
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №1
( с углубленным изучением отдельных предметов)»
Исследование эффективности действия ингибиторов
(исследовательская работа по химии)
Выполнила: Котова Екатерина,
обучающаяся 10 класса
Научный руководитель: Галкина Ю.Н.,
учитель химии
Моршанск, 2010 г.
Содержание
I. Введение _____________________________________3
II. Основная часть _______________________________4
1. Теоретическая часть:
А) Термин « коррозия»_____________________________ 4
Б) Виды коррозий__________________________________4
В) Защита металлов от коррозии______________________7
Г) Зависимость скорости коррозии от ряда условий_____10
Д) Вещества, изменяющие скорость коррозии _________ 12
2. Практическая часть:
А) Методика исследования__________________________13
Б) Результаты исследования_________________________15
III.Выводы _____________________________________ 18
IV.Заключение _________________________________19
V.Список используемой литературы________________20
VI.Приложение__________________________________21
I. Введение
Основной проблемой является то, что, несмотря на широкое внедрение в нашу сегодняшнюю жизнь полимерных материалов, стекла, керамики, основным конструкционным материалом продолжает оставаться железо и сплавы на его основе. И так как избавиться от коррозии совсем невозможно, то, зная процессы, происходимые при коррозии, нужно искать новые и совершенствовать старые способы защиты от неё.
В связи с этим, проблема, которую мы хотели бы затронуть в работе: Защита металлов от коррозии с помощью ингибиторов.
Приступая к работе, мы выдвинули следующую гипотезу:
– Ингибиторы замедляют процесс коррозии металлов в среднем в два раза.
Актуальность таких исследований на современном этапе развития химической технологии очевидна. Потери от коррозии колоссальны. Каждая шестая домна работает лишь для того, чтобы восполнить потери металлов, «съеденных» ржавчиной. Но вред, наносимый коррозией, не сводится только к потере металла вследствие его разрушения (прямые потери), больший вред наносят косвенные потери. Гибнет труд людей, затраченный на обработку металла и создание тех или иных машин и механизмов. Кроме того, немало труда приходится затратить, чтобы заменить «изъеденные» коррозией детали новыми. Например, для замены проржавевших под землей водопроводных труб приходится копать глубокие траншеи. В городе для этого надо сначала взломать асфальт, который лишь иногда лишь недавно был уложен. Чтобы сменить детали, например, химических или нефтехимических аппаратов, приходится останавливать производство, а вынужденная остановка даже на сутки обходится большими потерями готовой продукции. При коррозии загрязняется окружающая среда (например, за счет утечки газа, нефти), может произойти снижение качества или порча выпускаемой продукции и т.д. Таким образом, потери от коррозии в сотни раз превосходят стоимость металла.
Практическая значимость наших исследований заключается в приобретении знаний
· О коррозионном разрушении металлов под действием окружающей среды
· Способах защиты от коррозии
· О влиянии ингибиторов на коррозионный процесс
· Об эффективности влияния некоторых ингибиторов
Объект исследования – коррозия железа.
Предмет исследования – ингибиторы коррозии.
Цель исследования – изучение эффективности действия ингибиторов
Задачи исследования
· Познакомиться с явлением коррозии металлов
· Выяснить какие вещества могут быть использованы в качестве ингибиторов коррозии
· Определить эффективность действия ингибиторов
· Построить диаграммы зависимости действия ингибиторов от времени
Ход исследования
· Изучить литературу по данной тематике
· Ознакомиться с методикой проведения опытов
· Проделать опыты
· Сделать выводы и обобщения
II.Основная часть
1.Теоретическая часть
А) Что такое коррозия?
Коррозия (от латинского слова «коррозио» - разъедание) – это самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой.
Б) Виды коррозии.
Химическая коррозия
Химическая коррозия протекает в сухих газах (газовая коррозия) при повышенных температурах и не сопровождается возникновением электрического тока. Она протекает по механизму гетерогенных реакций. Химическая коррозия протекает не только в сухих газах, но и в неэлектролитах. Отличительной особенностью химической коррозии является то, что продукты коррозии (например, оксидные пленки) носят первичный характер, то есть образуются непосредственно в местах соприкосновения метала с агрессивной средой. Поэтому скорость коррозионного процесса определяется не только природой металла, но и свойствами образовавшихся оксидных пленок. Например, на поверхности щелочных и щелочно-земельных металлов в процессе окисления кислородом воздуха образуются толстые, рыхлые оксидные пленки, через которые свободно проникает кислород, поэтому они не защищают металл от разрушения. А на поверхности цинка, алюминия, никеля, хрома и других металлов формируются тонкие, эластичные и сплошные оксидные пленки, которые изолируют металл от контакта с агрессивной средой. Именно эти металлы применяют в качестве легирующих добавок к стали (для повышения жаростойкости сплавов) и для нанесения защитных покрытий на изделия, работающие в условиях газовой коррозии.
Электрохимическая коррозия
Электрохимическая коррозия протекает в растворах электролитов (кислоты, основания, соли, морская и речная вода, влажная почва, атмосфера любого влажного газа) и сопровождается возникновением электрического тока. Она протекает по механизму гальванического элемента.
При электрохимической коррозии в отличие от химической, продукты коррозии (осадки в нейтральных средах) образуются за счет вторичных процессов, то есть они образуются не непосредственно на поверхности коррозирующего металла, а в объеме раствора, поэтому обладают более низкими защитными свойствами, чем первичные пленки, образующиеся на поверхности металла при химической коррозии.
Биокоррозия
Еще один интересный вид коррозии металлов – биокоррозия. Это новый вид коррозии. Известно, что коррозия протекает при участии микроорганизмов.
Они выделяют продукты, которые могут вызывать коррозию. Биокоррозия изучена еще недостаточно. Но интересно отметить особый вид бактерий - так называемых железных, которые усваивают железо в виде ионов, для чего они выделяют продукты, разрушающие металл, переводящий его в соединения железа, то есть в окисленное состояние.
Вопрос о том, как защищать металлы от разрушения, является столь же древним, как и их применение. Можно сказать, что вместе с использованием металла возникла необходимость и его защиты. Однако научные методы защиты металлов от коррозии возникли много позже.
Разработка методов защиты тесно связана с изучением причин, вызывающих коррозию металлов. Первые научные основы изучения коррозии металлов были заложены гениальным русским ученым М.В.Ломоносовым.
Наряду с разработкой методов защиты металлов от коррозии в настоящее время получают новые вещества, которые с успехом могут заменять в некоторых изделиях металлы. Следовательно, борьба с коррозией металлов идет не только по пути защиты самих металлов, но и замены их коррозионно-стойкими материалами.
Все применяемые методы защиты металлов можно разделить на две группы.
К первой группе относят различного рода покрытия. Сущность этого метода сводится к тому, что на поверхности металла создается та или иная пленка, защищающая поверхность металла от контакта с внешней средой. Покрытия в свою очередь делятся на металлические и неметаллические.
Ко второй группе относят электрохимические методы защиты.
Итак, первая группа защиты. Роль покрытия как средства защиты от коррозии большей частью сводится к тому, чтобы изолировать металл от внешней среды.
В качестве металлических покрытий корпусов изделий используют хром, никель, серебро и золото. Хромированные, никелированные, серебрённые и золочёные изделия имеют красивый внешний вид и в то же время коррозионно-стойки. Этот метод получил название гальванотехники. Часто металлические изделия, как говорят, «работают» в жидких средах, например в воде, растворах кислот, щелочей и солей. Здесь уже необходимы более сложные методы защиты. Из металлических покрытий для изделий, «работающих» в воде или во влажной атмосфере, широко применяют цинковые или оловянные покрытия: оцинкованные ведра, луженая посуда.
Из неметаллических покрытий часто используют покрытие эмалью, кислотоупорным лаком, различными смолами нефтяного происхождения, резиной. Многие из этих неметаллических покрытий являются очень стойкими, как, например, резина или фенолформальдегидные смолы, которые предохраняют металл даже в таких средах, как растворы соляной кислоты любой концентрации.
Часто на поверхность металла искусственно наносится оксидная пленка другого металла, которая является прочным веществом. Образование таких пленок получило название оксидирование. Оксидирование как средство защиты приборов, станков, а также основных частей огнестрельного оружия получило широкое распространение. Оксидирование не только играет защитную роль, но и придает изделиям красивую черную или синюю окраску. Поэтому очень часто оксидирование называют воронением, потому что окраска изделия в этом случае напоминает цвет воронова крыла.
Таким образом, мы видим, что выбор покрытия зависит от того, в каких условиях будет находиться изготовляемое металлическое изделие.
Из коррозионных разрушений металла мы наиболее часто встречаемся с ржавлением железа. Борьба с ржавлением железа и изделий из него имеет наибольшее значение в народном хозяйстве.
Рассматривая процесс ржавления металлов, я отметила, что если железо находится в контакте с другими металлами, то последние могут сильно изменить скорость ржавления. В одних случаях – контакта железа с медью (контакт с менее активным металлом) – скорость ржавления увеличивается, а в других, когда железо находится в контакте с алюминием, цинком (контакт железа с более активным металлом), наоборот, ржавление замедляется или полностью прекращается. Метод защиты металла способом создания гальванической пары получил название протекторная защита.
Цинк – один из наиболее широко применяемых металлов в протекторной защите. Кроме цинка, для этих целей используют сплавы магния и алюминия. Выбор протектора зависит от характера структуры металла, из которого изготовлена сама конструкция, а также условий, в которых находится данный металл.
Протекторную защиту обычно применяют для крупных сооружений: нефтехранилищ, танкеров, заводской арматуры, электрических кабелей, находящихся под землей, водопроводных труб, корпусов морских судов.
Г) Зависимость скорости коррозии от ряда условий.
Многие металлические предметы, которые мы повседневно применяем, не подвергают видимой коррозии, в то время как нож, к нашему огорчению, покрывается некрасивыми бурыми пятнами ржавчины; окрашенные трубы парового отопления, находясь в комнате, не имеют следов видимых коррозионных разрушений, в то время как эти же трубы, если их закрыть в почву, через некоторое время настолько разрушаются ржавчиной, что становятся непригодными к употреблению. Коррозия металла зависит от условий, в которых он находится.
Металлы стремятся перейти в свое естественное состояние, т. е. В котором они находятся в природе. И действительно, даже в условиях сухого воздуха при комнатной температуре блестящая поверхность металла тускнеет и становится матовой. При тщательной осмотре поверхности металла можно обнаружить, что она покрыта тончайшей пленкой оксидов – продуктов химического взаимодействия металлов и кислородов воздуха.
С повышением температуры скорость коррозии увеличивается. Кислород воздуха прежде всего взаимодействует с поверхностными атомами металлического изделия, образуя пленку оксидов. Эта пленка может быть той или иной прочности, в случае образования прочной пленки она препятствует дальнейшему коррозионному процессу. Особенно прочные пленки может получаются на поверхности алюминия и цинка. Такого рода пленки получили название защитных. Таким образом, коррозия не только разрушает металл, но и защищает его. При нагревании слитков железа или стали до температуры 1200 – 1300 С могут получатся пленки толщиной в несколько миллиметров, а иногда при нагревании больших слитков толщина слоя оксида достигает 1 см.
На металл оказывают влияние не только кислород воздуха, но и газы и пары воды, находящиеся в атмосфере. При соприкосновении поверхности металла с атмосферой , в котором содержится кислород, даже в случае полного отсутствия влаги в атмосфере на поверхности металла возникают пленки, появления которых и есть один из видов коррозии. Эти пленки у разных металлов их образования неодинаковы.
Д) Вещества, изменяющие скорость коррозии. (Приложение №1)
«Ингибиторы» (от латинского слова inhibire – тормозить). Ингибитор, добавленный в небольшом количестве, задерживал процесс растворения металла в кислоте (коррозию металла) и при этом не меняет свойства кислоты.
Например – диэтиламин. Диэтиламин в сотни раз ускоряет растворение цинка в кислоте и в 10 – 12 раз замедляет скорость растворения железа. Таким образом, диэтиламин – вещество, которое делает более «агрессивной кислоту по отношению к цинку и «укрощает» коррозийную активность кислоты по отношению к железу.
Нитротолуол – ускоряет растворение железа в серной кислоте в 10 – 15 раз.
Пассиваторы – вещества, которые замедляют разрушение металла в воде и в водных растворах солей и нейтральных растворах).
§ Фосфат натрия
§ Дихромат калия
§ Сода
§ Растворимые стекла
2.Практическая часть
А) Методика исследования.
Исследование эффективности действия ингибиторов.
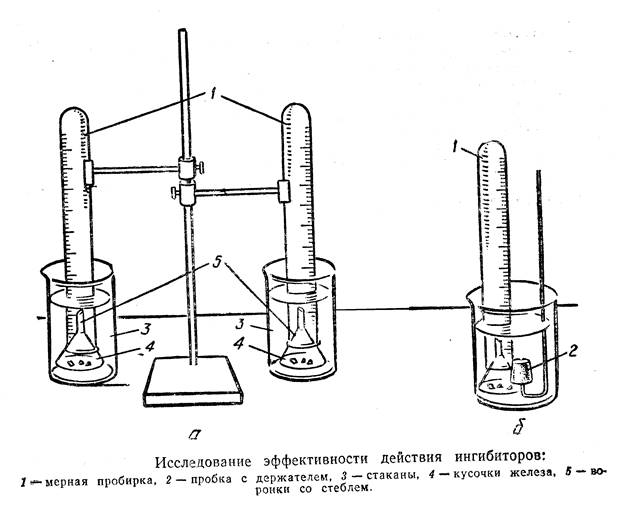
Оборудование: мерная пробирка (4 шт.); стакан на 50 мл (4шт.); штатив лабораторный; воронка коническая (4 шт.). (Приложение №2)
Реактивы и материалы: кусочки железа (скрепки); серная кислота (1:5), ингибиторы: формалин, анилин, йодид калия.
Заполняем пробирки раствором серной кислоты 1:5 и закрываем (осторожно!) пробкой с держателем.
На дно стаканов помещаем кусочки металла (скрепки) и накрываем их воронками. В стакан наливаем одинаковых объем серной кислоты так, чтобы уровень кислоты был на 1 – 2 см выше стебля воронки: в первую воронку – без ингибитора, во вторую третью и четвертую с ингибитором (формалин, анилин и йодид калия соответственно).
Пробирки опрокидываем в стаканы и под кислотой (осторожно!) вынимаем пробки; надеваем пробирки на отростки воронок и закрепляем в штативе.
Ведем наблюдение за протеканием эксперимента и через определенные интервалы времени отмечаем объем выделившегося водорода в каждой пробирке.
Результат в каждой мерной пробирке записываем отдельно. По полученным данным строим графики скорости коррозионного процесса. На оси абсцисс откладываем время в минутах; на оси ординат – объем водорода в миллилитрах.
Сравниваем графики между собой.
В конце отсчета (когда почти вся пробирка без ингибитора будет заполнена водородом) производим окончательные измерение объема выделившегося водорода в каждой пробирке.
Эффективность действия ингибитора определяем по формуле:
![]() ,
,
Где V0 – объем выделившегося водорода из кислоты без ингибитора, V – объем выделившегося водорода из кислоты с ингибитором.
В качестве ингибитора можно брать и другие вещества, например раствор бромида калия, крахмал желатин.
А) Результаты исследования
|
Время |
Опыт№1 |
Опыт №2 |
Опыт №3 |
Опыт №4 |
|
5 мин. |
1 |
0,8 |
1 |
1 |
|
10 мин. |
1,9 |
1,1 |
1,8 |
1,3 |
|
20 мин. |
3,1 |
1,3 |
1,9 |
1,3 |
|
30 мин |
5,9 |
1,4 |
2,8 |
1,3 |
|
50 мин. |
11,1 |
2,1 |
3,8 |
1,8 |
|
1 час 10 мин. |
18,1 |
2,9 |
6 |
1,9 |
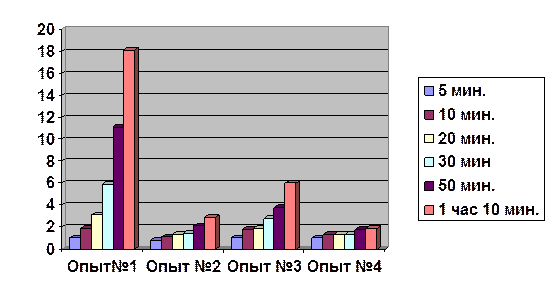
Эффективность действия ингибиторов (мл)
|
Время |
Формалин |
Анилин |
Йодид калия |
|
5 мин. |
1,25 |
1 |
1 |
|
10 мин. |
1,73 |
1,05 |
1,46 |
|
20 мин. |
2,38 |
1,63 |
2,38 |
|
30 мин |
4,21 |
2,1 |
4,54 |
|
50 мин. |
5,28 |
2,92 |
6,2 |
|
1 час 10 мин. |
6,24 |
3,01 |
9,53 |
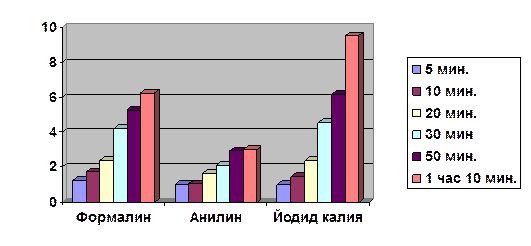
Среднее значение действия ингибиторов
|
Формалин |
Анилин |
Йодид калия |
|
4,28 |
2,38 |
4,8 |
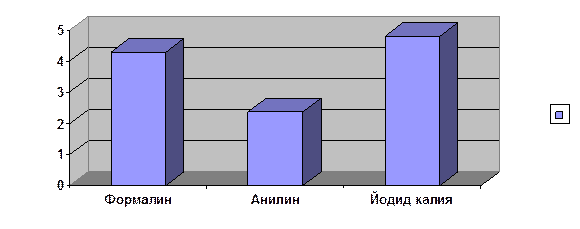
Данные ингибиторы замедляют коррозию металлов в среднем~3,82 раза
III. Выводы
В результате данной работы мы выяснили:
· что представляет собой коррозия металлов
· какие виды коррозии существуют
· какие существуют методы защиты от коррозии
· какие вещества могут быть использованы в качестве ингибиторов коррозии
· определили эффективность действия ингибиторов
· самым эффективным ингибитором оказался йодид калия, наименее эффективным - анилин
· построили диаграммы зависимости действия ингибиторов от времени
· в результате проделанной работы удалось выяснить, что использованные ингибиторы замедляют скорость коррозии в среднем в 3,82 раза, что несколько противоречит выдвинутой гипотезе.
IV.Заключение
В своей работе я не ставила цель исследовать все существующие виды коррозии, их гораздо больше, чем я изложила. Но даже те виды коррозии, которые здесь представлены, уже говорят о значимости этой проблемы и путях ее решения. При изучении химии в дальнейшем мне еще предстоит более детальное знакомство с явлением разрушения металла под воздействием различных факторов. Но уже те немногие сведения, которые собраны здесь, думаю, заинтересуют тех ребят, которые прочтут данную работу, и помогут им в дальнейшем защитить свой собственный автомобиль, крышу дома, хозяйственный инвентарь от коррозии. А это уже не мало. Значит, есть результат от работы.
V. Список использованной литературы
1. Аликберова Л.Ю. «Занимательная химия», М., «АСТ-ПРЕСС», 1999 г.
2. Балезин С.А. «От чего и как разрушаются металлы», М., «Просвещение», 1976 г.
3. Большая детская энциклопедия. Химия. М., «Русское энциклопедическое товарищество», 2001 г.
4. Глинка Н.Л. «Общая химия», Ленинград «Химия», 1974 г.
5. Назарова Т.С., Грабецкий А.А., Лаврова В.Н. Химический эксперимент в школе .М.: «Просвещение», 1987 г.
6. Периодическая печать.
7. Пилипенко А.Т. и др., «Справочник по элементарной химии», Киев, «НАУКОВА ДУМКА», 1978 г.
8. Энциклопедический словарь юного химика, М., «Педагогика-Пресс», 1999 г.
Приложение №1
Вещества, изменяющие скорость коррозии
 |
|
Ингибиторы |
Стимуляторы |
Пассиваторы |
|
Тормозит коррозию металлов в кислотах, при этом свойства кислот не изменяет: - раствор йода в иодиде калия; - уротропин. |
Вещества, ускоряющие коррозию металлов в кислотах: -диэтиланилин (в 100 раз увеличивает коррозию цинка и в то же время уменьшает коррозию железа в 10-15 раз); -нитротолуол (ускоряет растворение железа в серной кислоте в 15 раз). |
Замедляют разрушение металла в нейтральных растворах; -фосфат натрия- Na3 PO4; -дихромат калия- K2Cr2 O7 ; -сода- Na2CO3 ; -растворимые стекла- Na2 SiO3 ;
|
Приложение №2
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.