
Публикация является частью публикации:
Урок по химии в 8 классе
«Путешествие в мир кислот»
Карташова Людмила Александровна
МАОУ СОШ № 27 г. Балаково
Цель урока: создание условий для освоения учащимися представлений о кислотах как о классе неорганических веществ, для формирования умения распознавать кислоты по формуле, названию и с помощью индикаторов, применять знания об общих свойствах кислот для безопасного использования их в повседневной жизни.
Ход урока
I. Организационный момент.
II. Мотивация (самоопределение)
Любой человек, невзирая на возраст, любит путешествовать! Вот и вас я приглашаю совершить путешествие. Давайте представим, что мы сели в поезд. Вы пассажиры, а я проводник, у проводника есть помощники. А ещё у нас будут путевые дневники – это листы, которые я вам приготовила, потом вы вклеите их в свои тетради.
III. Актуализация знаний.
Мы отправляемся в путь. И первая станция Загадочная.
На этой станции Вам необходимо узнать
• тему путешествия
• цель путешествия
• маршрут путешествия
? Ребята, какие вы знаете вещества?
(Простые и сложные)
Распределите вещества на две группы. H2, Ag2O, HClO2, He, O3, HBr, NaOH, HNO2, H2S, N2
? Ребята, мы с вами приступили к изучению классов неорганических соединений. С какими классами веществ мы уже успели познакомиться? (Оксиды, гидриды и летучие водородные соединения, основания).
? Распределите вещества на три группы
Са(ОH)2, Ag2O, Сl2О7, NaOH, H2SО4, H3PО4, Nа2О, N2О5, HCl, Fe(OH)3
Какие вещества называют оксидами?
Какие вещества относят к основаниям?
Название третьей группы мы узнаем, сопоставив формулы веществ и их названий
|
Оксиды |
Основания |
? |
|
Ag2O, Сl2О7, Nа2О, N2О5, |
Са(ОH)2, Fе(ОН)3, NаОН |
НСl, Н3PО4, Н2SО4 |
IV. Изучение нового материала
В третью группу вы поместили пока что незнакомые вам вещества, которые относятся к классу кислот. Именно с веществами этого класса мы и будем знакомиться сегодня. Итак, тема нашего урока «Путешествие в мир кислот». Запишите тему урока в путевой лист.
Что же нам необходимо знать о кислотах? (Состав, формулы, названия, классификации, значение, правила техники безопасности).
Итак, мы прибываем на станцию Информационная
Вы видите формулы трех кислот: хлороводородной НСl, серной Н2SО4 и фосфорной кислот Н3РО4. Что общего в их составе?
Наличие атомов водорода.
Остальная часть называется кислотным остатком.
Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
Какие кислоты вы знаете?
Лимонная, виноградная, яблочная, муравьиная, молочная
Всё это органические кислоты.
Познакомьтесь с некоторыми неорганическими кислотами
H2SO3 – сернистая
HNO3 – азотная
HCl – cоляная (хлороводородная)
H2SO4 - серная
H2SiO3 – кремниевая
H2CO3 – угольная
H3PO4 – фосфорная
H2S – сероводородная
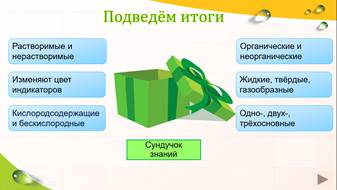
Первая классификация кислот.
Кислоты бывают органическими и неорганическими. А также растворимыми и нерастворимыми. Кстати, способности растворяться в воде – ещё один признак классификации кислот. По этому признаку все кислоты подразделяют на две группы: растворимые и нерастворимые. Узнать это можно в таблице растворимости кислот, солей и оснований. Посмотрите, какая кислота нерастворимая?
Кремниевая

Обратите
внимание по какому признаку разделены кислоты?
Правильно, кислотные остатки серной, азотной, фосфорной и угольной кислот содержат кислород, а кислотные остатки хлороводородной, бромоводородной, сероводородной и фтороводородной кислот кислорода не содержат.
Наличие кислорода или его отсутствие – один из признаков классификации кислот. По этому признаку кислоты подразделяют на две группы: бескислородные и кислородсодержащие. Это вторая классификация.
? Посмотрите на формулы кислот на доске. Они распределены на три группы по определенному признаку. Как вы думаете, что это за признак?

Основность – число атомов водорода в кислоте.
По числу атомов водорода можно определить общий заряд кислотного остатка, который при растворении в воде образует отрицательно заряженный ион.
Водород при растворении образует положительно заряженный ион, заряд которого равен +1. Обозначение заряда иона имеет свои особенности.
Степень окисления элементов в кислотах и соответствующие кислотам оксиды.
+1 −1 +1 − 2 +1 х − 2 +5 − 2
НСl Н2S Н3РО4 → Р2О5
(+1) · 3 + х + (−2) · 4 = 0
х − 5 = 0
х = + 5
+1 + 5 − 2 +5 − 2
НNО3 → N2О5
? Как вы думаете, в каких агрегатных состояниях встречаются кислоты?
Следующая классификация кислот по агрегатному состоянию. Кислоты встречаются жидкие – например, серная, азотная, твёрдые – фосфорная, кремниевая.
V. Первичная проверка понимания
Мы познакомились с основными характеристиками кислот. Дайте характеристику кислот по плану:
1. Наличие кислорода
2. Основность
3. Растворимость
4. Степень окисления элементов, образующих кислоту
5. Заряд иона
6. Соответствующий оксид
Первый вариант – H2SO4, второй – H2SiO3
Обменяйтесь тетрадями и проверьте правильность выполнения работы.
Мы прибываем на станцию Биологическая
Помощник проводника. В холодное зимнее время организм нуждается в витаминах для поддержания иммунитета. Все мы знакомы с аскорбиновой кислотой, поставщиком витамина С. Аминокислоты образуют множество белков, а из них, в свою очередь, строятся все ткани нашего организма. Соляная кислота – сильнейший бактерицид, под действием которого большинство бактерий, попавших в желудок, погибают. Молочная кислота образуется в мышцах при нагрузках.
Следующая станция Историческая.
Помощник проводника познакомит вас с историей открытия некоторых кислот. А вы запишите в путевые дневники даты открытия кислот.
Помощник проводника. Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Знаете ли вы, что слово «уксус» происходит от греческого слова «оксос», означающий «кислый»? Почему уксусная кислота оказалась первой, понять нетрудно. С древнейших времён люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его, видимо, выливали, потом научились использовать как лекарство, приправу к пище, как растворитель красок.
С серной кислотой люди познакомились значительно позднее, примерно в 10 в. Честь её открытия приписывается персидскому химику Абубекеру аль Рези. Но это установлено не совсем точно. По крайней мере серную кислоту человечество знает около 1000 лет. Серную кислоту выделили из купоросов, например, из железного купороса, и соответственно назвали купоросным маслом.
Соляная и азотные кислоты были выделены и определены химиками примерно в 15 веке.
Соляную кислоту называли соляным спиртом, а азотную – селитряной водкой. Получали эти кислоты с помощью серной кислоты, которую потом поэтично стали называть «матерью всех кислот»
Угольную кислоту получил впервые в конце 15 века Джозеф Пристли, английский химик, он же священник. Для этого он растворял в воде углекислый газ. Раствор углекислого газа в воде назвали содовой водой. А так как она получила широкое применение как напиток, за это открытие Пристли наградили золотой медалью.
К концу 18 века химики уже знали более десятка кислот.
Мы прибываем на станцию Экспериментальная
? Каким образом, не прибегая к экстремальным методам, можно определить кислоту?
Помощник проводника. Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, случайно пролил её. Кислота попала на сине-фиолетовые лепестки фиалки. Спустя некоторое время лепестки стали ярко-красными. Это явление удивило Р.Бойля, и он тут же провёл серию опытов с разными кислотами и цветками разных растений. Оказалось, что и васильки, и розы, и цветки некоторых других растений изменяли свою окраску при действии кислот. Особенно интересным оказался фиолетовый настой лакмусового лишайника. В растворе кислот он становился красным. После некоторых раздумий такие вещества Р.Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот.
ИНСТРУКТИВНАЯ КАРТА:
Форма работы: парная. Время работы – 8-10 минут.
Задание: Исследовать окраску индикаторов в кислотных средах.
Оборудование и реактивы:
3 пробирки с соляной и 3 пробирки с серной кислотами, жидкие индикаторы: лакмус, фенолфталеин и метилоранж, универсальный индикатор.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1. В пробирку с соляной кислотой добавьте каплю фенолфталеина. Результаты наблюдений запишите в таблицу. Во 2-ю пробирку с соляной кислотой добавьте каплю метилоранжа. Результаты наблюдений запишите в таблицу. В 3-ю пробирку с соляной кислотой добавьте каплю лакмуса. Результаты наблюдений запишите в таблицу.
2. В пробирку с серной кислотой добавьте каплю фенолфталеина. Результаты наблюдений запишите в таблицу. Во 2-ю пробирку с серной кислотой добавьте каплю метилоранжа. Результаты наблюдений запишите в таблицу. В 3-ю пробирку с серной кислотой добавьте каплю лакмуса. Результаты наблюдений запишите в таблицу.
Действие кислот на индикаторы
|
Индикатор |
Окраска индикатора в воде |
Окраска индикатора в растворе соляной кислоты (HCl) |
Окраска индикатора в серной кислоте H2SO4 |
|
Лакмус |
фиолетовая |
|
|
|
Фенолфталеин |
бесцветная |
|
|
|
Метилоранж |
оранжевая |
|
|
Обсуждение результатов и формулирование выводов:
?
Какие индикаторы изменили свой цвет в кислотах? (Лакмус и метилоранж).
? Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах?
(Да).
? Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной
кислотах?
(Лакмус стал красным, а метилоранж - розовым).
На основании проведенных опытов сделаем выводы:
независимо от вида кислоты (органической или неорганической) индикаторы изменяют
свой цвет одинаково; а это означает, что все кислоты обладают сходными
свойствами.
? С чем же это связано? (С наличием
атомов водорода).
Станция Познавательная
Во время грозы воздух горит вокруг плазменного шнура молнии, образуются оксиды азота. Они, растворяясь в воде, дают азотную кислоту. При извержении вулкана в атмосферу выбрасываются оксиды серы, образующие серную кислоту. Кислотные дожди – одна из экологических проблем. Все эти кислоты выпадают на землю в виде кислотных дождей. Мы знаем, сколько вреда наносят такие дожди:
• разрушают почвы
• угнетают развитие растений
• разрушают здания, скульптуры.
А смогут ли кислоты разрушить наши зубы? Ведь зубы по составу схожи с мрамором. Опустим универсальный индикатор в стакан с напитками «Фантой», «Спрайтом», «Кока-колой». Универсальный индикатор приобрёл розовую окраску, значит напитки имеют слабо-кислую среду и могут со временем стать причиной разрушения зубов.
Помощник проводника
Если вы присядете вблизи муравейника, то надолго запомните жгучие укусы его обитателей. Муравей впрыскивает в ранку от укуса яд, содержащий муравьиную кислоту. Муравьиной кислотой обусловлено жжение крапивы, ее выделяют некоторые гусеницы.
В волосках крапивы также содержится жгучая муравьиная кислота
Ботаникам известно более 800 видов растений, вырабатывающих синильную кислоту. Многие растения выделяют кислоты, угнетая ими другие виды растений.
Тропический паук стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты. Плоские тысяченожки используют пары синильной кислоты. Некоторые жуки выстреливают струйкой разбавленной серной кислоты.
Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Однако лоси жуют мухоморы и не погибают от этого. Скорее – наоборот: мухоморами они лечат какие-то свои «хвори».
VI. Первичное закрепление
Мы прибываем на станцию Итоговая
 Разгадайте ребус. С каким
классом неорганических соединений мы сегодня познакомились?
Разгадайте ребус. С каким
классом неорганических соединений мы сегодня познакомились?
Выберите из з-х строк строку, где написаны формулы кислот.
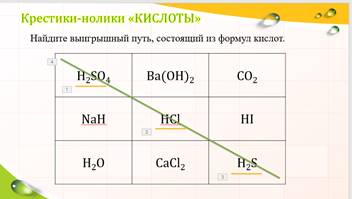
Найдите
выигрышный путь, состоящий из формул кислот
Подведем игоги
VII. Рефлексия
Наше путешествие закончилось.
Продолжите фразу
1. Сегодня на уроке мы узнали…
2. Мне было непонятно/понятно…
3. Для меня этот урок…
4. Интерес вызвало, то …
5. Затруднения возникли, когда…
VIII. Домашнее задание. §20, с. 102-107, выучить формулы и названия кислот, задание 1, с.107 (учебник).
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.