
Ионная и ковалентная химическая связь
Каждый атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Благодаря зарядам ядра и электронов между соседними атомами возникают электростатические силы: притяжения и отталкивания. Если сближение атомов приводит к понижению энергии образующейся частицы (по сравнению с энергиями отдельных атомов), то образуется химическая связь.
Химическая связь – это силы взаимодействия, удерживающие частицы друг около друга.
Ученые доказали, что главную роль в образовании связи играют электроны, которые меньше всего связаны с ядром, т. е. расположенные на внешней электронной оболочке. Такие электроны называют валентными.
В атомах элементов главных подгрупп все валентные электроны расположены на последнем (внешнем) электронном слое и их число равно номеру группы.
В атомах элементов побочных подгрупп валентные электроны расположены, как правило, на двух последних электронных слоях, но их число тоже равно номеру группы, к которой относится элемент.
Например, в атоме калия один валентный электрон, в атоме марганца – 7 валентных электронов (рис. 1).
|
|
|
|
Рис. 1. Электронные конфигурации атомов калия и марганца |
|
Согласно теории химической связи наиболее устойчивыми являются внешние оболочки из восьми электронов – октет (если в атоме только 1 электронный слой, то для него наиболее устойчиво двухэлектронное состояние – дуплет).
Образование устойчивой электронной оболочки может происходить несколькими способами, поэтому различают разные виды химической связи.
Ковалентная связь – химическая связь, образованная перекрыванием электронных облаков атомов. Электронные облака (электроны), обеспечивающие связь, называются общей электронной парой.
Различают два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме каждый атом предоставляет по одному электрону для образования общей пары:
А·+ В = А:В
При донорно-акцепторном механизме один атом предоставляет уже имеющуюся у него пару электронов (донор), а другой атом предоставляет свободную орбиталь для этой пары электронов (акцептор):
А: + □В = А:В
Связь, осуществляемая за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной.
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковыми значениями относительной электроотрицательности, например в молекулах хлора, азота, между атомами углерода в этилене (табл. 1).
|
Молекулярные формулы |
Электронные формулы |
Графические формулы |
|
Cl2 |
|
|
|
N2 |
|
|
|
C2H4 |
|
|
Табл. 1. Примеры соединений, в которых присутствуют ковалентные неполярные связи
Число общих электронных пар зависит от того, сколько электронов не хватает каждому атому для октета. Хлор – элемент VII-А подгруппы, следовательно, на его внешнем электронном слое 7 электронов. До октета не хватает одного электрона, значит, будет образована одна общая пара электронов в Cl2. Между атомами азота в молекуле N2 образуются три общие электронные пары, т. е. тройная ковалентная связь. Между атомами углерода в этилене образуется двойная ковалентная связь.
Обратите внимание, что из каждого правила есть исключения и правило октета не всегда выполняется (пример – молекула сернистого газа SO2).
Ковалентная полярная связь осуществляется за счет образования общих электронных пар, которые смещаются к атому более электроотрицательного элемента. При этом на атомах образуются частичные заряды: δ+ и δ- (рис. 2).
![]()
Рис. 2. Образование ковалентной связи в молекуле хлороводорода
Чем больше разность электроотрицательностей атомов элементов, тем больше полярность связи.
Ионная связь – предельный случай ковалентной полярной связи.
Ионная связь – это электростатическое притяжение между ионами, образованными путем практически полного смещения электронной пары к одному из атомов. Этот тип связи образуется, если разность значений относительной электроотрицательности атомов велика (как правило, больше 1,7 по шкале Полинга).
Ионная связь обычно образуется между типичным металлом и типичным неметаллом. Например, в хлориде натрия NaCl атом натрия свой 1 валентный электрон отдал атому хлора и превратился в катион, а атом хлора, приняв 1 электрон, превратился в анион. Катион с анионом притягиваются, и образуется ионная связь (рис. 3).
![]()
Рис. 3. Образование ионной связи в хлориде натрия
Соли, щелочи, основные оксиды, карбиды, нитриды относятся к ионным соединениям. Все эти вещества при обычных условиях твердые, с высокими температурами плавления (как правило, 700–1000 °С), их растворы и расплавы электропроводны.
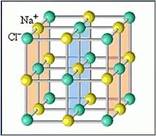 Тугоплавкость ионных соединений
объясняется тем, что ион может притягивать к себе противоположно заряженные
ионы в любых направлениях и большом количестве. Следовательно, ионы прочно
соединяются в кристаллическую решетку. Например, в кристаллической решетке
поваренной соли один катион натрия окружен шестью анионами хлора, а каждый
анион хлора окружен шестью катионами натрия (рис. 4). Таким образом, весь
кристалл поваренной соли представляет собой как бы одну огромную макромолекулу,
состоящую из огромного числа ионов. И химическая формула NaCl определяет только
их соотношение в кристалле. При обычных условиях молекулы NaCl не существует.
Тугоплавкость ионных соединений
объясняется тем, что ион может притягивать к себе противоположно заряженные
ионы в любых направлениях и большом количестве. Следовательно, ионы прочно
соединяются в кристаллическую решетку. Например, в кристаллической решетке
поваренной соли один катион натрия окружен шестью анионами хлора, а каждый
анион хлора окружен шестью катионами натрия (рис. 4). Таким образом, весь
кристалл поваренной соли представляет собой как бы одну огромную макромолекулу,
состоящую из огромного числа ионов. И химическая формула NaCl определяет только
их соотношение в кристалле. При обычных условиях молекулы NaCl не существует.
Рис. 4. Модель кристаллической решетки хлорида натрия
Донорно-акцепторный механизм образования связи
В одном веществе могут реализовываться сразу несколько типов химической связи. Например, в хлориде аммония присутствуют ковалентные связи, образованные по обменному и донорно-акцепторному механизму, а также ионная связь между катионом аммония и хлорид-ионом (рис. 5).
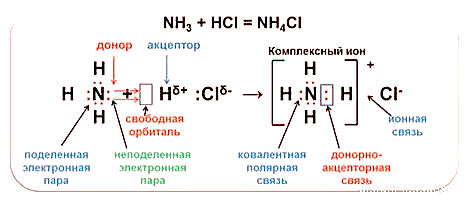
Рис. 5. Образование химических связей в хлориде аммония
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.