
ИНСТИТУТ СОВРЕМЕННОГО ОБРАЗОВАНИЯ
Педагогическое образование: теория и методика преподавания химии в образовательных организациях в условиях реализации ФГОС
Работа выполнена в рамках профессиональной переподготовки по программе:
«Учитель химии»
По теме: «История важнейших открытий в неорганической химии»
Автор:
Сухорукова Анастасия
Андреевна
Волжский 2020 г.
Содержание:
|
1. Введение |
3 |
|
2. Глава 1. Предпосылки возникновения химии, как науки. Этапы развития неорганической химии в мире. |
5 |
|
3. Глава 2. Вклад русских ученых в развитие неорганической химии. |
13 |
|
4. Глава 3. Периодический закон Дмитрия Ивановича Менделеева. |
19 |
|
5. 3.1. Биография Д. И. Менделеева |
19 |
|
6. 3.2. Открытие периодического закона. |
20 |
|
7. 3.3. История открытия таблицы периодической системы химических элементов |
22 |
|
8. 3.4. Открытие новых химических элементов после создания Периодического закона Д.И. Менделеевым |
25 |
|
9. Глава 4. Роль неорганической химии в современном мире |
30 |
|
10. 4.1. Химия прекурсоров
|
31 |
|
11. 4.2. Кристаллохимический дизайн |
35 |
|
12. 4.3. Неорганическая наномолекулярная и супрамолекулярная химия
|
37 |
|
13. 4.4. Соединения переменного состава
|
39 |
|
14. 4.5. Элементы в аномальных степенях окисления |
40 |
|
15. 4.6. Неорганические биоматериалы |
41 |
|
16. 4.7. Синтез с помощью физических воздействий |
43 |
|
17. Заключение |
46 |
|
18. Приложения |
48 |
19. Список используемой литературы 49
Введение
Наука о химических элементах и образуемых ими простых и сложных веществах (кроме соединений углерода, составляющих, за немногими исключениями, предмет органической химии) – это неорганическая химия — важнейшая область химии — наука о превращениях вещества, сопровождающихся изменениями состава, свойств и (или) строения. Неорганическая химия тесно связана, помимо органической химии, с другими разделами химии — аналитической химией, коллоидной химией, кристаллохимией, физической химией, термодинамикой химической, электрохимией, радиохимией, химической физикой; на стыке неорганической и органической химии лежит химия металлоорганических соединений и элементоорганических соединений.
Важнейшие достижения химии произошли в конце 18 — начала 19 вв. (создание кислородной теории горения, химической атомистики, открытие основных стехиометрических законов) явились результатами изучения неорганических веществ.
Одним из самых основных событием в развитии неорганической химии стало открытие в 1869 г великим русским химиком Д.И. Менделеевым периодического закона и создание Периодической системы химических элементов. Периодическая таблица химических элементов Д. И. Менделеева занимает всего один листок, но в этом листке заключено огромное количество информации. В каждой клетке таблицы расположены международный символ элемента, его название (в наших таблицах – на русском языке), его порядковый номер, относительная атомная масса (для нестабильных элементов – массовое число). Как правило, цветом выделена принадлежность элементов к тому или иному семейству, а также дано строение электронных оболочек атомов. И это всё видно сразу, невооруженным глазом, но если присмотреться и «капнуть глубже», то мы увидим всё изящество этого открытия.
Целью моей работы является рассказать о важнейших открытиях в неорганической химии, показать великих ученых, вложивших свой вклад в данную науку, показать роль химии в современном мире.
Задачи:
1. Рассказать про этапы развития неорганической химии;
2. Показать, какой вклад русских ученых внесли в развитие неорганической химии;
3. Описать важнейшие открытия неорганической химии;
4. Пояснить какую роль неорганическая химия занимает в современном мире.
Глава 1. Предпосылки возникновения химии, как науки. Этапы развития неорганической химии в мире.
Химия, как наука зародилась в Древнем Египте и использовалась в основном как прикладная наука: для получения каких-либо веществ и изделий, с новыми, еще неизвестными широкому кругу людей свойствами. Жрецы Древнего Египта использовали знания по химии для получения искусственных драгоценностей, бальзамирования людей, а также для того, чтобы показать свое могущество, показав какой-нибудь химический опыт на публике. Далее, начались многочисленные эксперименты по попытке превратить в золото другие вещества, поиск так называемого «философского камня», способного сделать это.
В Древнем Египте, жрецы блестяще владели прикладной химией, однако, не выделяли ее в самостоятельную область знаний. Химия в Древнем Египте входила в «священное тайное искусство» жрецов. Обработка и подделка благородных камней, бальзамирование трупов и т.д., сопровождались молитвами и заклинаниями.
Покровителем химии египтяне считали птицеголового бога Озириса.
Первым значительным представителем греко-египетской химии, имя которого дошло и до нас, был Болос из Менде (ок. 200 г. до н. э.), города в дельте Нила. В своих работах Болос. Он посвятил себя одной из важнейших задач химии - превращению одного металла в другой, и в частности превращению свинца или железа в золото (трансмутация). Согласно теории о четырех элементах, различные вещества на Земле различаются только по характеру сочетании элементов. Эту гипотезу можно было принять вне зависимости от атомистических воззрений, так как элементы могут смешиваться и как атомы, и как однородные вещества. Действительно, предположение о том, что сами элементы взаимозаменяемы, не было лишено оснований. Вполне можно было допустить, что вода при испарении превращается в воздух, который в свою очередь превращается в воду во время дождя. Дерево при нагревании превращается в огонь и дым (вид воздуха) и т. п. Болос в своих работах приводил подробные описания методов получения золота, но это не было мошенничеством. Можно, например, сплавить медь с металлическим цинком и получить латунь - сплав желтого цвета, т. е. цвета золота.
Весьма вероятно, что для древних исследователей изготовление металла цвета золота и означало изготовление самого золота.
В VII в. на мировой арене появились арабы. В 641 г. н. э. они вторглись в Египет и вскоре заняли всю страну, а через несколько лет такая же судьба постигла и Персию. Возникла огромная арабская империя. Подражая древним властителям, арабские халифы начали покровительствовать наукам, и в VIII-IX вв. появились первые арабские химики. Арабы преобразовали слово «химия» в «ал-химия».
Европейцы позднее заимствовали это слово у арабов, и в результате в европейских языках появились термины «алхимия» и «алхимик». Термин «алхимия» сейчас употребляют, когда говорят о периоде истории химии, охватывающем около двух тысячелетий, начиная с 300 г. и до 1600 г.
Впервые с химией арабы познакомились довольно необычным образом. В 670 г. корабли арабского флота, осаждавшего Константинополь, были сожжены «греческим огнем» - химической смесью, образующей при горении сильное пламя, которое нельзя погасить водой. По преданию, эту смесь изготовил занимавшийся химией Каллиник, который бежал из своего родного Египта, спасаясь от арабов.
Страницы европейской истории химии периода между 300 и 1100 гг. фактически пусты. После 650 г. развитие греко-египетской алхимии полностью контролировалось арабами, и так продолжалось в течение пяти веков. Следы этого периода сохранились в ряде химических терминов с арабскими корнями: alembic (перегонный куб), alkali (щелочь), alcohol (спирт), carboy (оплетенная бутыль), naphta (лигроин), zircon (цирконий) и др.
Самым талантливым и прославленным арабским алхимиком был Джабир ибн Хайян (721-815), ставший известным в Европе позднее под именем Гебер. Многочисленные труды Джабира написаны достаточно понятным языком. Джабир описал нашатырный спирт и показал, как приготовить свинцовые белила. Он перегонял уксус, чтобы получить уксусную кислоту - самую сильную из известных в то время кислот. Ему удалось получить слабый раствор азотной кислоты. Джабир изучал возможность трансмутации металлов, и эти его исследования оказали сильнейшее влияние на последующие поколения алхимиков. Джабир полагал, что ртуть является особым металлом, так как благодаря своей жидкой форме она содержит очень мало примесей. Столь же необычными свойствами обладает и сера: она способна воспламеняться (и к тому же она желтая, как и золото). Джабир считал, что все остальные семь металлов образуются из смеси ртути и серы, «созревающей» в недрах земли. Труднее всего образуется золото - наиболее совершенный металл. Поэтому, чтобы получить золото, необходимо найти вещество, ускоряющее «созревание» золота. В старинных преданиях говорилось, что это вещество представляет собой сухой порошок. Греки называли его xerion, или «сухой», арабы изменили его на al-iksir, и в конце концов в европейских языках появилось слово эликсир. В Европе это удивительное вещество получило название философского камня. (Вспомним, что до 1800 г. «философами» называли всех «ученых».) Эликсир должен был обладать и другими чудесными свойствами: излечивать от всех болезней и, самое главное, давать бессмертие. И в последующие столетия алхимики шли двумя параллельными путями: одни искали золото, другие - эликсир жизни, дававший бессмертие.
Другой арабский алхимик Ар-Рази (865-925), ставший известным в Европе под именем Разес, занимался медициной и алхимией. Он завоевал почти такую же известность, как и Джабир. Ар-Рази описал методику приготовления гипса и способа наложения гипсовой повязки для фиксации сломанной кости. Он изучил и описал металлическую сурьму. Джабир рассматривал серу как принцип горючести, ртуть как принцип металличности, Ар-Рази добавил к этим двум принципам третий - принцип твердости, или соль. Летучая ртуть и воспламеняющаяся сера образовывали твердые вещества только в присутствии третьего компонента - соли. Ар-Рази интересовался медициной больше, чем Джабир, но самым знаменитым врачом был бухарец Ибн-Сина (ок. 980-1037), гораздо более известный под латинизированным именем Авиценна. Его сочинения служили важнейшими руководствами для врачей в течение многих веков.
Авиценна единственный из алхимиков не верил в возможность получения золота из других металлов. Авиценна был последним крупным ученым арабского мира; наступала пора упадка. Опустошительные набеги монгольских орд ускорили этот процесс.
Центр научной мысли вновь переместился в Европу. В 1096 г. начался первый крестовый поход; христиане начали отвоевывать у мусульман захваченные ими земли. В 1099 г. христиане завоевали Иерусалим. Почти два столетия на побережье Сирии просуществовало христианское государство. Произошло некоторое смешение культур, и горсточка христиан, возвратившихся в Европу, познакомила европейцев с достижениями арабской науки. В то же самое время христиане постепенно возвращали себе Испанию, захваченную арабами в начале VIII в. Во время этих войн христианская Европа узнала о блестящей мавританской цивилизации. Европейцы узнали, что арабы - обладатели книжных сокровищ: переведенных ими трудов греческих ученых, например Аристотеля, и сочинений своих ученых, например Авиценны. Несмотря на сопротивление арабов, не желавших передавать столь ценные труды своему заклятому смертельному врагу, начались попытки перевода этих трудов на латинский язык. Этому начинанию всячески способствовал французский ученый Герберт (ок. 940-1003), который в 999 г. стал папой Сильвестром II. Английский ученый Роберт из Честера был среди тех, кто первым перевел (ок. 1144 г.) арабские труды по алхимии на латинский язык. У него нашлось немало последователей. Лучшим переводчиком был итальянец Герард Кремонский (ок. 1114-1187). Большую часть своей жизни он провел в испанском городе Толедо, который был отвоеван христианами в 1085 г., и перевел с арабского языка 92 трактата.
Начиная с 1200 г. европейские ученые могли, близко познакомившись с наследием алхимиков прошлого, попытаться вновь двинуться вперед по тернистому пути познания. Первым видным европейским алхимиком был Альберт Больштедский (около 1193-1280), более известный как Альбертус Магнус (Альберт Великий). Он тщательно изучил работы Аристотеля, и именно благодаря ему философия Аристотеля приобрела особое значение для ученых позднего средневековья и начала Нового Времени. Альберт Великий в описаниях своих алхимических опытов дает настолько точную характеристику мышьяку, что ему иногда приписывают открытие этого вещества, хотя, в принесях мышьяк был известен алхимиками и до него.
Современником Альберта Великого был английский ученый монах Роджер Бэкон (1214-1292), который известен сегодня прежде всего благодаря своему четко выраженному убеждению, что залогом прогресса науки являются экспериментальная работа и приложение к ней математических методов. Он был прав, но мир еще не был готов к этому. Бэкон попытался написать всеобщую энциклопедию знаний и в своих работах дал первое описание пороха. Иногда его называют изобретателем пороха.
С изобретением пороха средневековые замки перестали быть неприступными твердынями, а пеший воин стал более опасен, чем закованный в латы всадник. Сочинения средневековых алхимиков - испанского врача Арнальда из Виллановы (ок. 1240-1311) и Раймунда Луллия (1235-1313), современников Бэкона, пронизаны мистическим духом алхимии. Эти труды в основном посвящены трансмутации. Считалось, что Луллий даже изготовлял золото для расточительного короля Англии Эдуарда II.
Имя самого видного из средневековых алхимиков осталось неизвестным; он подписывал свои труды именем Джабира, арабского алхимика, жившего за шесть веков до него. Этот «Псевдо-Джабир» был, вероятно, испанцем и жил в XIV в. Псевдо-Джабир первым описал серную кислоту - одно из самых важных соединений сегодняшней химии (после воды, воздуха, угля и нефти). Он также описал, как образуется сильная азотная кислота. Серную и сильную азотную кислоты получали из минералов, в то время как все ранее известные кислоты, например, уксусную кислоту, получали из веществ растительного или животного происхождения.
Открытие сильных минеральных кислот было самым важным достижением химии после успешного получения железа из руды примерно за 3000 лет до того. Используя сильные минеральные кислоты, европейские химики смогли осуществить многие новые реакции и смогли растворить такие вещества, которые древние греки и арабы считали нерастворимыми (у греков и арабов самой сильной кислотой была уксусная).
Минеральные кислоты дали человечеству гораздо больше, чем могло бы дать золото, если бы его научились получать трансмутацией. Если бы золото перестало быть редким металлом, оно мгновенно бы обесценилось. Ценность же минеральных кислот тем выше, чем они дешевле и доступнее. Но, увы, такова человеческая природа - открытие минеральных кислот не произвело впечатления, а поиски золота продолжались.
Шло время, и алхимия после многообещающего начала стала вырождаться в третий раз (в первый раз у греков, второй - у арабов). Поиск золота стал делом многих мошенников, хотя и великие ученые даже в просвещенном XVII в. (например, Бойль и Ньютон) не могли устоять от соблазна попытаться добиться успеха на этом поприще. И вновь, как при Диоклетиане, изучение алхимии было запрещено. Запрещение преследовало две цели: нельзя было допустить обесценивания золота (вдруг трансмутация удастся) и необходимо было бороться против мошенничества.
В 1317 г. папа Иоанн XXII предал алхимию анафеме, и честные алхимики, вынужденные скрывать, чем они занимаются, стали изъясняться еще более загадочно, хотя жульничество на почве алхимии процветало, как и прежде. Однако ветры перемен в Европе уже бушевали. Восточно-Римская (или Византийская) империя доживала последние дни. В 1204 г. столица империи Константинополь был варварски разграблен крестоносцами, и большинство памятников греческой культуры, сохранившихся к тому времени, было полностью разрушено. В 1261 г. греки вернули город, но от прежнего его великолепия уже не сохранилось и следа. В последующие два столетия войска турецких завоевателей все неумолимее приближались к городу, и в 1453 г. Константинополь пал и навсегда стал турецким. Спасаясь от нашествия турок, греческие ученые бежали в Европу, и те знания, те традиции древнегреческой науки, которые они принесли с собой, оказали мощное стимулирующее действие. В Европе начался период кропотливых исследований и важных открытий.
В XIII в. был изобретен магнитный компас и начало развиваться мореплавание. Сначала было проведено изучение побережья Африки, а в 1497 г. совершено путешествие вокруг этого континента. Впечатляющими были путешествия Христофора Колумба (1492-1504 гг.), благодаря которым была открыта другая половина мира. В этом же «веке открытий» немецкий изобретатель Иоганн Гутенберг (ок. 1397-1468) изобрел первый печатный станок с подвижными литерами, собирая которые в текст можно было напечатать любую книгу. Впервые в истории стало возможным выпускать дешевые книги и в достаточном количестве.
Понимание задач химии наметилось в работах двух современников врачей - немца Георга Бауэра (1494-1555) и швейцарца Теофраста Бомбаста фон Гогенгейма (1493-1541). Бауэр, более известный под именем Агриколы (что в переводе с латинского означает «крестьянин»), интересовался минералогией и ее возможной связью с медициной. Попытки обнаружить такую связь (как и сочетание врач-минералог) вообще характерны для химии того периода и последующих двух с половиной столетий. В своей книге «О металлургии» («De Re Metallica»), изданной в 1556 г., Агрикола систематизировал практические знания, почерпнутые им у современных ему рудокопов. Эта книга, написанная понятным языком, с прекрасными иллюстрациями шахтных устройств, сразу же стала популярной и считается классической работой и в наше время. Это самая значительная работа по химической технологии, появившаяся до 1700 г.; со времени ее издания минералогия была признана как наука.
Фон Гогенгейм вошел в историю под выбранным им самим именем Парацельс, т. е. «превосходящий Цельса». Цельс - древнеримский ученый, писавший о медицине. Парацельс, как и Авиценна, считал, что основная задача алхимии - не поиски путей получения золота, а изготовление лекарственных средств. До Парацельса в качестве таковых использовались преимущественно растительные препараты, но Парацельс свято верил в эффективность лекарственных средств, изготовленных из минералов. Несмотря на свое негативное отношение к идее трансмутации, Парацельс был алхимиком старой школы. Парацельс был уверен, что он открыл металлический цинк, и иногда честь этого открытия действительно приписывают ему, хотя цинк в составе руды и в сплаве с медью (латунь) был известен еще в древности. Труды Парацельса вызывали споры даже полвека спустя после его смерти.
Немецкий врач алхимик Андрей Либау (ок. 1540-1616), известный под латинизированным именем Либавия, опубликовал в 1597 г. «Алхимию» - первый в истории учебник химии. Либавий первым описал приготовление соляной кислоты, тетрахлорида олова, сульфата аммония и «царской водки» (aquaregia) - смеси азотной и соляной кислот, получившей свое название из-за способности растворять золото. Либавий считал, что минеральные вещества можно опознать по форме кристаллов, полученных после испарения раствора. Тем не менее, он был уверен, что превращение металлов в золото возможно и открытие способа изготовления золота явится венцом химической науки, хотя и он соглашался с Парацельсом в том, что основная задача алхимии - служить медицине.
Наиболее видным представителем нового направления в химии был немецкий химик Иоганн Рудольф Глаубер (1604-1668). Врач по образованию, он занимался разработкой и совершенствованием методов получения различных химических веществ. Глаубер разработал метод получения соляной кислоты воздействием серной кислоты на поваренную соль. Тщательно изучив остаток, получаемый после отгонки кислот (сульфат натрия), Глаубер установил, что это вещество обладает сильным слабительным действием. Он назвал это вещество «удивительной солью» (sal mirabile) и считал его панацеей, почти эликсиром жизни. Современники Глаубера назвали эту соль глауберовой, и это название сохранилось до наших дней.
В XVII в. значение алхимии неуклонно уменьшалось, а в XVIII в. она постепенно стала тем, что мы сегодня называем химией.
Глава 2. Вклад русских ученых в развитие неорганической химии.
Истоки отечественной химической науки восходят к XVIII в., когда была основана Петербургская академия наук. По замыслу Петра I академия должна была выполнять две основные задачи: «науки производить и совершать» и «оные в народе размножать». Для этого, прежде всего, требовалось подготовить кадры русских ученых в различных областях знаний и привлечь иностранных ученых для исследования природных богатств России.
Уже с первых лет существования Академии наук с ней были связаны все научные достижения в России. В ее стенах работали такие известные ученые, как Иоганн и Даниил Бернулли, Л. Эйлер, С. П. Крашенинников, П. С. Паллас, И. И. Лепехин, Н. Я. Озерецковский, Я. Д. Захаров и др. Начало занятиям химией в Академии наук было положено в 1731 г. избранием в академики Иоганна Георга Гмелина (1709–1755). Гмелину принадлежит первое химическое исследование, опубликованное в «Записках Петербургской академии наук», статья «Об увеличении веса некоторых тел при обжигании».
В течение XVIII в. химией в академии занимались Иоганн Готлоб Леман (1719–1767), Эрик Густав (Кирилл Густавович) Лаксман (1737–1796), Тобиас Иоганн (Товий Егорович) Ловиц (1757–1804), Василий Михайлович Севергин (1765–1826), Апполос Апполосович Мусин-Пушкин (1760–1805) и др. Однако основные достижения этого столетия в области химии связаны с именем Михаила Васильевича Ломоносова (1711–1765). Хотя Ломоносова благодаря исключительно многогранному характеру творческой (математика, физика, химия, науки о Земле, астрономия) и просветительской деятельности с полным правом называют ученым-энциклопедистом, его преимущественное внимание было направлено на развитие физики и химии. Основное направление деятельности ученого в области химии – стремление обосновать последнюю как науку, опирающуюся на союз с математикой, механикой и физикой. К фундаментальным достижениям Ломоносова относятся следующие: он обратил внимание (1756) на основополагающее значение закона сохранения массы вещества в химических реакциях; изложил (1741–1750) основы своего корпускулярного (атомно-молекулярного) учения, получившего развитие лишь спустя столетие; выдвинул (1744–1748) кинетическую теорию теплоты; обосновал (1747–1752) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название «физическая химия», а для практической части – «техническая химия». Ломоносов первым начал читать в Петербургской академии наук «Курс истинно физической химии». В 1748 г. по инициативе ученого в России была построена первая химическая лаборатория, предназначенная для научных и учебных целей. Для этой лаборатории он разработал широкую программу исследований, центральным пунктом которой было изучение тех явлений, которые происходят в смешанном теле при химическом взаимодействии. В период 1748–1757 гг. работы ученого были посвящены главным образом решению теоретических и экспериментальных вопросов химии. Проводя опыты по обжигу металлов в запаянных сосудах, он показал (1756), что их вес после нагревания не изменяется и что мнение Р. Бойля о присоединении тепловой материи к металлам ошибочно; изучал жидкое, газообразное и твердое состояния тел; достаточно точно определил коэффициенты расширения газов; изучал растворимость солей при разных температурах; исследовал влияние электрического тока на растворы солей, установил факты понижения температуры при растворении солей и понижения точки замерзания раствора по сравнению с чистым растворителем; установил различие между процессом растворения металлов в кислоте, сопровождающимся химическими изменениями, и процессом растворения солей в воде, происходящим без химических изменений растворяемых веществ.
Ломоносову принадлежит большое число практических изысканий. Он был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора); разработал технологию и рецептуру цветных стекол, которые употреблял для создания мозаичных картин; изобрел фарфоровую массу. Занимался анализом руд, солей и других продуктов; описал процессы получения железного купороса, меди из медного купороса, серы из серных руд, квасцов, серной, азотной и соляной кислот. Труд Ломоносова «Первые основания металлургии, или рудных дел» (1763), в котором он рассмотрел свойства различных металлов, дал их классификацию и описал способы получения, не только заложил первые блоки в основы русского химического языка, но и положил начало систематическим работам ученых последующих поколений по исследованию и освоению естественных богатств России.
Традиции М.В. Ломоносова, связанные с изучением руд и минералов России, были продолжены во второй половине XVIII и начале XIX в., когда были выполнены многочисленные химические исследования прикладного характера. Особое значение в этот период имела просветительская деятельность русских химиков. И.Г. Леман, занявший после М.В. Ломоносова кафедру химии Петербургской академии наук и принявший заведование химической лабораторией, исследовал сибирскую свинцовую руду – крокоит, описал русские минералы, содержащие вольфрам и хром, издал (1772) переведенные на русский язык руководства по минералогии и пробирному искусству.
Э.Г. Лаксман изучал минеральные богатства Алтая и Восточной Сибири. Будучи непримиримым противником сжигания лесных массивов с целью накопления золы, которая была необходима для получения поташа – главного исходного материала в производстве стекла, Лаксман разработал новый беспоташный способ изготовления стекла на основе природной глауберовой соли (десятиводного сульфата натрия). Он также предложил (1769) способ получения поваренной соли из рапы соляных озер ее вымораживанием и выпариванием; разработал технологию селитры, соды и квасцов.
В течение всего XVIII в. развитие химических знаний получало действенную поддержку со стороны руководства Академии наук, будь то ее первый президент Л. Л. Блюментрост (1725–1733) или первая женщина-директор Е. Р. Дашкова (1783–1796).
В период конца XVIII – начала XIX столетий наибольший вклад в развитие химической науки внесли академики В. М. Севергин и Т. Е. Ловиц.
В. М. Севергин с 1793 г. – академик (профессор) Петербургской АН. В 1805–1826 гг. он в знак признания высоких научных заслуг шесть раз подряд избирался членом Комитета правления академии. Основные научные работы Севергина посвящены общей и неорганической химии. Он развил химическое направление в минералогии, считая главной задачей этой науки исследование состава и строения минералов; впервые сформулировал понятие о парагенезисе («смежности минералов»); стоял у истоков колориметрического анализа; предложил (1795) способ количественных определений, основанный на сравнении интенсивности окраски растворов. Севергин был автором первых русских руководств по химии и химической технологии «Пробирное искусство, или руководство к химическому испытанию металлических руд и других ископаемых тел» (1801), «Способ испытывать минеральные воды» (1800), «Наставление о лучших способах добывать, приготовлять и очищать селитру в России…» (1812). Он также перевел с французского и переработал «Словарь химический» (т. 1–4, 1810–1813), был основателем и редактором (с 1804) «Технологического журнала».
Т. Е. Ловиц открыл (1785) явление адсорбции углем в жидкой среде и предложил способы очистки на этой основе воды, спирта и фармацевтических препаратов. Внес существенный вклад в учение о растворах солей и кристаллохимию; разработал способы получения ледяной уксусной кислоты, кристаллической глюкозы, безводных диэтилового эфира и спирта, а также разделения солей бария, стронция и кальция.
К концу XVIII в. появились первые в России работы в области химии и технологии платины и хрома.
Почетный член Петербургской академии наук А. А. Мусин-Пушкин получил ряд «тройных» комплексных солей платины – хлорплатинаты магния, бария и натрия, амальгаму платины, разработал способ получения ковкой платины прокаливанием ее амальгамы. Он впервые получил и описал золь металлической ртути, открыл хромовые квасцы, исследовал сплавы платины с медью и серебром.
Если XVIII столетие можно назвать периодом зарождения российской химической науки, то XIX в. делится на два периода: первая половина – становление отечественной химии, вторая половина – утверждение российских ученых в профессиональном мировом сообществе. При этом выдающиеся открытия Д. И. Менделеева и А. М. Бутлерова стали логическим следствием той огромной деятельности русских ученых, направленной на популяризацию химических и химико-технологических знаний, на развитие отечественной промышленности, которая велась ими с начала века.
Петербургская академия наук, в которой в XVIII в. была сосредоточена практически вся российская химия, не потеряла своего значения и в последующее столетие. В 1803 г. был принят ее новый устав, в котором она определялась как главное ученое учреждение страны, а в ее задачи входило усовершенствование наук, просвещение, а также усовершенствование мануфактур, ремесел и фабрик.
В 1810–1830 гг. русскими химиками была проделана огромная работа по созданию учебно-методических основ преподавания химии, написанию отечественных руководств по химии. Так, в 1808 г. А. И. Шерер (1772–1825), профессор Петербургской медико-хирургической академии, Главного педагогического института и Горного кадетского корпуса, а с 1815 г. – академик Петербургской академии наук издал первый русский учебник – «Руководство к преподаванию химии» (в двух частях). В «Предуведомлении» он писал о своем стремлении прежде всего к тому, чтобы преподавание химии было «практическим и основательным». В 1813–1817 гг. было издано пятитомное энциклопедическое руководство «Всеобщая химия для учащих и учащихся» профессора химии Харьковского университета Ф.И. Гизе (1784–1821). Это уникальное издание впервые ознакомило русского читателя с новейшими теориями и открытиями в химии: представлениями К. Бертолле о химическом сродстве, законами Пруста, Рихтера, электрохимическими представлениями Г. Дэви и Я. Берцелиуса и др.
Первой книгой, достаточно полно отражавшей последние достижения науки и излагавшей факты и теории химии в компактной и доступной форме, стал учебник Г.И. Гесса «Основание чистой химии» (1831), который вплоть до выхода в свет «Основ химии» Д.И. Менделеева (1869) был принят в учебных заведениях России в качестве основного руководства по химии.
В историю мировой и отечественной химии имя Германа Ивановича Гесса (1802–1850) вошло не только благодаря его знаменитому учебнику. В первую очередь он известен как создатель первой в России научной школы химиков-неоргаников, один из основоположников термохимии. В своих термохимических исследованиях Г.И. Гесс значительно раньше Х.П. Томсена и П.Э. Бертло выдвинул (1840) положение, согласно которому величины тепловых эффектов реакции могут служить мерой химического сродства. Открыл (1840) основной закон термохимии – закон постоянства количества тепла, доказал (1842) правило термонейтральности.
Вторая половина XIX в. представляет собой особый период в истории отечественной науки, в том числе и химии. Эпохой в истории мировой науки стали открытие в 1869 г. Дмитрием Ивановичем Менделеевым (1834–1907) Периодического закона химических элементов и разработка в 1861–1870 гг.
А. М. Бутлеровым (1828–1886) теории химического строения веществ. Ответ на вопрос о различии химических свойств органических соединений дал А. М. Бутлеров в своей теории химического строения. Он показал, что реакционная способность молекул зависит от величин энергии химических связей между атомами, которые изменяются в результате взаимного влияния атомов и атомных групп в единой системе молекулы. Таким образом, в соответствии с его теорией сущность химического строения молекул заключается в энергетической неэквивалентности разных химических связей, одинаково обозначаемых как С–Н, или в общем случае А–В. На основе теории химического строения представителями школы Бутлерова был осуществлен синтез олефиновых и парафиновых углеводородов состава C5–C10 – основы химии углеводородов, которая стала впоследствии базой для развития органической химии и нефтехимии, являющейся основным поставщиков карбюраторных и дизельных топлив и смазочных материалов для авто- и авиамоторостроения.
Не меньший вклад в науку о химии нефти внёс ученик А.М. Бутлерова, В.В. Марковников, посвятивший более 20 лет своей научной деятельности исследованию состава кавказской нефти, но эти открытия стали относиться к другому разделу химии – органической.
Глава 3. Периодический закон Дмитрия Ивановича Менделеева.

Рис 1. «Портрет Д. И. Менделеева»
3.1. Биография Д. И. Менделеева
Дмитрий Иванович Менделеев – гениальный русский ученый, профессор, член Академии наук, обладатель энциклопедических знаний по химии, физике, географии, экономике.
Дмитрий Иванович родился в семье директора Тобольской гимназии Ив. П. Менделеева и М. Дм. Корнильевой, дочери небогатого сибирского помещика, 27.01 (08.02) 1834 года. Он был 17 сыном (по другой версии – 14), но мать сделала все возможное, чтобы ее «последыш» получил хорошее образование.
Часть своей жизни будущий ученый провел в Сибири, где в это же время отбывали ссылку декабристы. Семья Менделеевых была знакома с И. Пущиным, А. М. Муравьевым, П. Н. Свистуновым, М. А. Фонвизиным. На формирование жизненных взглядов Дмитрия Ивановича оказал влияние и дядя, брат матери, Василий Дмитриевич Корнильев, который был знаком с выдающимися представителями мира искусства и науки своего времени. Возможно, в доме дяди Дмитрий Иванович мог встречать Н. Гоголя, Ф. Глинку, М. Погодина и даже Сергея Львовича и А. С. Пушкина.
Сохранились сведения, что одним из учителей Дмитрия Ивановича в гимназии был известный впоследствии поэт П. Ершов (автор знаменитого «Конька-Горбунька»).
Высшее образование будущий ученый получил в Санкт-Петербурге, в Главном педагогическом институте.
Менделеев был женат дважды. Первая жена, Физа Лещева, была падчерицей П. Ершова, а вторая, Анна Попова, была младше ученого на 26 лет. От двух браков родилось 7 детей. Одна из его дочерей, Любовь Менделеева, была женой известного русского поэта Серебряного века А. Блока.
Научная деятельность: в 1855 году Менделеев закончил институт (с золотой медалью) и начал преподавать. Сначала он работал в Симферопольской гимназии (где познакомился с Н. И. Пироговым), потом в Ришельевском лицее в Одессе. В 1856 году он защитил диссертацию и получил степень магистра химии.
С 1857 по 1890 работал в Императорском Санкт-Петербургском университете на кафедре химии.
С 1859 по 1860 год преподавал и работал в Германии, в Гейдельбергском университете, где познакомился с такими учеными, как Р. Бунзен, Дж. Гиббсон.
С 1872 года, после получения звания профессора, он преподавал в Санкт-Петербургском технологическом институте, Николаевском инженерном училище, а также в Институте путей сообщения. С 1876 года он член-корреспондент Академии наук.
3.2. Открытие периодического закона.
Периодический закон Дмитрия Ивановича Менделеева — один из фундаментальных законов природы, который увязывает зависимость свойств химических элементов и простых веществ с их атомными массами. В настоящее время закон уточнен, и зависимость свойств объясняется зарядом ядра атома.
Закон был открыт русским ученым в 1869-м году. Менделеев представил его научному сообществу в докладе съезду Русского химического общества (доклад был сделан другим ученым, так как Менделеев был вынужден срочно выехать по заданию Вольного экономического общества Петербурга). В этом же году вышел учебник «Основы химии», написанный Дмитрием Ивановичем для студентов. В нем ученый описал свойства популярных соединений, а также постарался дать логическую систематизацию химических элементов. Также в нем впервые была представлена таблица с периодически расположенными элементами, как графическая интерпретация периодического закона. Все последующие годы Менделеев совершенствовал свою таблицу, например, добавил столбец инертных газов, которые были открыты спустя 25 лет.
|
|
|
|
|
Рис. 2 «Алюминий гранулированный» |
Рис. 3. «Йод кристаллический» |
Рис. 4. «Сера молотая» |
Научное сообщество далеко не сразу приняло идеи великого русского химика, даже в России. Но после того, как были открыты три новых элемента (галлий в 1875-м, скандий в 1879-м и германий в 1886-м годах), предсказанные и описанные Менделеевым в своем знаменитом докладе, периодический закон был признан.
Периодический закон Менделеева:
· Является всеобщим законом природы.
· В таблицу, графически представляющую закон, включаются не только все известные элементы, но и те, которые открывают до сих пор.
· Все новые открытия не повлияли на актуальность закона и таблицы. Таблица совершенствуется и изменяется, но ее суть осталась неизменной.
· Позволил уточнить атомные веса и другие характеристики некоторых элементов, предсказать существование новых элементов.
· Химики получили надежную подсказку, как и где искать новые элементы. Кроме этого, закон позволяет с высокой долей вероятности заранее определять свойства еще неоткрытых элементов.
· Сыграл огромную роль в развитии неорганической химии в 19-м веке.
3.3. История открытия таблицы периодической системы химических элементов
Есть красивая легенда о том, что свою таблицу Менделеев увидел во сне, а утром проснулся и записал ее. На самом деле, это просто миф. Сам ученый много раз говорил, что созданию и совершенствованию периодической таблицы элементов он посвятил 20 лет своей жизни.
Все началось с того, что Дмитрий Иванович решил написать для студентов учебник по неорганической химии, в котором собирался систематизировать все известные на этот момент знания. И естественно, он опирался на достижения и открытия своих предшественников. Впервые внимание на взаимосвязь атомных весов и свойств элементов обратил немецкий химик Дёберейнер, который попытался разбить известные ему элементы на триады с похожими свойствами и весами, подчиняющимися определенному правилу. В каждой тройке средний элемент имел вес, близкий к среднему арифметическому двух крайних элементов. Ученый смог таким образом образовать пять групп, например, Li–Na–K; Cl–Br–I. Но это были далеко не все известные элементы. К тому же, тройка элементов явно не исчерпывала список элементов с похожими свойствами. Дальше всех продвинулся немецкий ученый Мейер, который в 1864-м году составил таблицу, очень похожую на таблицу Менделеева, но она содержала лишь 28 элементов, в то время как было известно уже 63.

Рис. 5 «Первая периодическая таблица Д. И. Менделеева»
В отличие от своих предшественников Менделееву удалось составить таблицу, в которую вошли все известные элементы, расположенные по определенной системе. При этом, некоторые клетки он оставил незаполненными, примерно вычислив атомные веса некоторых элементов и описав их свойства. Кроме этого, русскому ученому хватило смелости и дальновидности заявить, что открытый им закон является всеобщим законом природы и назвал его «периодическим законом». Сказав «а», он пошел дальше и исправил атомные веса элементов, которые не вписывались в таблицу. При более тщательной проверке, оказалось, что его исправления верны, а открытие описанных им гипотетических элементов стало окончательным подтверждением истинности нового закона: практика доказала справедливость теории.
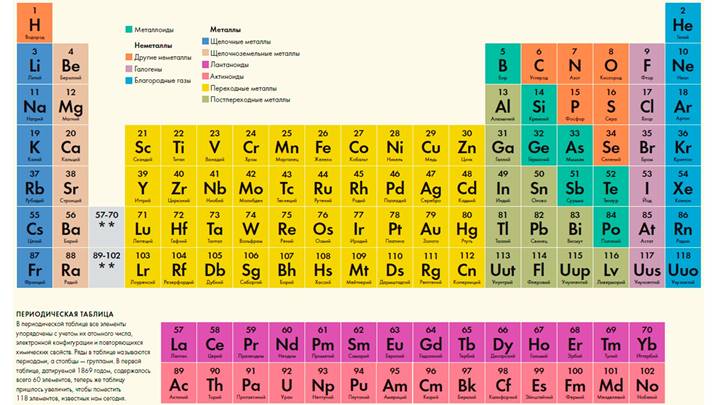
Рис 6. «Полная таблица химических элементов Дмитрия Ивановича Менделеева»
Периодическая таблица химических элементов Д. И. Менделеева занимает всего один листок, но в этом листке заключено огромное количество информации. В каждой клетке таблицы расположены международный символ элемента, его название (в наших таблицах – на русском языке), его порядковый номер, относительная атомная масса (для нестабильных элементов – массовое число). Как правило, цветом выделена принадлежность элементов к тому или иному семейству, а также дано строение электронных оболочек атомов. Некоторые фирмы выпускают красочные таблицы, в которых в каждой клетке помещена фотография соответствующего простого вещества, дано строение наиболее устойчивой кристаллической решетки, даны сведения о применении данного элемента. Интересно решается оформление клеточек с радиоактивными элементами. Так, в одной таблице на месте радия помещена фотография рабочего журнала Марии Кюри, открытого на той странице, где впервые появилась запись об открытии нового элемента.
Оригинальную серию из пятнадцати цветных открыток выпустила ассоциация французских химиков. На ней помещены фотографии почтовых марок, выпущенных во многих странах мира. Каждая марка посвящена очередному химическому элементу. И, конечно, почетное место занимает портрет создателя периодической системы элементов – Д. И. Менделеева и фотография первого рукописного наброска его таблицы.
Еще Менделеев говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж. У. Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»...
Сейчас мало кому известны имена тех, кто предложил современную шкалу атомных масс, впервые разделил мифический элемент «дидим» на празеодим и неодим, синтезировал технеций и нашел его следы в земной коре, – словом, всех, кто своим трудом внес хотя бы небольшой вклад в таблицу элементов. Но таблица – перед нами, и количество информации, которое она содержит – огромно. Начало же ее простирается вглубь веков, в античные времена, когда греческим философом Левкиппом и его знаменитым учеником Демокритом были сформулированы первые идеи об атомах.
Латинское слово элемент (elementum) использовалось еще античными авторами (Цицерон, Овидий, Гораций), причем во многом в том же смысле, что и современное его значение – как часть чего-то (элемент речи, элемент образования и т.п.). Интересно происхождение названия этого слова. В древности было распространено изречение «Как слова состоят из букв, так и тела – из элементов». Отсюда – вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» – «em» – «en» – «tum»).
3.4. Открытие новых химических элементов после создания Периодического закона Д.И. Менделеевым
Для развития теоретической химии этого периода исходным и основополагающим было создание Д. И. Менделеевым его периодической системы.
Гениальное творение русского ученого наложило печать на развитие химической науки в двух аспектах. Во-первых, пустые клетки таблицы Д. И. Менделеева (в 1871 г. было известно только 63 элемента) заполнились в результате открытий ученых различных стран, причем блестяще подтверждались предположения Менделеева о свойствах некоторых из этих неизвестных тогда элементов. До 1917 г. таблица пополнилась многими вновь открытыми элементами.
Периодическая система элементов нашла подтверждение в работах многих ученых. В 1875 г. французский химик П. Э. Лекок де Буабодран (1838—1912) получил новый элемент — серебристый легкоплавкий металл, названный в честь родины ученого галлием. Практическое применение галлия относится лишь к нашему времени.
В 1878—1879 гг. швейцарский химик Сорэ и шведский ученый П. Т. Клеве (1840—1905) обнаружили и получили небольшое количество солей элемента, окрашенных в оранжевый цвет. Этот элемент был назван гольмием в честь столицы Швеции Стокгольма, в старину называвшейся Гольмия (или Хольмия), где и были найдены эти редкоземельные минералы. В те же годы П. Клеве при активном участии физика Талена открыл тулий, названный учеными в честь античного наименования сказочной северной страны Туле (в данном случае отождествленной со Скандинавией).
Последующие исследования «дидймиевой земли» привели в 1882 г. австрийского химика К. А. фон Вельсбаха к открытию еще двух редкоземельных элементов — празеодима, названного так за свой светло-зеленый цвет (от греческого слова «прасинос» — зеленый, как лук), и неодима (от приставки «нео», т. е. новый, и последнего слога дидимия — «дим»). Таким образом, в начале 80-х гг. дидимий, значившийся в первых вариантах периодической системы Д. И. Менделеева химическим элементом, исчез, а вместо него образовалось четыре новых лантаноида: празеодим, неодим, самарий и гадолиний. В 1886 г. Лекок де Буабодран с помощью спектроскопического анализа «гольмиевой земли» открыл элемент, названный им диспрозием, также относящийся к лантаноидам. Это название было производным от греческого слова «дюспроситос» — труднодоступный.
Чешский химик Б. Браунер (1855—1935), которому принадлежит большая заслуга по дальнейшему подтверждению и обоснованию периодической системы, выделил все редкоземельные элементы в особую группу, впоследствии названную лантаноидами
Сейчас лантаноиды широко применяются в виде металлов, сплавов и химических соединений в различных отраслях техники.
В 1886 г. А. Муассан получил свободный фтор, который вскоре приобрел широкое применение в технологии.
В 1894 г. У. Рамзай (Рэмзи) в сотрудничестве с Дж. Рэлеем (Рейли) (1842—1919) открыл ранее неизвестную составную часть воздуха — газ аргон. Позднее аргон нашел широкое использование в термической обработке легко окисляющихся металлов, в электроосветительных устройствах и т. д.
В предыдущей главе уже упоминалось, что в 1868 г. астрономы обнаружили в солнечном спектре линии прежде неизвестного элемента, который был назван гелием.
В 1895 г. Рэмзи выделил гелий из некоторых земных веществ. Он оказался инертным газом в 7 раз легче воздуха. Первое практическое применение этого легкого и невоспламеняющегося газа было осуществлено в Германии во время первой мировой войны для наполнения дирижаблей (вместо водорода). В 1898 г. Рэмзи совместно с М. Траверсон открыл криптон, ксенон и неон. Эти инертные газы применяются главным образом в электротехнической промышленности для изготовления неоновых ламп.
Последним инертным газом явился радиоактивный радон, открытый Э. Дорном в 1900 г. Радон в наши дни применяется в медицине (радоновые ванны и т. п.).
В 1900 г. бельгийский химик Л. Эррер предложил свести эти «благородные», или инертные, газы в особую, нулевую группу периодической системы элементов.
Первым в нулевой группе был поставлен гелий. Сейчас весь вертикальный столбец, составивший нулевую группу, входит в VIII группу элементов.
Конец XIX и начало XX в. было временем открытия радиоактивности таких ранее известных тяжелых элементов, как уран и торий.
В 1900 г. Крукс открыл первый изотоп урана — уран-Х В 1913 г. Фаянс и Геринг доказали, что уран-Х превращается в новый изотоп (уран-Хг) в результате радиоактивного распада.
Радиоактивность тория была обнаружена супругами Кюри в 1898 г. В 1902 г. Резерфорд и Содди выделили изотоп тория (торий-А^).
В 1898 г. супруги Кюри открыли радий ', а в 1902 г. выделили первые 0,1 г чистого препарата радия, опеределив его атомный вес — 225. В последующий период радий применялся как источник у-лучей для просвечивания металлических изделий, изготовления светящихся красок, а в медицине — для лечения злокачественных опухолей, кожных и других заболеваний.
В 1898 г. М. Склодовская-Кюри открыла другой радиоактивный элемент — полоний. Он стал использоваться только в последние годы как нейтронный источник в ядерных реакторах.
В 1899 г. Добьёрн, сотрудник Кюри, открыл еще один радиоактивный элемент — актиний (от греческого слова «актис» — излучение) . По имени этого элемента весь ряд радиоактивных трансурановых элементов получил потом название «актиноиды».
В 1903 г. Рэмзи доказал, что гелий — это продукт" радиоактивного распада радия.
В 1914 г. англичанин Ф. Содди теоретически обосновал открытия многочисленных разновидностей радиоактивных веществ, указав, что существуют элементы, почти не отличающиеся друг от друга по химическим свойствам и занимающие одно и то же место в периодической системе элементов, но различающиеся по своему атомному весу,— изотопы. В 1915 г. Содди экспериментально получил радий из урана.
Дальнейшие исследования радиоактивности урана позволили сделать вывод, что актиний — это продукт одного из превращений урана и что могут существовать другие элементы уранового ряда. Подтверждение этому нашли австрийский физик Л. Майтнер (1878—1968) и немецкий химик О. Ган (1879—1968), открыв в 1917 г. протактиний.
Благодаря открытию радиоактивного распада элементов, созданию электронной теории и новой модели атома, сущность и значение периодического закона Менделеева предстали в новом свете. Было установлено, что порядковый (атомный) номер элемента в периодической системе (он обозначается «Z») имеет реальный физический и химический смысл: он соответствует общему числу электронов в слоях оболочки нейтрального атома элемента и положительному заряду ядра атома. В 1913—1914 гг. английский физик Г.Г. Дж. Моз-ли (1887—1915) обнаружил прямую связь между спектром рентгеновских лучей элемента и его порядковым числом.
К 1917 г. усилиями ученых разных стран было открыто 24 новых химических элемента, а именно: галлий (Ga), скандий (Sc), германий (Ge), фтор (F); лантаноиды: иттербий(Yb), гольмий (Но), тулий (Ти), самарий (Stn), гадолиний (Gd), празеодим (Рг), диспрозий (Dy), неодим (Nd), европий (Ей) и лютеций (Lu); инертные газы: гелий (Не), неон (Ne), аргон (Аг), криптон (Кг), ксенон (Хе) и радон (Rn) и радиоактивные элементы (к которым относился и радон): радий (Ra), полоний (Ро), актиний (Ас) и протактиний (Ра). Количество химических элементов в периодической системе Менделеева увеличилось с 63 в 1869 г. до 87 в 1917.
За всю историю периодической системы элементов было несколько сот вариантов ее графического изображения. Известны ее изображения в виде различных геометрических фигур: пространственных, плоскостных, аналитических фигур-спиралей. Наибольшее распространение получили три формы: короткая, предложенная Менделеевым и получившая всеобщее признание, длинная и лестничная. Длинную также разрабатывал Менделеев, а в усовершенствованном виде она была предложена в 1905 г. А. Вернером. Лестничная форма разрабатывалась английским ученым Т. Бейли (1882), датским ученым Ю. Томсоном (1895), а позднее была усовершенствована Н. Бором (1921).
Начало систематическому изучению химических реакций было положено Н. А. Меншуткиным (1842—1907) в 1877 г. В теории гальванических элементов были даны представления об электронных потенциалах (В. Нернст), Вант-Гофф окончательно сформулировал и детально разработал основные принципы формальной кинетики, Аррениус ввел представление об энергии активации. В 90-х гг. русский ученый А. Н. Бах (1857—1946) создал теорию медленного окисления. В 1905 г. Н. А. Шилов (1872—1930) подробно изучил механизм сопряженных реакций, особое внимание придавая промежуточным продуктам в кинетике сопряженных реакций окисления.
Д. П. Коновалов положил начало исследованиям по физико-химической теории катализа. В 1885 г. он впервые ввел понятие активной поверхности, сыгравшее важную роль в развитии теории катализа. Теорией катализа занимался в 1886 г. Менделеев.
За рубежом С. Оствальд в 1888 г. независимо от Д. П. Коновалова вывел формулу скорости автокаталитических реакций.
В начале XX в. исследованием хода каталитических реакций занялся в России В. Н. Ипатьев (1867—1952). Он исследовал каталитическое действие оксидов металлов при высоких давлениях и температурах и в 1911 г. обнаружил, что при использовании смеси катализаторов их действие усиливается.
В 1878 г. в США Дж. У. Гиббс установил основные законы поверхностных явлений и адсорбции (поглощение вещества из газовой или жидкой среды поверхностным слоем твердого тела — адсорбента).
Русскими учеными Н. Д. Зелинским, Н. А. Шиловым, А. В. Ра-ковским (1879—1941) и другими был изучен ряд важных процессов адсорбции на углях и других адсорбентах. В 1903 г. физиолог и биохимик растений М. С. Цвет (1872—1919) открыл способ хромато-графического адсорбционного анализа, получившего в дальнейшем широкое практическое применение для различения веществ, близких по свойствам.
В 1879 г. норвежские ученые К. М. Гульдберг (1836—1902) и П. Вааге (1833—1900) открыли закон действия масс, представив его в математической форме, и развили теорию скоростей химических реакций. Химическое равновесие рассматривалось ими не как статический, а как динамический процесс. В 1884 г. француз А. Л. Ле Шательё (1850—1936) сформулировал общий закон смещения химического равновесия в зависимости от внешних факторов (принцип Ле Шателье). В 1884 г. Вант-Гофф, опираясь на выведенное Гульдбергом и Вааге кинетическое выражение закона действия масс, обосновал важнейшие положения теории химической кинетики.
Глава 4. Роль неорганической химии в современном мире
Большая часть знаний, на которых базируется неорганическая химия, получена довольно давно, но во второй половине прошлого века она вдруг оказалась в тени фантастических достижений органической химии и химии живых систем. Практически у всех создалось ощущение, что неорганическая химия — в глубоком застое. Этому в немалой степени способствовали и университетские профессора, излагавшие предмет почти в неизменном виде на протяжении десятилетий. Между тем ситуация в последние годы существенно переменилась. Интенсивное развитие электроники, фотоники, сенсорики и спинтроники потребовало новых материалов со специальными свойствами, что привело к ренессансу неорганической химии.
Кстати, неорганика вообще гораздо сложнее органической химии. Последняя — это фактически химия одного элемента, а у неорганики их в арсенале почти сто. Именно это дает простор для создания самых разных материалов с разными свойствами.
В Периодической системе элементов уже почти исчезли «застойные» зоны, практически все элементы активно применяются в новых материалах. Пример тому — использование самых молодых (по времени открытия) химических элементов, таких, как рений, технеций и франций, не говоря уже о плутонии, америции и других актинидах.
Переход от химических элементов к материалам исключительно сложен, здесь не помогают даже методы комбинаторной химии, поскольку возможно множество сочетаний различных химических элементов. Например, только для элементов, имеющих стабильные изотопы, таких сочетаний больше 7·1023. Это число увеличится на много порядков, если учесть, что большинство современных материалов создают, используя метастабильные состояния веществ. Дело в том, что 99,9% неорганических материалов находятся в неравновесном состоянии, то есть с ними что-то происходит во времени (например, металл окисляется). Этот процесс превращения может быть очень медленным, поэтому кажется, что материал стабилен и неизменен. Чем отличается стабильное состояние от метастабильного? Если зафиксировать все параметры, которые характеризуют состояние системы, то только одно-единственное будет термодинамически стабильным, а множество других — метастабильными. Таких метастабильных состояний бесконечно много даже для одного вещества, имеющего фиксированный состав, а свойства у этих состояний разные.
В этой ситуации метод случайного перебора композиций не может быть эффективным — надо с умом использовать закономерности неорганической химии. К сожалению, несмотря на славные традиции ее развития в России, в последние 10–20 лет фронт отечественных исследований значительно сузился из-за крайне ограниченных экспериментальных возможностей многих научных групп (нет современных электронных микроскопов, синхротронных источников излучения, сквид-магнетометров, ЯМР-спектрометров высокого разрешения и т. д.). Это тем более печально, что в прошлом российские ученые внесли существенный вклад в развитие неорганической химии, — достаточно вспомнить Д.И. Менделеева, И.С. Курнакова, Л.А. Чугаева, И.И. Черняева, а также А.В. Новоселову, И.В. Тананаева, В.И. Спицина.
Мы не будем пытаться охватить все направления современной неорганической химии, а ограничим круг научных проблем опытом, накопленным на кафедре неорганической химии химического факультета и на факультете наук о материалах МГУ за последние годы. Несмотря на неизбежную субъективность, этот выбор дает достаточно полное представление о современной неорганической химии. Возьмем только основные направления: химия ионных и молекулярных прекурсоров; кристаллохимический дизайн новых неорганических соединений; неорганическая супрамолекулярная химия; химия соединений переменного состава; химия элементов в аномальных степенях окисления; неорганическая химия биоматериалов; неорганический синтез материалов с использованием различных физических воздействий.
4.1. Химия прекурсоров
Прекурсор — это предшественник, а точнее, обычное в неорганике обозначение исходного вещества, вступающего в реакцию. Конечная цель исследователей — не синтез соединений, а создание на основе материалов с определенным комплексом свойств. Свойства же материала зависят от его структуры. Если смотреть глубже, то видно, что у каждого материала есть несколько уровней структуры, которые связаны между собой, и все они влияют на свойства материала.
Первый уровень структуры — кристаллический. Это структура на атомном и ионном уровне организации вещества, то, как расположены ионы, атомы или молекулы в кристаллической решетке относительно друг друга. Следующий уровень — более удаленный от атомного состояния, он связан с присутствием в твердом теле различных линейных дефектов. Третий уровень — это макроскопические дефекты (например, поры), которые возникают в твердых телах в процессе их формирования или использования.
Одно дело, когда у нас в руках монокристалл — в нем кристаллический порядок повторяется во всем объеме. Но чаще всего мы имеем дело с поликристаллическими телами, то есть такими, которые состоят из маленьких кристалликов (кристаллитов), по-разному ориентированных друг относительно друга. Здесь возникают дополнительные дефекты (дислокации, границы между кристалликами, поры, трещины), которые вносят важный вклад в формирование свойств. Например, железо, если его получить в виде монокристалла, будет в химическом отношении совершенно инертно. А если железо получить разложением карбонила или оксалата железа, то это будет поликристаллический материал, который сразу сгорает на воздухе, образуя оксиды. И то и другое — железо, а ведут они себя совершенно по-разному.
Чтобы управлять зависимостью свойств от уровней структуры, надо, чтобы исходные вещества были в определенном состоянии. А этого не всегда просто достичь. При получении многих материалов неэффективен, казалось бы, самый простой твердофазный синтез, который широко использовали раньше для получения магнитных диэлектриков и пьезокерамики. Например, марганец-цинковые ферриты синтезировали, осуществляя реакцию:
![]()
Оказалось, что традиционные механическое перемешивание, прессование смеси реагентов и их высокотемпературный обжиг (1200°С) во многих случаях не дают однофазного продукта. При повышении температуры теряется летучий оксид цинка и происходит диссоциация оксида железа (III). Все это изменяет состав и существенно ухудшает свойства материала.
Шаг вперед — использование в качестве исходных реагентов твердых солевых растворов. Как показали наши исследования, наиболее удобны для этого соли типа шенитов — M2+A+(RO4)2·6Н20 (М = Mg, Mn, Ni, Co, Fe, Cu, Zn; A — щелочной металл или NH4+, R = S, Se, Те) или квасцов A+M3+(SO4)2·12Н20 (А — щелочной металл или NH4, М = Fe, Cr, Со).
Теперь сделаем маленькое отступление и поясним, что такое твердые солевые растворы. Для примера возьмем более простую соль, например NaCl. Если растворить хлорид натрия в воде, а потом понизить температуру, то раствор станет пересыщенным и выпадет осадок. Если мы в этот же раствор добавим еще и KCl, то из раствора по мере понижения температуры выделятся не индивидуальные соли NaCl и KCl, а кристаллиты твердого раствора. В твердом растворе, также как и в жидком, вещества смешаны на атомном уровне — в этом его ключевое отличие от механической смеси кристаллов.
Твердые растворы широко используют в металлургии. Известно, что железо в процессе получения из руды растворяет углерод. Если железо не содержит углерода, то оно мягкое и пластичное, если углерода 1% — это прочная сталь, а если 4% — хрупкий чугун. Для любого человека это совершенно разные материалы, а для химика — твердый раствор железа с различным содержанием растворенного углерода. Другой пример — когда в меди растворяют олово и получается бронза. В зависимости от того, какое количество олова содержится в сплаве, материал будет иметь совершенно разные механические и прочностные свойства, и даже звучание колокола, который делают из меди, будет совершенно разным.
Так вот, оказалось, что шениты и квасцы могут образовывать твердые растворы при любых соотношениях компонентов и имеют хорошую растворимость в воде, резко уменьшающуюся при охлаждении. Это так называемые ионные (поскольку в солях ионная связь) прекурсоры, или исходные реагенты. Целевой продукт — феррит получают с помощью термолиза:
![]()
От того, в каких условиях проводится эта реакция, зависит, удастся ли получить поликристаллический материал с нужной керамической структурой и свойствами.
Несколько позже появилась криохимическая технология получения твердых солевых растворов, основанная на сбалансированном сочетании нагрева и охлаждения. Прежде чем применять новую технологию, надо было подробно изучить фундаментальные процессы криокристаллизации, сублимационного обезвоживания, криоосаждения, криоэкстракции и криодиспергирования. Криохимический синтез солеобразных исходных реагентов стал основой получения самых разных функциональных материалов. Например, высокопрочной керамики, пигментов, сорбентов, катализаторов и многого другого.
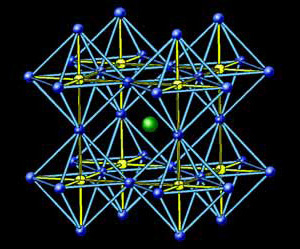
Рис. 7. Структура перовскита ABX3
Важная особенность солеообразных ионных прекурсоров — так называемая топохимическая память, то есть способность помнить свое происхождение и передавать эту информацию в последующих реакциях, которые так и называются — топохимическими. Скорее всего, эту информацию в твердом теле хранит реальная структура, сформированная, как правило, в неравновесных условиях. В дальнейшем это сильно влияет на свойства функциональных материалов (особенно тех, которые получают в форме поликристаллической керамики).
Очень важны и интересны исследования молекулярных прекурсоров (исходных реагентов). Их используют, например, для создания тонкопленочных материалов методом молекулярного наслаивания. Известно, что уже давно назрела необходимость увеличить плотность записи информации в кремниевых микросхемах, а для этого придется заменить SiО2 на оксиды с большей величиной диэлектрической константы. Среди наиболее вероятных претендентов оказались НfO2, ZrO2, Ln203 (лантан и другие редкоземельные элементы). Чтобы получить пленки таких оксидов на поверхности кремния, надо создать исходные реагенты с высокой летучестью и относительной термической стабильностью, которые смогут легко гидролизоваться (или вступать в другие реакции разложения) с образованием аморфных оксидов на поверхности кремния. В лаборатории координационной химии МГУ синтезировали новые молекулярные прекурсоры на основе насыщенных комплексов металла с лигандами, образующими относительно слабые донорно-акцепторные связи.
Комплексы с органическими лигандами использовали и для решения другой важнейшей проблемы — получения термозащитных покрытий на лопатках газотурбинных двигателей. Оказалось, что лучше всего покрытия, полученные осаждением ZrO2 (Y2O3) из паров бета-дикетонатов соответствующих металлов. Процесс недорогой, поскольку можно использовать недорогой ацетилацетат. То, что полимерный Y(AcAc)3 недостаточно летуч, легко устраняется его совместным испарением с летучим Zr(AcAc). — при этом испарение происходит гораздо полнее.
4.2. Кристаллохимический дизайн
Сотрудники кафедры неорганической химии МГУ разработали концепцию структур срастания и использовали ее для поиска новых материалов. Что такое структуры срастания?
Например, возьмем кристалл WO3. Его стабильная модификация (со структурой типа ReO3) получается в результате сочленения октаэдров, так что они имеют только общие вершины и больше ничего общего у них нет. Если представить, что одна часть структуры смещается относительно другой, то тогда общими становятся не только вершины, но и грани. Такое смещение происходит при переходе к нестехиометрическим составам. Практически это делают следующим образом. В WO3 на каждый атом вольфрама приходится три атома кислорода. Если отжигать такой кристалл при пониженном давлении кислорода, то он частично восстанавливается, теряя какую-то часть кислорода и сохраняя при этом кристаллическую структуру (на такое восстановление способны не все оксиды, например оксид никеля восстанавливается скачком, изменяя состав с образованием металлического никеля). Структура срастания — это фаза с нестехиометрическим соотношением атомов, и ее можно представить как сдвиг одной части кристаллов относительно другой. Этот сдвиг повторяется через определенное число октаэдров, а увидеть его можно на электронных микроскопах высокого разрешения. Надо отметить, что структуры срастания оказались стабильны в довольно широком диапазоне температур.
Концепция структур срастания показала себя очень эффективной при синтезе новых высокотемпературных сверхпроводников на основе сложных оксидов меди. В них входит перовскит (ABO3) или его фрагмент, который становится одним из блоков структур срастания (рис. 1). Новые сверхпроводники синтезировали, перебирая различные структуры, подобно тому как это делается при синтезе органических соединений. Но в данном случае надо было рассматривать не изолированные группы атомов, как в органических молекулах, а бесконечные двумерные слои, объединенные в блоки.
Рис. 8. Новые сверхпроводники: HgBa2Can–1CunO2n+2+δ (изображение: «Химия и жизнь»)
Такое кристаллохимическое моделирование позволило Е.В. Антипову и С.Н. Путилину (кафедра неорганической химии МГУ) спрогнозировать существование и синтезировать новое семейство сверхпроводников HgBa2Can–1CunO2n+2+δ, которое обладает рекордно высокими значениями критической температуры (у лучшего представителя 135 К). Температуры перехода в сверхпроводящее состояние у таких соединений сильно зависят от содержания кислорода и числа слоев (CuO2). Потом оказалось, что если добавить еще и атомы фтора, то это расширяет область поиска Cu-содержащих сверхпроводников (оксифторидов). Особенно надо отметить синтез HgBa2Ca2Cu3O8F0,32 — в этом веществе внедрение фтора вызвало анизотропное химическое сжатие и привело к возрастанию Тс до рекордно высокого значения 138 К.
Принципиально новый подход к дизайну новых материалов (разработан А.Р. Каулем с сотрудниками) — эпитаксиальная стабилизация неустойчивых оксидов в виде тонких пленок. Эпитаксия — это когда одно вещество удается кристаллизовать на поверхности другого, заставляя его принять ту структуру, которую имеет подложка. Матрица как бы навязывает пленке свое строение.
Так, ученые МГУ синтезировали новые соединения RBО3 (R — редкоземельный элемент, В = Ni, Co, Mn, Fe, In) с различными свойствами: сегнетоэлектрики (RFeО3 и RMnО3), материалы с переходом «металл—диэлектрик» (RNiО3, RCоО3) и магнитные материалы (R3Fe5O12). Оказалось, что эпитаксиальную стабилизацию можно с успехом использовать в производстве тонкопленочных материалов для микроэлектроники.
Конечно, конструирование функциональных материалов не сводится только к кристаллохимическому дизайну. Можно использовать систему физико-химических принципов, достаточно давно сформулированных автором этой статьи. Ее с успехом применили для оптимизации свойств ферритов, магнитных полупроводников, электронно-ионных проводников, керамических электролитов, пьезокерамики и т. д.
4.3. Неорганическая наномолекулярная и супрамолекулярная химия
Интерес к наноматериалам связан, в частности, с их необычными физическими свойствами. Принято, что наноматериалы, в отличие от обычных материалов, состоят из частиц меньше 100 нм — именно в этой области происходит резкое изменение свойств. Например, уменьшение размеров полупроводниковых частиц ниже некоторого критического значения может привести к изменению ширины запрещенной зоны, генерации второй гармоники, эффектам размерного квантования энергетических уровней. При этом, наверное, самая большая проблема — предрасположенность свободных наночастиц к агрегации: это сильно затрудняет их практическое применение. Один из путей решения этой проблемы — нанести наночастицы на инертную матрицу, которая защитит их от воздействия окружающей среды и предотвратит агрегацию. Методами получения таких нанокомпозитов тоже занимается неорганическая химия.
Как матрицу для нанокомпозитных материалов можно использовать кремнеземы. Их большое преимущество — высокоупорядоченные поры с диаметром от 20 до 100 А. Пористых материалов много, но кремнеземы в своем роде уникальны, поскольку у них довольно однородное распределение пор по размерам, а также очень высокая удельная поверхность (1000 м2/г). Пористый SiO2, можно использовать как матрицу для синтеза наночастиц металла, полупроводниковых соединений, а также полианилиновых и углеродных волокон.
Cl (получен высокотемпературным синтезом. Изображение: «Химия и жизнь»](https://fs.znanio.ru/8c0997/de/01/e10e8196eb185b233de6fa10263bffc60f.jpg)
Рис. 9. Упорядоченное расположение гостей двух типов — TiCl63– и Cl– — в полостях трехмерного каркаса [Hg6P4]4+ в супрамолекулярном ансамбле [Hg6P4](TiCl6)Cl (получен высокотемпературным синтезом).
Сегодняшний этап развития неорганической супрамолекулярной химии — это супрамолекулярные ансамбли, обладающие благодаря особенностям архитектуры особыми свойствами. Их строение определяется структурой каркаса «хозяина», а функциональные свойства — природой «гостя». Возьмем, к примеру, полупроводниковые клатраты. У них в полостях каркаса «хозяина» размещены атомы «гостя» с координационными числами 20 и 24. Гостевые атомы не связаны с каркасом ковалентными связями и могут колебаться с такими частотами, которые обеспечивают эффективное рассеяние теплопроводящих фононов. У таких материалов очень низкое (как у стекол) значение теплопроводности. В то же время каркас обеспечивает высокие концентрацию и подвижность носителей заряда. Все это делает клатраты перспективными веществами для создания термоэлектрических материалов.
Новое направление неорганической супрамолекулярной химии исследует контролируемую самосборку упорядоченных супрамолекулярных ансамблей в высокотемпературных реакциях, когда реакционная система сложна и не поддается анализу. Основой для таких процессов служит взаимная подстройка «гостя» и «хозяина». Первый служит шаблоном для формирования каркаса определенной топологии и геометрии, но при этом и сам изменяет свои параметры, подчиняясь требованиям «хозяина». Пример — структура [Hg6P4](TiCl6)Cl, сформированная за счет самосборки TiCl63– и Сl– в полостях каркаса [Hg6P4]4+ .
4.4. Соединения переменного состава
Соединения переменного состава открыл более 100 лет назад Н.С. Курнаков и назвал их бертоллидами. Позднее оказалось, что практически все неорганические твердофазные соединения с ионным типом связи имеют непостоянный состав. Возьмем, к примеру, поваренную соль NaCl. Кажется, что это соединение постоянного состава, а на самом деле — переменного. Причем его кристаллическая структура будет сохраняться, даже если на один атом натрия придется больше (или меньше), чем один атом хлора. И хотя отклонение состава от стехиометрического очень невелико (порядка 10–5–10–7), это уже влияет на свойства вещества и потому становится очень важным в науке о материалах. Например, бесцветный (и стехиометрический) NaCl, обработанный парами натрия при высоких температурах, станет голубым и начнет проводить электрический ток. Если NaCl обработать парами хлора, то он позеленеет и тоже станет проводником, но не за счет движения электронов, а за счет подвижных дырок. Выходит, что можно получать вещества с различными свойствами, не изменяя кристаллической структуры.
В зависимости от элементов, которые входят в состав соединений переменного состава, область их существования может быть широкой (моноксиды титана и железа) или, наоборот, крайне узкой (галогениды щелочных металлов, халькогениды цинка, свинца, кадмия). Если отклонения от стехиометрии невелики, то такой материал можно описывать как модель с точечными дефектами или внедренными атомами, не взаимодействующими друг с другом. Когда степень нестехиометрии возрастает, изменения, происходящие в кристаллах, имеют другую природу (например, образуются ассоциаты). Подробным исследованием структуры таких соединений занимаются многие исследователи, но тут пока не все ясно.
Есть немало систем с так называемой бесконечно адаптируемой структурой. Они сохраняют свою структурную организацию при непрерывном изменении состава и без участия точечных дефектов. Способностью адаптироваться, как оказалось, обладают фазы переменного состава Y(OF)2,13–2,22 и твердые растворы ТiO2(Cr2O3).
Все уже полученные знания в этой области можно применить к любым вновь созданным материалам: сверхпроводящим купратам, манганитам с колоссальным магнитным сопротивлением или цератам с высокой протонной проводимостью. Но каждый из них имеет собственную специфику и потому требует проведения собственных исследований нестехиометрии.
Именно среди таких соединений с переменным составом удалось найти сверхпроводящий материал, сохраняющий высокий уровень критических токов в сильных магнитных полях, — например, неодим-бариевый купрат Nd1–xBa2–xCu3Oz.
А вот иттрий-бариевый купрат YBa2Cu3Oz со строгой катионной стехиометрией такими свойствами не обладает.
4.5. Элементы в аномальных степенях окисления
Идея создавать новые материалы на основе элементов в необычных степенях окисления пока кажется довольно странной. Очевидная причина — аномальная степень окисления равносильна нестабильному состоянию этого элемента. Получать подобные материалы можно только в том случае, когда такой необычный элемент существует достаточно долго. Но тем не менее исследования эти необычайно интересны.
Большой вклад в химию элементов, находящихся в аномальной степени окисления, внесли исследователи из Института физической химии РАН и химического факультета МГУ. Они получили NpVII, PuVII, AmVII, CmVI, CmV, серию актинидов и лантанидов в низших степенях окисления, показали возможность существования TmIV.
С точки зрения материаловеда, наиболее интересны «матричные» системы. Их получают кристаллизацией из раствора или расплава, соосаждением или твердофазным синтезом. Так удалось синтезировать матричные системы, содержащие Fe(IV), Fe(V), Fe(VI) и Co(VI). Возможен и другой путь синтеза — когда легирующий ион замещает металл в матрице, свойства которой предопределяют состояние окисления этого легирующего иона. Так, в пентаоксиде ванадия стабилизируется Fe(V), причем это необычное окислительное состояние возникает просто при растворении в расплаве пентаоксида ванадия оксида трехвалентного железа. Правда, реально получить Fe(V) удалось только после быстрой закалки образцов. Известны также соединения висмута в низших степенях окисления (Bi53+, Bi85+ и Bi95+) и никеля.
Со всеми подобными соединениями очень трудно работать, поскольку они малостабильны. Свойства их почти не изучены, и не очень понятна перспектива их применения.
4.6. Неорганические биоматериалы
У таких, казалось бы, прочных природных материалов, как костная и зубная ткани, тем не менее постоянно появляются проблемы. Кость, с точки зрения материаловеда, — это композиционный материал, состоящий из гидроксилапатита Ca10(PO4)6(OH)2 (63% вес.) и белка коллагена (20% вес.) (рис. 4). Кроме того, в кости есть заметные количества ионов Na+, Mg2+, К+, Сl–, F–, СО32–. Что обеспечивает высокую прочность кости, так до конца и непонятно. Поэтому даже самыми современными методами пока невозможно создать полный аналог костной ткани. Единственная альтернатива — имплантаты.
Рис. 10. Гидроксилапатит
Когда требуется восстановить участки, подверженные серьезным циклическим нагрузкам (например, тазобедренный сустав), используют металлические сплавы на основе малотоксичного титана. В остальных случаях предпочитают более похожую по составу на кость керамику или композиты с фосфатом кальция. Современная тенденция — «регенерационный» подход, то есть создание и использование материалов, которые взаимодействуют с организмом и стимулируют восстановление ткани. Такие имплантаты невозможно создать без глубокого понимания физиологических процессов.
Считают, что важен не только химический состав, но и структура кристаллов гидроксилапатита, поскольку это определяет отклик организма на чужеродный материал. С этой точки зрения идеально вещество, во всем подобное костному биоминералу. Этого добиться очень сложно, тем более в промышленных масштабах. Тем не менее химическое и структурное соответствие биоматериала костной ткани — один из основных принципов в этой области. Варьируя эти параметры, можно делать биоматериалы с заданной биоактивностью.
Синтез, модификация и исследование фосфатов кальция с заданным составом и микроморфологией, оценка их будущей биоактивности — большая и неординарная задача для химиков. Уже известно, как образуется и гидролизуется гидроксилапатит. Увеличить его биологическую активность можно двумя путями: уменьшить размеры кристаллов (благодаря чему увеличивается удельная поверхность) и изменить физико-химические характеристики поверхности, то есть химически ее модифицировать. При втором подходе возможно создать материалы, которые активно рассасывались бы при контакте с жидкостями организма. Перспективными считают карбонатсодержащий гидроксилапатит Ca10–0,5x(PO4)6–x(CO3)·(OH)2, а также кремнийсодержащий гидроксилапатит:
![]()
То, что после полувекового активного применения биоматериалов исследователи пытаются сделать такой, который бы стимулировал регенерацию костной ткани, означает, что пришло понимание исключительной сложности задачи. Применение того или иного материала зависит и от характеристики костного дефекта, и от конкретного клинического случая. Поэтому надо иметь целый спектр искусственных заменителей, чтобы можно было выбрать то, что подходит конкретному больному.
4.7. Синтез с помощью физических воздействий
Каков бы ни был механизм химических превращений, чтобы они начались, смесь надо активизировать. Самое простое — нагрев, эффективность которого можно оценить величиной энергии активации в уравнении Аррениуса. Однако эта величина (ее можно экспериментально определить как температурный коэффициент скорости реакции) имеет физический смысл только тогда, когда ее можно связать с определенным элементарным процессом, лимитирующим реакцию в рассматриваемом температурном диапазоне.
В реальных же синтезах материалов химическое взаимодействие складывается по меньшей мере из двух фундаментальных процессов — собственно химической реакции и переноса вещества к реакционной зоне. Поскольку последний процесс зависит от диффузии, а в твердом теле подвижность составных частей определяется дефектностью его структуры, то в результате дефекты существенно влияют на условия твердофазного синтеза. А значит, скорость и направление химической реакции можно изменять с помощью различных физических воздействий (с нагревом или без). Нагрева как раз пытаются избежать, поскольку могут происходить нежелательные изменения.
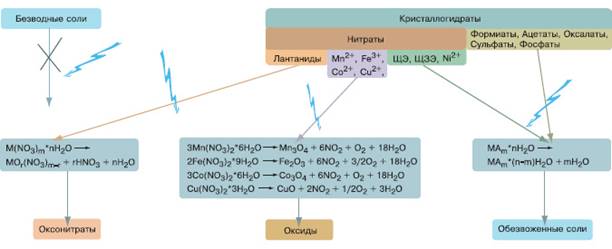
Рис. 11. Взаимодействие кристаллогидратов солей металлов с микроволновым излучением
Начнем с ультразвука. Его эффективность зависит от фазового состояния системы. Если это жидкость (растворы, расплавы), то после ультразвукового воздействия происходит кавитация, то есть возникновение, осцилляции и коллапс микропузырьков. В результате формируются короткоживущие «горячие зоны», с температурой до 5000 К и давлением до 1000 атм. В некоторых случаях после схлопывания кавитационных пузырьков возникают интенсивные микропотоки жидкости и мощные локальные ударные волны, которые ускоряют массоперенос. Как следствие — разлагаются летучие соединения (карбонилы металлов), ускоряются окислительно-восстановительные реакции, образуются стабильные эмульсии и суспензии. Оказалось, что ультразвук очень эффективен в жидкофазных системах при проведении классических реакций неорганического синтеза, а также при получении нанопорошков металлов, оксидов и карбидов.
Если реакция идет в твердой фазе, то ультразвук увеличивает плотность дислокаций и эффективные коэффициенты диффузии, а также способствует новым межфазным контактам. Возможно даже, что изменится механизм реакции и снизится температура взаимодействия реагентов. Акустическая активация процессов в твердой фазе дала возможность синтезировать оксидные материалы, получить активные формы исходных реагентов, а иногда и направленно изменять конечные свойства продуктов.
В последние 10–12 лет исследователи предпринимали немало попыток микроволнового синтеза и спекания материалов. Но между тем физико-химическая природа происходящих при этом процессов так и осталась малоизученной. Микроволнами обрабатывали разнообразные оксиды, гидроокиси, соли или их смеси друг с другом, получая при этом самые разные материалы — ферриты, манганиты, кобальтиты, никелаты и купраты.
Согласно теории, для того чтобы микроволновое излучение взаимодействовало с веществом и последнее поглощало энергию, нужно, чтобы в нем были либо диполи, способные переориентироваться и вращаться под микроволновым воздействием, либо свободные носители зарядов, которые могут перемещаться при наложении микроволнового поля. Многие неорганические соли имеют низкую проводимость, а с другой стороны, у молекул воды в кристаллогидратах, а также у некоторых анионов есть значительный дипольный момент. Поэтому в большинстве солевых систем поглощение микроволнового излучения, вероятнее всего, связано с диполями.
Экспериментально известно, что соединения, не содержащие химически связанной воды (карбонаты, нитраты, оксалаты щелочных и щелочно-земельных элементов), практически не поглощают микроволнового излучения. Напротив, кристаллогидраты неорганических солей взаимодействуют с микроволновым полем (рис. 5), причем то, как это происходит, зависит от химической природы катионов. В итоге — микроволновая обработка смеси солей довольно эффективна, поскольку после их разложения образуются высокодисперсные частицы оксидов, равномерно распределенные по реакционному объему, которые активно взаимодействуют друг с другом. Кроме того, при микроволновой обработке смеси не только увеличивается скорость реакции, но и понижается температура взаимодействия — это также наблюдали экспериментально.
Заключение
Учение о том, что все вещества состоят из мельчайших частиц, получило название атомистической теории. Догадки древних, основанные лишь на размышлении, не так уж далеки, в принципе, от современных представлений: существует ограниченное число различных типов атомов (т.е. элементов), которые могут по-разному соединяться друг с другом, давая огромное разнообразие веществ с разными свойствами. А процесс перестройки взаимного расположения атомов составляет сущность химической реакции. Понятие об атомах, элементах – величайшее достижение человеческого разума. Очень образно об этом сказал лауреат Нобелевской премии по физике Ричард Фейнман: «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это – атомная гипотеза (можно называть ее не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
За последние два десятилетия неорганическая химия разительно изменилась благодаря тесному взаимодействию с физической химией, физикой твердого тела, органической химией, биохимией, а также применению современных инструментальных методов исследования. Необыкновенно расширился круг объектов неорганической химии. К ним теперь причисляют не только соединения, но и материалы, причем помимо неорганической составляющей они часто содержат органические, полимерные или биополимерные фрагменты.
Большинство объектов изучают на нескольких уровнях — кроме кристаллической или молекулярной структуры исследуют электронную и магнитную, структуру дефектов кристаллического строения, распределение микропримесей, структуру границ раздела в поликристаллических веществах, наноструктуру, структуру микро- и мезопор, поверхностей, а также влияние всех перечисленных уровней на свойства вещества. О каком кризисе можно говорить, когда перед химиками столь обширное поле деятельности?
В нашей курсовой работе мы рассмотрели процессы открытия важнейших химических элементов в неорганической химии, показали великих ученых, вложивших свой вклад в данную науку, рассказали роль химии в современном мире.
Цели дипломной работы достигнуты.
Приложения:
1. Таблица Менделеева
2. Таблица растворимости

Список используемой литературы:
1. Билл Стеймен. «Полный справочник вредных, полезных и нейтральных веществ, которые содержатся в пище, косметике, лекарствах», «Эксмо - пресс», 2003.
2. Бобырев В.Г., Кузьмин Н.М. Физические и химические методы исследования. ‑ Волгоград: ВСШ МВД, 1979.
3. Габриелян О.С. Химия. 8 класс: учебник. – М.: Дрофа, 2011.
4. Габриелян О.С., Лысова Г.Г. Учебное пособие для выпускных классов общеобразовательных учебных заведений. – Москва, 2000.
5. Глинка Н.Л. Общая химия: Учебное пособие для ВУЗов / Под ред. В.А. Рабиновича. ‑ Л.: Химия, 1983.
6. Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа: Учебное пособие. ‑ М.: Высшая школа, 1991.
7. Зайцев А.Н. О безопасных пищевых добавках и «зловещих» символах «Е» журнал «Экология и жизнь», № 4, 1999.
8. Кукушкин Н.Н. Химия вокруг нас – М.: Высшая школа, 1992.
9. Машковский, М.Д. Лекарственные средства: в 2 т. / М.Д. Машковский - 14-е изд., перераб. и доп. - М.: Новая волна, 2004. - Т. 1. Научно-методический журнал «Химия» в школе, «Центр Химпрес» (за 2001-2003 гг.).
10. Пичугина Г.В. «Повторяем химию на примерах из повседневной жизни» - Москва: «Аркти», 2000.
11. Третьяков Ю.Д. и др. Химия и современность: Пособие для учителя. – М.: Просвещение, 1985.
12. Фигуровский Н. А. Открытие элементов и происхождение их названий. — М.: Наука, 1970. 207 с.
13. Хомченко, "Общая химия": учебник. – М.: ООО изд. "Новая Волна": ЗАО
"Издательский дом ОНИКС". 1999 г. – 464 с. © Хомченко И.Г., 1997 г.
14. Чернобельская Г.М. «Методика обучения химии в средней школе», Москва «Владос», 2000.
15. Юдин А.М., В.Н. Сучков. «Химия для Вас». – М.: Химия, 2001 Шульгин Г.Б. «Химия для всех», Москва, «Знание», 1987.
16. Энциклопедия для детей. Химия. – М.: Аванта +, 2005.
17. «Энциклопедия школьника. Точные науки.» под редакцией П. Кошеля. Олма-Пресс, 2004 год.
18. www.eco.nw.ru/lib/data/07/3/030307.htm - пищевые добавки.
19. http://www. en. edu. ru/catalogue/3 – научный образовательный портал.
20. http://e-science. ru/ - портал естественных наук.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.