
федеральное государственное бюджетное образовательное учреждение
высшего образования
«Мичуринский государственный аграрный университет»
Центр-колледж прикладных квалификаций
КОНСПЕКТЫ ЛЕКЦИЙ
дисциплины
ЕН. 03 ХИМИЯ (раздел ОХ)
программы подготовки специалистов среднего звена (ППССЗ)
по специальности 19.02.05 Технология бродильных производств и виноделие
Базовая подготовка
Преподаватель: Филиппова Татьяна Ивановна
Рассмотрены на заседании ЦМК технических специальностей
Протокол №1 от «31» августа 2022 г
Председатель ЦМК___________/В.В.Кусова/
Мичуринск-2022
Оглавление
Предмет органической химии……………………………………………………………………..3
Алканы……………………………………………………………………........................................7
Алкены……………………………………………………………………………………………...10
Алкадинены………………………………………………………………………………………..16
Алкины……………………………………………………………………………………….…….17
Арены………………………………………………………………………………………………29
Предельные одноатомные спирты……………………………………………………………….33
Многоатомные спирты. Фенолы…………………………………………………………………36
Простые эфиры ……………………………………………………………………………………41
Альдегиды и кетоны………………………………………………………………………………41
Карбоновые кислоты………………………………………………………………………………45
Непредельные карбоновые кислоты…………………………………………………………… 49
Двухосновные карбоновые кислоты…………………………………………………………… 51
Сложные эфиры……………………………………………………………………………………53
Оксикислоты…………………………………………………………………………………….. 55
Кетонокислоты и альдегидокислоты……………………………………………………………. 59
Аминокислоты……………………………………………………………………………………..60
Белки………………………………………………………………………………………………. 64
Липиды…………………………………………………………………………………………… 67
Моносахариды……………………………………………………………………………………..73
Дисахариды ………………………………………………………………………………………..79
Полисахариды…………………………………………………………………………………… 82
Витамины…………………………………………………………………………………………..87
Ферменты…………………………………………………………………………………………..89
Пищевые добавки……………………………………………………..………………………….. 90
Предмет органической химии
Органическая химия – это химия углеводородов и их производных, т.е продуктов образующихся при замене водорода другими атомами или группами атомов.
Критерием деления соединений на органические и неорганические служит их элементный состав.
К органическим соединениям относятся химические вещества, содержащие в своем составе углерод, например
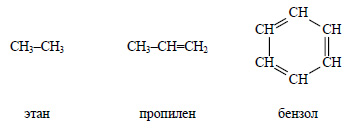
за исключением простейших (оксидов углерода, угольной кислоты и ее солей, карбидов)
Органические соединения отличаются от неорганических рядом характерных особенностей:
- почти все органические вещества горят или легко разрушаются при нагревании с окислителями, выделяя СО2 (по этому признаку можно установить принадлежность исследуемого вещества к органическим соединениям);
- в молекулах органических соединений углерод может быть соединен почти с любым элементом Периодической системы;
- органические молекулы могут содержать последовательность атомов углерода, соединенных в цепи (открытые или замкнутые);
- молекулы большинства органических соединений не диссоциирует на достаточно устойчивые ионы;
- реакции органических соединений протекают значительно медленнее и в большинстве случаев не доходят до конца;
- среди органических соединений широко распространено явление изомерии;
- органические вещества имеют более низкие температуры фазовых переходов (т.кип., т.пл.).
Многочисленность и разнообразие органических соединений требует особого внимания к их классификации. В основу этой классификации положены два главных структурных признака молекул: строение углеродной цепи, наличие и природа функциональной группы.
Углеродная цепь (углеродный скелет молекулы) - последовательность химически связанных между собой атомов углерода.
Функциональная группа - атом или группа атомов, определяющая химические свойства соединения и его принадлежность к конкретному классу.
Краткая история развития органической химии.
Впервые понятия об органических веществах и об органической химии ввёл шведский учёный Берцелиус. В своём учебнике химии Берцелиус (1827) высказывает убеждение, что "... в живой природе элементы повинуются иным законам, чем в безжизненной" и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой "жизненной силы". Органическую химию он и определил, как химию растительных и животных веществ. Последующее развитие органической химии доказало ошибочность этих взглядов.
В 1928 году Вёллер показал, что неорганическое вещество - циановокислый аммоний-при нагревании превращается в продукт жизнедеятельности животного организма-мочевину.
В 1845 г. Кольбе синтезировал органическое вещество - уксусную кислоту, в качестве исходных веществ он использовал древесный уголь, серу, хлор и воду. За сравнительно короткий период были синтезированы и другие органические кислоты, которые раньше выделялись только из растений.
В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу спиртов.
В 1861 г. А.М.Бутлеров действуя известковой водой на параформальдегид впервые осуществил синтез метиленитана, которое относится к сахарам, которые играют важную роль в процессах жизнедеятельности организмов.
Развитие органической химии
требовали разрешения вопроса, являются ли молекулы беспорядочным нагромождением
атомов, удерживаемых силами притяжения, или же они представляют собой частицы с
определённым строением, которое можно установить, исследуя свойства вещества. В
органической химии к тому моменту накопились факты и обобщения, которые могли
служить основой для решения вопроса о строении молекул.
Решающую роль сыграло открытие валентности элементов. Её открытие
непосредственно подводило к мысли, что молекулы имеют определённое строение.
Оставался открытым вопрос: как определять строение молекулы.
Этот вопрос не мог быть решён без подлинно научной теории органической химии, которая и была создана А.М.Бутлеровым в 1861 году. Он писал: "Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы, я называю химическим строением распределение действия данной сил, вследствие которого химические атомы, посредственно влияя друг на друга, соединяются в химическую частицу."
Основные положения теории строения химических соединений.
Теория химического строения органических соединений, выдвинутая А. М. Бутлеровым во второй половине прошлого века (1861 г.), была подтверждена работами многих ученых, в том числе учениками Бутлерова и им самим. Оказалось возможным на ее основе объяснить многие явления, до той поры не имевшие толкования: изомерию, гомологию, проявление атомами углерода четырехвалентности в органических веществах. Теория выполнила и свою прогностическую функцию: на ее основе ученые предсказывали существование неизвестных еще соединений, описывали свойства и открывали их.
Так, в 1862—1864 гг. А. М. Бутлеров рассмотрел изомерию пропиловых, бутиловых и амиловых спиртов, определил число возможных изомеров и вывел формулы этих веществ. Существование их позднее было экспериментально доказано, причем некоторые из изомеров синтезировал сам Бутлеров.
В течение XX в. положения теории химического строения химических соединений были развиты на основе новых воззрений, распространившихся в науке: теории строения атома, теории химической связи, представлений о механизмах химических реакций. В настоящее время эта теория имеет универсальный характер, то есть справедлива не только для органических веществ, но и для неорганических.
Первое положение. Атомы в молекулах соединяются в определенном порядке в соответствии с их валентностью. Углерод во всех органических и в большинстве неорганических соединений четырехвалентен. Очевидно, что последнюю часть первого положения теории легко объяснить тем, что в соединениях атомы углерода находятся в возбужденном состоянии:
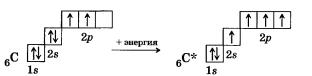
а) атомы четырехвалентного углерода могут соединяться друг с другом, образуя
различные цепи:
- открытые разветвленные,
- открытые неразветвленные
- замкнутые
б)
порядок соединения атомов углерода в молекулах может быть различным и зависит
от вида ковалентной химической связи между атомами углерода — одинарной или
кратной (двойной и тройной).
Второе положение. Свойства веществ зависят не только от их
качественного и количественного состава, но и от строения их молекул.
Это положение объясняет явление изомерии. Вещества, имеющие одинаковый состав,
но разное химическое или пространственное строение, а следовательно, и разные
свойства, называют изомерами.
Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком связи атомов в молекулах:
1) изомерия углеродного скелета
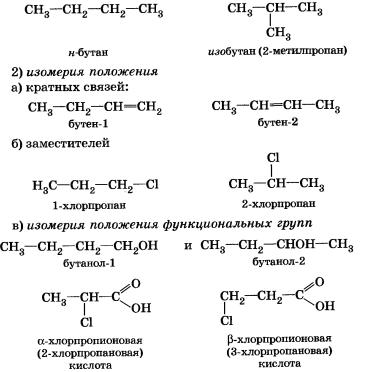
3)изомерия гомологических рядов (межклассовая)
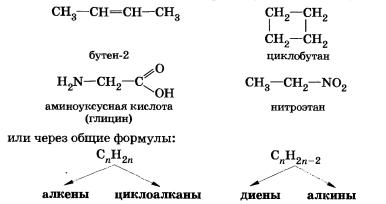
4)Пространственная изомерия, при которой молекулы веществ
отличаются не порядком связи атомов, а положением их в пространстве:
цис-транс-изомерия (геометрическая).
Третье положение. Свойства
веществ зависят от взаимного влияния атомов в молекулах.
Например, в уксусной кислоте в реакцию со щелочью вступает только один из четырех
атомов водорода. На основании этого можно предположить, что только один атом
водорода связан с кислородом:
![]()
С другой стороны, из структурной формулы уксусной кислоты можно сделать вывод о наличии в ней одного подвижного атома
водорода, то есть о ее одноосновности.
Основные направления развития теории строения химических соединений и ее
значение
Во времена А. М. Бутлерова в органической химии широко использовали
эмпирические (молекулярные) и структурные формулы. Последние отражают порядок
соединения атомов в молекуле согласно их валентности, которая обозначается
черточками.
Для простоты записи часто используют сокращенные структурные формулы, в которых
черточками обозначают только связи между атомами углерода или углерода и
кислорода.
Сокращенные структурные формулы
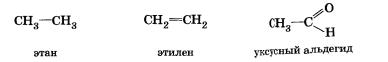
Затем, по мере развития знаний о природе химической связи и о влиянии электронного строения молекул органических веществ на их свойства, стали пользоваться электронными формулами, в которых ковалентную связь условно обозначают двумя точками. В таких формулах часто показывают направление смещения электронных пар в молекуле.
Значение органической химии
Органическая химия имеет исключительно важное научное и практическое значение. Объектом её исследований в настоящее время являются более 20 млн. соединений. Поэтому органическая химия стала крупнейшим и наиболее важным разделом современной химии. Все многообразие органических веществ можно условно разделить на три типа:
А) Природные органические вещества и их превращения лежат в основе явлений Жизни. Поэтому органическая химия является химическим фундаментом биологической химии и молекулярной биологии - наук, изучающих процессы, происходящие в клетках организмов на молекулярном уровне. Исследования в этой области позволяют глубже понять суть явлений живой природы.
Б) Искусственные – это продукты химических преобразований природных веществ в соединения, которые в живой природе не встречаются. Так на основе природного органического соединения целлюлозы получают искусственные волокна (ацетатное, вискозное и др.)
В) Синтетические – это соединения, которые получают синтетическим путем, то есть соединением простых молекул в более сложные, не встречающиеся в природе. К ним относятся, например, синтетические каучуки, пластмассы, лекарственные препараты, красители и т.п.
Успехи в области получения и использования органических соединений имеют большое значение для промышленности, сельского хозяйства, бытовых нужд. Без знания основ органической химии современный человек не способен экологически грамотно использовать все эти продукты цивилизации.
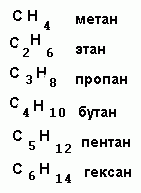
АЛКАНЫ
(предельные углеводороды,
парафины)![]()
Суффикс -ан является характерным для названия всех алканов
Алканы – алифатические (ациклические=нециклические)
предельные (=связь С-С - одинарная) углеводороды, в
которых атомы углерода связаны между собой простыми (одинарными) связями в
неразветвленные или разветвленные цепи.
Алканы – название предельных углеводородов по международной номенклатуре.
· Парафины– исторически сложившееся название, отражающее свойства этих соединений (от лат. parrum affinis – имеющий мало сродства, малоактивный). Кстати, это название очень четко отображает химические свойства алканов - "малоактивные"
Предельными, или насыщенными, эти углеводороды
называют в связи с полным насыщением углеродной цепи атомами водорода.
Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации.
Тип углеродной связи — σ-связи (см. Неорганическую химию)
Общая формула алканов:
СnH2n+2
Если мы подставим n=1, то получим формулу
метана - СН4
n=2
-
этана - C2H6
Гомологи обладают сходными химическими
свойствами.
Физические свойства:
С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность.
Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Смесь метана с кислородом взрывоопасна!
Метан еще называют болотным или рудничным газом, он встречается в земной коре в виде свободных скоплений (залежей), в растворённом (в нефти, пластовых и поверхностных водах). И если посмотреть информацию из новостей - довольно часто происходят взрывы в шахтах. Гибнут люди...
Химические свойства.
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.).
1. Реакция окисления: при внесении в открытое пламя алканы горят:
Общее уравнение горения:
![]()
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом - "синтез-газ":
![]()
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
2. Крекинг – процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью
Крекинг алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел и т.п., а также сырья для химической и нефтехимической промышленности.
![]()
Как написать уравнение крекинга?
1.Берем исходное вещество и как бы делим его напополам: 4:2 - получается С2
2.“Достраиваем” его до алкана по общей формуле- С2Н6
3.А оставшееся вещество составляем из “остатков” - 2 и 4: С2Н4 - это алкен
Реакции замещения:
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.
![]()
При достаточном количестве хлора реакция продолжается дальше и приводит к
образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
![]()
![]()
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Дегидрирование алканов
![]()
При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO) происходит их каталитическое дегидрирование – отщепления атомов водорода за счет разрыва связей С—Н.
Циклизация:
Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например
: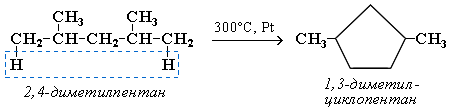
Изомеризация:
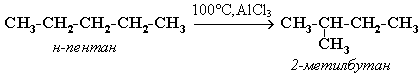
Почти все реакции с участием алканов идут при нагревании и в присутствии катализатора, при обычных условиях они пассивны.
Получение:
1. Крекинг нефти (промышленный способ)
![]()
2. Гидpиpование непpедельных углеводоpодов:
3. Из неорганических веществ:
![]()
4. Реакция Вюрца:
![]()
5. Электролиз по Кольбе
![]()
6. Разложение карбидов металлов водой:
![]()
Алкены (олефины).
Алкены – органические соединения, углеводороды алифатического (ациклического) непредельного характера, в молекуле которых между атомами углерода – одна двойная связь, и которые соответствуют общей формуле CnH2n.
Для алкенов характерна sp2-гибридизация. Длина двойной связи 0,134нм, она более прочная, чем одинарная, так как ее энергия больше. Одновременно, наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
В названии алкенов содержится суффикс –ен или –илен, обозначающий принадлежность соединения к данному классу.
Гомологический ряд
C2H4 – этен, C3H6 – пропен, C4H8 – бутен, C5H10 – пентен, C6H12 – гексен и т. д Простейший алкен: C2H4 или H – C = C – H этен или этилен,
| |
H H
Его радикал: C2H3- или CH2=CH- винил.
Правила номенклатуры алкенов
1.Выделяют в структурной формуле наиболее длинную цепь атомов углерода, включающую двойную связь, и нумеруют их с того конца, к которому ближе двойная связь.
2.В начале названия цифрой указывают положение замещающей группы (радикала).
3.Если замещающих групп несколько, цифрами отмечают каждую из них.
4.После названия замещающей группы (радикала) называют всю неразветвлённую углеродную цепь.
5.В конце названия обозначают положение двойной связи номером того атома углерода, от которого она начинается. Пример:
![]() СН3-С=СН-СН3 2-метилбутен-2
СН3-С=СН-СН3 2-метилбутен-2
СН3
В определении названия алкена положение кратной связи имеет при нумерации преимущество перед остальными.
CH3 Cl CH3
7 6| 5| 4| 3 2 1
CH3 – CH – CH – C – CH = CH – CH3
|
C2H5
4,6-диметил-4-этил-5-хлоргептен-2
Для алкенов характерны следующие виды изомерии:
1. Структурная изомерия:
а) изомерия углеродного скелета
1 2 3 4 5 1 2 3 4
CH2=CH – CH2 – CH2 – CH3 CH2=CH – CH – CH3
|
CH3
пентен-1 3-метилбутилен-1
б) изомерия положения кратной связи
1 2 3 4 5 1 2 3 4 5
CH2=CH – CH2 – CH2 – CH3 CH3–CH = CH – CH2 – CH3
пентен-1 пентен-2
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.)
1 2 3 4 5 1 2 3 4 5
CH2=CH – CH – CH2 – CH3 CH2=CH – CH2 – CH – CH3
| |
Cl Cl
3-хлорпентен-1 4-хлорпентен-1
2. Пространственная изомерия:
а) геометрическая изомерия
1 2 3 4
CH3 – CH = CH – CH3
бутилен-2
CH3 CH3 CH3 H
\ / \ /
C=C C=C
/ \ / \
H H H CH3
цис-изомер транс-изомер
3. Межклассовая изомерия (с циклоалканами)
1 2 3 4 5
CH2=CH – CH2 – CH2 – CH3 CH2 – CH2
пентен-1 ! !
CH2 CH2
\ /
CH2
циклопентан
Физические свойства.
C2H4 – C4H8 – газы, C5H10 – C16H32 - жидкости, C17H34 – … – твердые вещества. Алкены плохо растворимы в воде. Их температуры плавления и кипения закономерно повышаются при увеличении молекулярной массы соединения.
Химические свойства.
I. Реакции присоединения.
1. гидрирование
1 2 3
CH2=CH – CH3 + H – H à CH3 – CH2 – CH3
пропилен пропан
2. галогенирование
1 2 3
CH2=CH – CH3 + Br – Br à CH2 – CH – CH3
| |
Br Br
пропилен 1,2-дибромпропан
3. гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это -Hal, -OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва П-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода)
1 2 3
CH2=CH – CH3 + H – Br à CH3 – CH – CH3
|
Br
пропилен 2- бромпропан
4. гидратация (по правилу Марковникова) с образованием вторичных спиртов (кроме этилена – у него образуется первичный спирт)
1 2 3
CH2=CH – CH3 + H – OH à CH2 – CH – CH3
|
OH
пропилен пропанол-2 (вторичный пропанол)
5. сульфирование (по правилу Марковникова) с образованием алкилсерных кислот
1 2 3
CH2=CH – CH3 + H–O – SO2OH à CH3 – CH – CH3
|
O – SO2OH
пропилен пропил-2серная кислота
CH3 – CH – CH3 + H–OH à CH3 – CH – CH3 + HO – SO2 – OH
| |
O – SO2OH OH
пропил2серная кислота пропанол-2 серная кислота
6. алкилирование
CH3 CH3 CH3 CH3
| | | |
CH3 – CH + CH2=C – CH3 à CH3 – C – CH2 – CH – CH3
| |
CH3 CH3
метилпропан метилпропен 2,2,4-триметилпентан (изооктан)
7. взаимное алкилирование (обратный процесс крекинга алкенов), при разных температурах образуются разные соединения
![]()
CH2=CH – CH2 – CH3 бутилен-1
CH3 – CH=CH – CH3 бутилен-2
Kt, t0
CH2=CH2 + CH2=CH2 ––à CH2=C – CH3 метилпропилен
|
CH3
CH2=CH – CH=CH2 + H2 бутадиен-1,3
II. Реакции окисления.
1. горение
t0
C2H4 + 3 O2 (избыток) à 2 CO2 + 2 H2O
t0
C2H4 + 2 O2 (недостаток) à 2 CO + 2 H2O
t0
C2H4 + O2 (сильный недостаток) à 2 C + 2 H2O
2. частичное окисление кислородом воздуха с образованием эпоксидов (реакция Прилежаева)
t0, Ag
2 CH2=CH2 + O2 ––à2 CH2 – CH2
\ /
O
Этиленоксид (эпоксиэтан или окись этилена)
3. окисление кислородом окислителя в щелочной среде (реакция Вагнера)
из KMnO4
3 CH2=CH2 + [O] + H – OH ––––––––à HO – CH2 – CH2 – OH
этиленгликоль (этандиол-1,2)
KOH
3 C-2H2=C-2H2 + 2 KMn+7O4 + 4 H2O ––à 3 C-1H2 – C-1H2 + 2 Mn+4O2 + 2 KOH
| |
OH OH
![]()
![]()
![]() C2-2
-2ē → C2-1 3 3 C2-2
-6ē → 3 C2-1
C2-2
-2ē → C2-1 3 3 C2-2
-6ē → 3 C2-1
6
Mn+7 + 3ē → Mn+4 2 2 Mn+7 + 6ē → 2 Mn+4
Обесцвечивание щелочного раствора KMnO4 – это качественная реакция на непредельные углеводороды.
4. жесткое окисление кислородом более энергичного окислителя в кислой среде (кислый раствор KMnO4, HNO3, хромовая смесь) при нагревании
+H3O+, t°
СH3 – СH=CH – CH3 + 4 [O] ––à 2 CH3 – COOH
бутилен-2 этановая (уксусная) кислота
CH3 – CH2 – CH=CH2 + 4 [O] ––à CH3 – CH2 – COOH + HCOOH
бутилен-1 пропановая метановая (муравьиная)
кислота кислота
![]()
![]() HCOOH
+ [O] ––à HOCOOH (H2CO3)
HCOOH
+ [O] ––à HOCOOH (H2CO3)
метановая CO2↑ H2O
кислота угольная кислота
CH3 – CH2 – CH=CH – CH3 + 4 [O] ––à CH3 – CH2 – COOH + CH3 – COOH
пентен-2 пропановая кислота этановая кислота
5 CH3–CH2–C-1H=C-1H–CH3 + 8 KMn+7O4 + 12 H2SO4 à4 K2SO4 + 8 Mn+2 SO4 + 12 H2O +
пентен-2
+ 5 CH3–CH2–C+3OOH + 5 CH3–C+3OOH
пропановая кислота этановая кислота
![]()
![]()
![]() C2-1
-8ē → 2 C+3
5 5 C2-2 -40ē → 10 C-1
C2-1
-8ē → 2 C+3
5 5 C2-2 -40ē → 10 C-1
40
Mn+7 + 5ē → Mn+2 8 8 Mn+7 + 40ē → 8 Mn+4
CH3 – CH2 – CH2 – CH=CH2 + 5 [O] ––à CH3 – CH2 – CH2 – COOH + H2O + CO2
пентен-1 бутановая кислота
CH3 – CH2 – CH2 – C-1H=C-2H2 + 2 KMn+7O4 + 3 H2SO4 à K2SO4 + 2 Mn+2 SO4 + 4 H2O +
пентен-1
+ CH3 – CH2 – CH2 – C+3OOH + C+4O2
![]()
![]()
![]() бутановая кислота
бутановая кислота
![]() C-1
– 4ē → C+3
C-1
-4ē → C+3
C-1
– 4ē → C+3
C-1
-4ē → C+3
-10ē 1
C-2 – 6ē → C+4 C-2 -6ē → C+4
10
Mn+7 + 5ē → Mn+2 2 2 Mn+7 + 10ē → 2 Mn+2
III. Реакции полимеризации.
t0, kt, P
…+ CH2=CH2 + CH2=CH2 + …––––––à …-CH2 – CH2 – CH2 – CH2-…
этилен полиэтилен
t0, kt, P
nCH2=CH2 ––––––à (– CH2 – CH2 –)n
мономер структурное звено
где n – это степень полимеризации
t0, kt, P
n CH3 – CH=CH2 ––––––– à (– CH – CH2 –)n
|
CH3
пропилен полипропилен
IV. Реакции изомеризации.
550°C
CH2=CH2 – CH2 – CH3 ––––à CH3 – CH = CH – CH3 + CH3 – C = CH2
|
CH3
бутен-1 бутен-2 метилпропен
V. Реакции отщепления (элиминирования)
а) до алкадиенов:
MgO, ZnO
CH2=CH – CH2 – CH3 ––––à CH2 = CH – CH = CH2 + H2
бутен-1 бутадиен-1,3
б) до алкинов:
1200°C
2 CH2=CH2 ––––à 2 CH≡CH + 2 H2
этен (этилен) этин (ацетилен)
Получение.
1. Крекинг нефтепродуктов
C16H34 à C8H18 + C8H16
гексадекан октан октен
Обычно образуется смесь различных углеводородов: например, при крекинге бутана конечными продуктами будет – смесь бутенов, пропилена, этилена и метана; при крекинге пропана – смесь пропилена, этилена и метана; при крекинге метилпропана – смесь метилпропилена, пропилена и метана.
2. Дегидрирование предельных углеводородов
![]() CH2 = CH – CH2 – CH3 бутен-1
CH2 = CH – CH2 – CH3 бутен-1
CH3 – CH2 – CH2 – CH3 à
бутан CH3 – CH = CH – CH3 бутен-2
550-650oc, Kt
2CH4 –––––––––––à C2H4 + 2H2
3. Внутримолекулярная дегидратация спиртов
H2SO4, 140-150oC
CH3 – CH2 – OH ––––––––––––––––à CH2 = CH2 + H2O
этанол этилен
4. Дегидрогалогенирование галогенпроизводных алканов (по правилу Зайцева: при отщеплении галогенводорода от вторичных и третичных галогеналканов атом водорода отщепляется о наименее гидрированного атома углерода)
Br
| спирт, to
CH3 – CH – CH2 – CH3 + NaOH –––––––à CH3 – CH = CH – CH3 + NaBr + H2O
2-бромбутан бутен-2
5. Дегалогенирование дигалогенпроизводных алканов
Br Br
| |
CH3 – CH – CH – CH3 + Zn à CH3 – CH = CH – CH3 + ZnBr2
2.3-дибромбутан бутен-2
Алкадиены.
Строение. Изомерия и номенклатура
Алкадиены — непредельные углеводороды, содержащие две двойные связи. Общая формула алкадиенов СnН2n-2.
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются изолированными. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Если двойные связи разделены в цепи только одной s-связью, то их называют сопряженными. Важнейшие представители сопряженных диенов:
СН2 = СН-СН = СН2 СН2 = С(СН3)-СН = СН2.
бутадиен-1,3 изопрен
Существуют также диены с системой С = С = С, называемые аленами: такие двойные связи называют кумулированными. Первый член гомологического ряда — аллен СН2 = С = СН2 : бесцветный газ с tnл = -136,2 °С и tкип = -34,5 °С.
Далее рассмотрим только сопряженные диены, имеющие большое практическое значение.
В сопряженных диенах p-электронные облака двойных связей перекрываются между собой и образуют единое p-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
![]()
Пунктирные линии показывают область делокализации электронов и обозначают промежуточный порядок связи между С-С и С = С. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация p-электронов и тем устойчивее молекула.
Для алкадиенов характерны те же виды изомерии, что и для алкенов:
1) изомерия углеродного скелета.
2) изомерия положения двойных связей
3) цис-транс-изомерия.
Номенклатура.
Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание -ан заменяется на -диен.
Физические свойства. Бутадиен-1,3 — легко сжижающийся газ с неприятным запахом. Изопрен — жидкость с tкип 34 °С.
Получение. Основной промышленный способ получения диенов — дегидрирование алканов. Бутадиен-1,3 (дивинил) получают из бутана:
|
|
t,Сr2О3 |
|
|
СН3-СН2-СН2-СН3 |
→ |
СН2=СН-СН=СН2 + 2Н2, |
а изопрен (2-метилбутадиен-1,3) — из 2-метилбутана:
|
|
t, Сr2О3 |
|
|
СН3-СН(СН3)-СН2-СН3 |
→ |
СН2=С(СН3)-СН=СН2+2Н2. |
Бутадиен-1,3 можно также получать по реакции Лебедева путем одновременного дегидрирования и дегидратации этанола:
|
|
t, ZnO, Al2O3 |
|
|
2С2Н5ОН |
→ |
СН2=СН-СН=СН2 + Н2 + 2Н2О. |
Химические свойства.
Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях: а) к одной из двойных связей (1,2-присоединение) или б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение). Так, присоединение брома к бутадиену может привести к двум продуктам:
|
|
1,2 |
|
|
СН2=СН-СН=СН2 + Вr2 |
→ |
СН2=СН-СНВr-СН2Вr |
или
|
|
1,4 |
|
|
СН2=СН-СН=СН2 + Вr2 |
→ |
ВrСН2-СН=СН-СН2Вr |
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений. Важнейшее свойство диенов — их способность к полимеризации, которая используется для получения синтетических каучуков. При полимеризации бутадиена-1,3, которая протекает как 1,4-присоединение, получают бутадиеновый каучук:
nСН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n.
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором все звенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
nСН2=С(СН3)-СН=СН2 → (-СН2-С(СН3)=СН-СН2-)n.
Применение. Основная область применения алкадиенов - синтез каучуков.
Алкины
Алкины – углеводороды ациклического ряда, содержащие в своей структуре два атома углерода, связанные между собой тремя связями, а оставшиеся валентности этих атомов могут быть затрачены на образование связей с другими атомами углерода или атомами водорода.
Алкины образуют гомологический ряд соединений, выраженных общей формулой СnH2n-2. Первый член гомологического ряда – этин или ацетилен.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры
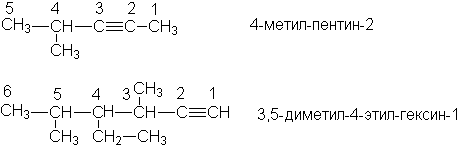
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HCº C- этинил
СН3-Сº С- пропинил-1
НСº С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
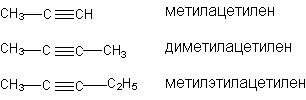
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
Методы синтеза алкинов
1. Реакции пиролиза метана или этана
2CH4 → C2H2 +
3H2
CH3 - CH3![]() C2H2 + 2H2
C2H2 + 2H2
При
пиролизе метана необходимо строго выдерживать время реакции. Для этого
используется “закалка” - быстрый ввод на выходе реакционной зоны воды.
2. Карбидный метод
CaC2 + 2H2O ® C2H2 + Ca(OH)2
Аналогично реагируют карбиды стронция и бария SrC2, BaC2.
Карбид магния с водой образует пропин
Mg2C3 +4 H2O ® CH3C º CH + 2Mg(OH)2
3. Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов.
CH3-CHBr-CH2Br + 2NaOH ![]() CH3-Cº CH + 2NaBr + 2H2O
CH3-Cº CH + 2NaBr + 2H2O
CH3-BrC=CH2 + NaOH ![]() CH3-Cº CH + NaBr + H2O
CH3-Cº CH + NaBr + H2O
4. Алкилирование алкинов.
Реакции проводятся через синтез ацетиленидов
а) R-Cº CH + NaNH2® R-Cº C-Na+ + NH3
R-Cº CNa + R'Hal ® RCº CR' + NaHal
б) R-Cº C-H +CH3-MgHal ® R-Cº C-MgHal + CH4
R-Cº C-MgHal + R’Hal ® R-Cº C-R’ + MgHal2
Физические свойства
алкинов и природа связей
Алкины представляют собой бесцветные газы или жидкости. Начиная с С17 , алкины являются кристаллическими веществами.
Тройная связь представляет собой одну s -связь С-С и две p -связи. При переходе от двойной к тройной связи средняя энергия p -связи снижается. Это означает, что тройная связь менее стабильна, чем двойная. Сам ацетилен неустойчивое соединение и способен к спонтанному взрывному распаду на элементы. Молекула ацетилена имеет линейное строение, что обусловлено sp-состоянием атомов углерода. Тройная связь в алкинах характеризуется более высокой поляризуемостью, чем в алкенах RCº C = 5,96; RC=C=4,17.
По сравнению с алкенами алкины характеризуются большими значениями потенциалов ионизации. Это означает, что электрон на ВЗМО у ацетилена связан прочнее чем у этилена. Это обусловливает более высокую электрофильность алкенов по сравнению с алкинами. Потенциал ионизации алкинов резко снижается при введении в них алкильных групп.
В электронных спектрах поглощения алкины имеют полосу поглощения при 170-180 нм, что соответствует p - p * - переходу. В ИК спектрах характерны валентные колебания связи Сº С при 2100-2260 см-1 и связи º С-Н при 3270-3330 см-1.
В спектрах ПМР химический сдвиг атома водорода º С-Н равен 1,7-2 м.д.
Химические свойства алкинов.
Высокая степень ненасыщенности алкинов обусловливает их склонность к реакциям присоединения. В реакциях электрофильного присоединения алкины менее реакционноспособны по сравнению с алкенами, несмотря на то что энергия p -связей у последних выше. Это обусловлено более высокой электрофильностью алкенов. В то же время в реакциях, имеющих гомолитический характер, например, каталитическое гидрирование, большую реакционную способность обнаруживают алкены.
1. Реакция гидрирования.
Реакция имеет ступенчатый характер:
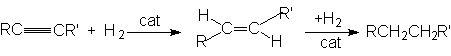
Сat: металлические Ni, Pl, Pd.
На первой стадии количественно образуется алкен, и после практического исчерпывания алкина начинается гидрирование алкена. Это связано с более высоким сродством алкинов к поверхности катализатора. Обычно реакция протекает нестереоселективно и образуется смесь цис- и транс-продуктов присоединения.
Модификация катализаторов приводит к стереоселективному синтезу. Так, промотируя палладий оксидом свинца (II) и CaCO3, получают катализатор Линдлара, на котором осуществляется стереоспецифичный синтез цис-изомера.
|
RCºCR' + 2H2 |
® |
RCH=CHR' |
|
|
|
цис-алкен |
К аналогичным результатам приводит катализатор Pd/BaSO4 в пиридине.
Стереоселективное восстановление тройной связи можно осуществлять, используя для этого соответствующие агенты. К этим реакциям относятся:
а) восстановление натрием или литием в жидком аммиаке или этиламине. При этом преимущественно образуется транс-изомер:
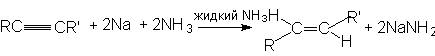
б) Гидроборирование. Алкины, подобно алкена, реагируют с гидридами бора, присоединяя их по тройной связи углерод-углерод
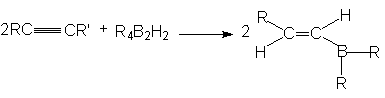
Первоначально образуется моноалкенильное производное бора, причем присоединение идет против правила Марковникова. Дальнейшее присоединение может происходить по двойной связи моноалкенильных производных бора. Однако если R2BH ( или RBH2) содержит объемные группы, то пространственные препятствия затрудняют вторую реакцию присоединения и достигается высокий выход моноалкенильного производного.
Реакции такого типа особенно важны для синтезов, поскольку моноалкенильные производные бора могут быть окислены щелочным раствором Н2О2 в альдегиды (если в исходном алкине тройная связь находиться на конце цепи) или в кетоны ( если тройная связь неконцевая)
2C4H9CºCH + R4B2H2 ® 2C4H9CH=CHB(R)2![]() 2C4H9CH=CH-OH ®
2C4H9CH=CH-OH ®
® 2C4H9CH2CHO
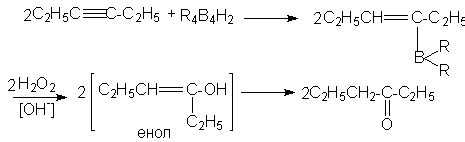
Моноалкенильные производные бора легко реагируют с уксусной кислотой в мягких условиях, образуя алкены. Весь этот процесс полностью стереоспецифичен, поскольку дизамещенные алкины дают только цис-алкены. Очевидно, что гидрид бора присоединяется к тройной связи цис-способом и образующийся моноалкенил бора реагирует далее с кислотой, образуя цис-алкен.
Реакции электрофильного присоединения.
1. Присоединение галогенов (Cl2 и Br2)
Алкины, подобно алкенам, участвуют в реакциях присоединительного галогенирования. Отличие состоит лишь в том, что алкин можен присоединить две молекулы галогена, а алкен – только одну:
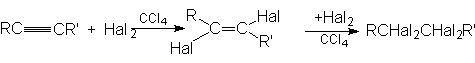
Промежуточный дигалогенид может быть получен присоединением одной молекулы галогена к алкину при низких температурах, причем реакция протекает преимущественно как транс-присоединение.
Реакции присоединения галогенов к алкинам как и другие реакции электрофильного присоединения, происходят медленнее, чем реакции присоединения к алкенам.
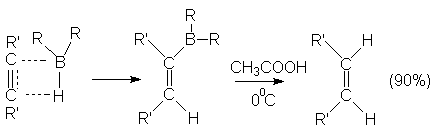
HCº C-CH2-CH=CH2![]() HCº C-CH2-CHBr-CH2Br (90%)
HCº C-CH2-CHBr-CH2Br (90%)
Такое соотношение реакционных способностей связано с различием устойчивости карбкатионов, образующихся при присоединении электрофильного реагента к кратным связям
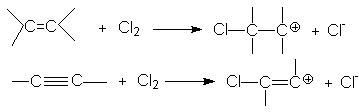
Можно видеть, что винил-катион менее устойчив по сравнению с алкил-катионом, поэтому образование последнего характеризуется более низким энергетическим барьером. В целом механизм галогенирования алкина (на примере бромирования) может быть представлен следующими стадиями:
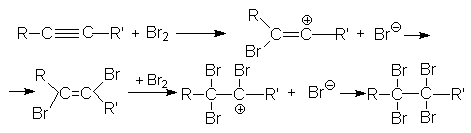
2. Присоединение галогеноводородов к алкинам.
Присоединение хлоро- и бромоводорода к алкинам протекает также, как и к алкенам. Реакция имеет ступенчатый характер.
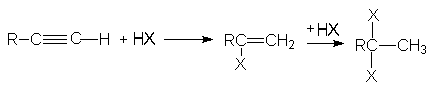
Обе реакции идут по правилу Марковникова. Показано, что присоединение галогеноводородов к алкинам идет как транс-присоединение. Поскольку реакционная способность тройной связи меньше чем у алкенов, используют катализ: например HgCl2.
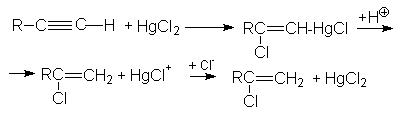
3. Реакция гидратации (Реакция Кучерова)
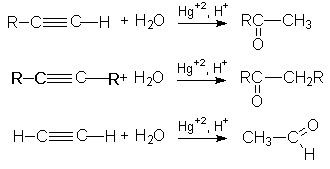
Механизм этой реакции можно представить последовательностью стадий:
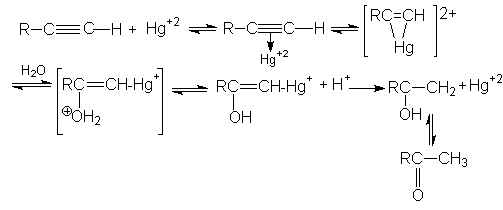
При синтезе ацетальдегида протекают побочные реакции:
а) альдольная конденсация
CH3CHO+CH3CHO ![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO ![]() CH3CH=CH-CHO
CH3CH=CH-CHO ![]() альдегидные
смолы
альдегидные
смолы
б) окисление
СH3CHO + 2Hg2+![]() 2Hg+ + CH3COOH + 2H+
2Hg+ + CH3COOH + 2H+
CH3CHO + Hg+![]() Hg + CH3COOH + 2H+
Hg + CH3COOH + 2H+
Подавление приведенных побочных реакций можно обеспечить путем увеличения скорости подачи ацетилена в реакционную зону. Благодаря этому образующийся альдегид отдувается из реакционной массы и степень его вовлечения в побочные реакции резко снижается.
4. Присоединение HCN.
![]()
5. Присоединение спиртов.
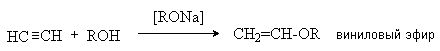
Кислотные свойства ацетилена и алкинов
с терминальной тройной связью.
Соединения этого типа являются С-Н – кислотами. Атом водорода, находящийся при углероде тройной связи обладает большей кислотностью, чем атом водорода алкенов и алканов. Объясняется это тем, что атомы Сº обладают большим s-характером и поэтому сильнее притягивают электроны, поэтому С-Н связи поляризованы и электроположительные атомы водорода в них проявляют большую кислотность. Кислотность ацетилена и a -алкинов проявляется в следующих реакциях:
RCº CH + K+NH2-![]()
![]() RCº C-K+ + NH3
RCº C-K+ + NH3
Амид-анион обладает высокой основностью, что обусловливает сдвиг равновесия в сторону образования ацетиленида. В то же время, вода, обладая более высокой кислотностью по сравнению с ацетиленом, вытесняет последний из ацетиленидов:
RCº CК + H2O ® RCº CH + КOH
Натриевые, калиевые и другие ацетилениды щелочных металлов являются истинными солями, состоящие из катиона металла и ацетиленид-анионов. Соли ацетиленов с тяжелыми металлами (Ag, Cu, Hg) – не в полном смысле соли. Это ковалентно-построенные соединения, нерастворимые в воде. Они осаждаются из водного раствора.
Осаждением ацетиленида серебра определяют наличие тройной связи или отделяют терминальные ацетилены от дизамещенных:
RCº CH + [Ag(NH3)2]NO3® RCº CAg + NH4NO3 + NH3
RCº CR' + [Ag(NH3)2]NO3 ® реакция не идет
Монозамещенные ацетилены тяжелых металлов легко регенерируют из осадка под действием сильных минеральных кислот.
RCº CAg + HNO3 ® RCº CH + AgNO3
Аналогичное использование находят ацетилениды меди
RCºCH + [Cu(NH3)2]Cl ® RCºC-Cu¯ + NH4Cl + NH3
RCºC-Cu + HCl ® RCºCH + CuCl
Ацетилениды магния (реактив ) имеют важное синтетическое значение. Их получают действием терминального алкина на магний органические соединения с предельными радикалами:
RCºCH + CH3MgI ® CH4 + RCºC-MgI
Благодаря этому реактиву можно получать спирты и карбоновые кислоты, содержащую тройную связь:
а) RCºC-MgI + CH2=O ® RCºC-CH2-OMgI ![]() RCºC-CH2OH + Mg(OH)I
RCºC-CH2OH + Mg(OH)I
первичный спирт
б)
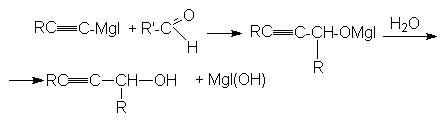
вторичный спирт
в)
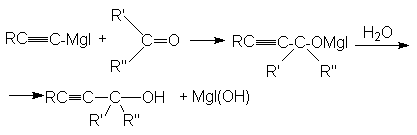
третичный спирт
г)
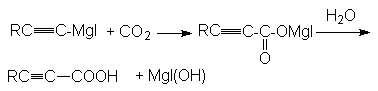
карбоновая кислота
Подобные синтезы можно осуществлять путем конденсации ацетилена или терминальных алкинов с альдегидами и кетонами (Фаворский)
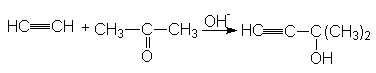
Механизм:
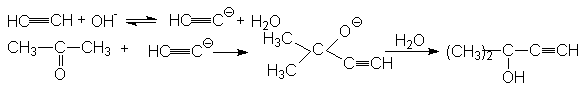
+ OH-
Конденсация ацетилена с альдегидами в присутствии щелочей не дает желаемого результата из-за побочной реакции альдольной конденсации. В.Реппе осуществил ее разработав новый катализатор на основе ацетиленида меди, стабилизированного соединениями висмута:
СHº CH + CH2O ® CHº CH-CH2OH ![]() HO-CH2-Cº C-CH2-OH
HO-CH2-Cº C-CH2-OH
(бутиндиол-1,4)
Изомеризация алкинов
Алкины способны к изомеризации с перемещением кратной связи или с превращением в диеновые углеводороды.
Под действие щелочных металлов тройная связь переходит на конец молекулы полученного ацетиленида. Действие спиртовых щелочей способствует переходу тройной связи с конца молекулы в центр. Промежуточными продуктами в этих превращениях являются алленовые углеводороды (Фаворский)
CH3CH2CºCH ![]() CH3CºCCH3
CH3CºCCH3
Окисление
RCº CR' + KMnO4 ![]() RCOOH
+ R'COOH
RCOOH
+ R'COOH
RCºCH ![]() RCOOH + CO2
RCOOH + CO2
RCºCR' ![]() RCOOH + R'COOH
RCOOH + R'COOH
Окислительная конденсация терминальных алкинов.
2RCºCH ![]() RCºC-CºCR
RCºC-CºCR
Полимеризация
1) Реакция Зелинского:
2) Димеризация:
2HCºCH![]() HCºC-CH=CH2
HCºC-CH=CH2![]() H2C=CH-CºC-CH=CH2
H2C=CH-CºC-CH=CH2
винилацетилен дивинилацетилен
Карбонилирование (Реппе)
CHºCH + CO + H2O ® CH2=CH-COOH акриловая кислота
CHºCH + CO + ROH ® CH2=CH-COOR эфир акриловой кислоты
CHºCH + CO + NH3® CH2=CH-CONH2 амид акриловой кислоты
Катализаторами этих реакций являются карбонилы никеля и кобальта.
Арены.
Общая формула – СnН2n-6 Представитель – С6Н6 (бензол)
История открытия бензола
У бензола интересная история. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменноугольной смолы. Но названия вещество не получило, и состав его был неизвестен.
1825 г – Майкл Фарадей установил, что вещество состоит только из водорода и углерода, назвал его «карбюрированным водородом»
1833 г – Эйльгард Мичерлих определил эмпирическую формулу С6 Н6 нагрел негашеную известь CaO с бензойной кислотой C6H5COOH (она содержится во многих ягодах, в частности, в клюкве и бруснике, и препятствует их гниению) и получил неизвестную, легкокипящую жидкость с резким запахом. Вот тогда и вспомнили об открытии Фарадея. Он назвал его "бензином".
Наиболее полно свойства бензола описал немецкий химик Фридрих Август Кекуле. Он же предложил циклическую формулу бензола в 1865 г.
Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углеродного цикла.
Плоскость в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом. Связь в бензольном ядре часто называют ароматической. Отсюда название.
Попробуем сформулировать определение ароматических углеводородов или аренов.
Ароматические углеводороды, или арены — это углеводороды, в молекулах которых имеется одно или несколько бензольных колец.
После открытия бензола дискуссия о его строении велась в науке очень долго.
Выводы:
У бензола циклическая форма молекулы.
В молекуле бензола существуют кратные связи. Чтобы показать равномерность распределения п-электронной системы в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри
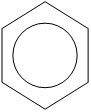
Сочетание шести сигма-связей с единой п-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядро.
По современным представлениям в молекуле бензола формируется особый тип связей – ароматический. Давайте рассмотрим, как такая связь образуется.
1) Атомы углерода находятся в состоянии sр2-гибридизации.
2) Между атомами углерода и углерода и водорода образуются сигма-связи, лежащие в одной плоскости (работа с рисунком)
3) Валентный угол – 120º
4) Длина связи С-С 0,140нм
5) За счет негибридных р-электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма-связей образуется единая п-электронная система, состоящая из 6р-электронов и общая для всех атомов углерода (работа с рисунками)
Исходя из этого, вытекает современная структурная формула бензола.
Получение бензола
Основные пром. способы получения ароматических УВ:
1. сухая перегонка каменного угля (коксование);
2. нефтепереработка (путем перегонки) пиролиза (каталит. крекинга).
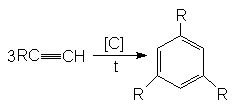
Синтетические способы получения:
1. Дегидрирование циклогексана:
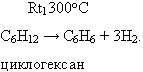
2. Тримеризация ацетилена. /Зелинский в лаб. усл./
![]()
3. Ароматизация (дегидроциклизация) алканов:
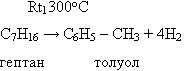
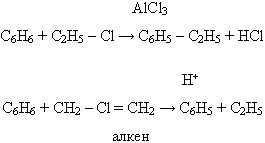
4. Алкирование: (бензол + алкен в присут. кислоты) или хлорида не с галоген. производным
Физические свойства
Легкокипящая бесцветная жидкость, имеет специфический запах, не растворяется в воде, растворяется в органических растворителях, сам является растворителем.
При охлаждении легко застывает и превращается в белую кристаллическую массу с температурой плавления 5.5 °С.
Токсичен, опасен для окружающей среды, огнеопасен.
Химические свойства бензола:
а) ароматическая система, состоящая из 6 σ и единой 6р π связи обладает устойчивостью. Для аренов наиболее характерны реакции замещения, которые протекают легче ,чем у предельных углеводородов и заканчиваются, как правило, замещением одного атома водорода. Замещение (галогенирование, нитрование, сульфирование, алкилирование) каталитическое и носит электрофильный характер.
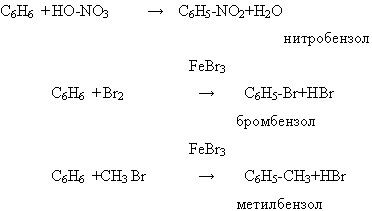
б) для бензола менее характерны реакции присоединения (хлорирования и гидрирования). Они проходят труднее ,чем у непредельных углеводородов.
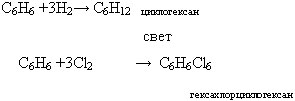
в) Бензол не обесцвечивает бромную воду (Вr2) и раствор перманганата калия (КМnO4) так как в молекулах аренов нет двойных связей.
г) Арены горят коптящим пламенем, так как массовая доля углерода высокая и составляет 92,3%.
Учащиеся делают вывод, что по химическим свойствам бензол занимает как бы промежуточное положение между предельными и непредельными углеводородами, т.к. вступают в реакции замещения и присоединения. Но реакции замещения у бензола идут легче, чем у предельных, а реакции присоединения – труднее, чем у непредельных углеводородов.
Гомологи бензола. Правила ориентации в бензольном кольце
|
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется черезиндуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действиемезомерного эффекта. Влияние заместителей, передающееся по сопряженной системе π -связей, называется мезомерным (М) эффектом. В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные. 1. Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электроннаяплотность сосредоточивается в орто- и пара-положениях:
Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности. 2. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца. Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации. I. Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называютсязаместителями (ориентантами) первого рода:
II. Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- иорто-положения:
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его. |
Спирты
Простейшими кислородосодержащими органическими веществами являются спирты. Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.
Спирты – производные углеводородов, содержащих одну или несколько гидроксильных групп.
Классификация спиртов.
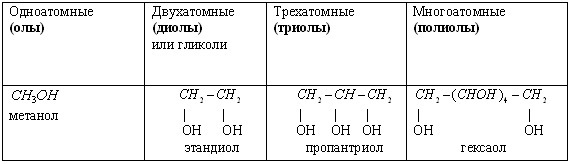
1) По числу гидроксильных групп (ОН) спирты бывают одноатомные и многоатомные (двухатомные, трехатомные).
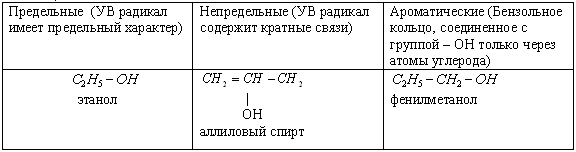
2) По характеру углеводородного радикала спирты бывают предельные, непредельные, ароматические.
3) По характеру атома углерода, с которым связана гидроксильная группа, спирты бываю первичные, вторичные, третичные.
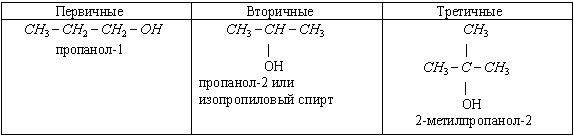
Обратите внимание на то, что четвертичных спиртов не существует, т.к. четвертичный атом С связан с 4 другими атомами С, поэтому на связь с гидроксильной группой нет больше валентностей.
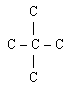
Изомерия спиртов.
Для предельных одноатомных спиртов характерны следующие виды изомерии:
- углеродного скелета
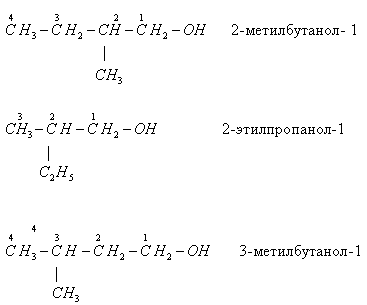
- положения функциональной группы
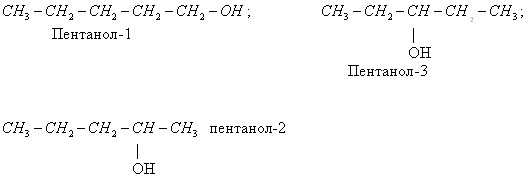
- межклассовая изомерия
(СН3 – СН2 – ОН этиловый спирт и СН3 – О – СН3 диметиловый эфир)
Номенклатура спиртов.
К названию углеводорода добавляют количество гидроксогрупп (префикс), затем – суффикс ОЛ, затем указываются номера атомов углерода, с которыми соединены функциональные группы. Например:
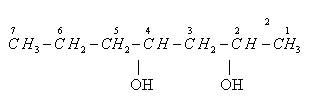
Порядок построения названия:
1.
Углеродная цепь нумеруется с конца
к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий УВ гептан.
3. Число групп – ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название данного спирта - гептандиол-2,4
Предельные одноатомные спирты.
Предельные одноатомные спирты (алканолы) содержат одну гидроксильную группу –ОН, соединённую с насыщенным углеводородным радикалом. Общая формула алканолов: С n H 2 n +1OH или R – OH, где R- углеводородный радикал.
Гомологический ряд алканолов: CH3OH метанол, метиловый спирт
C2H5OH этанол, этиловый спирт
C3H7OH пропанол
C4H9OH бутанол
C5H11OH пентанол
Изомерия C4H9OH
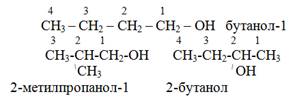
Физические свойства
Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют спиртовой запах. Метанол – сильный яд. Все спирты ядовиты, обладают наркотическим действием.
Химические свойства
1. Растворы спиртов имеют нейтральную реакцию на индикаторы
2. Взаимодействие с щелочными металлами
2C2H5OH + 2Na → 2C2H5ONa + H2 ↑
этанол этилат натрия
3. Взаимодействие с галогеноводородами
C2H5OH + HCl → C2H5Cl + H2O
хлорэтан
4. Дегидратация (при t и в присутствии H2SO4)
C2H5OH → C2H4 + H2O
этилен
2 C2H5OH→ C2H5 –О— C2H5
диэтиловый эфир
5. Горение
C2H5OH + 3O2 → 2CO2 + 3H2O +Q
6. Окисление
C2H5OH + CuO → Cu + H2O + CH3-CHO
этанол уксусный альдегид
7. Взаимодействие с карбоновыми кислотами (реакция этерификации)
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
Получение этанола:
Этанол получают из
1) этилена: C2H4 + HOH → C2H5OH (при катализаторе и t)
2) брожением глюкозы: C6H12O6 → 2C2H5OH + 2CO2
Многоатомные спирты. Фенолы. Простые эфиры
Многоатомные спирты - органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом. Общая формула многоатомных спиртов: R(OH)n, где n > 2.
Различают 2-х атомный спирт – этиленгликоль, 3-х атомный спирт – глицерин, 5-ти атомный – ксилит, 6-ти атомный сорбит .
Они не являются гомологами, а каждый из них начинает свой гомологический ряд.
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

Получение многоатомных спиртов
I. Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
![]()
2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:
![]()
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В лаборатории
1. Окисление алкенов:
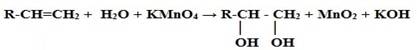
II. Получение трёхатомных спиртов (глицерина)
В промышленности
Омыление жиров (триглицеридов):
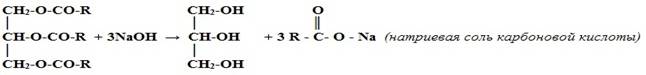
Физические свойства.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.
Химические свойства.
Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Кислотные свойства
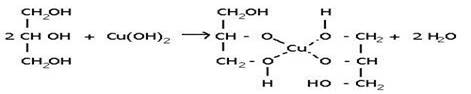
1. С активными металлами:
HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия)
2. С гидроксидом меди(II) – качественная реакция!
Упрощённая схема
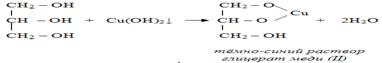
Основные свойства
1. С галогенводородными кислотами
HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH2-CH2-Cl + 2H2O
2. С азотной кислотой
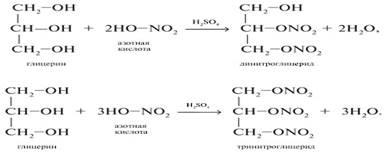
Тринитроглицерин - основа динамита
Применение
Этиленгликоль производства лавсана, пластмасс, и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
Фенолы
Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильные группы непосредственно связаны с бензольным кольцом.
2. Классификация фенолов
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
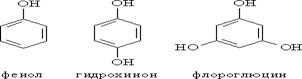
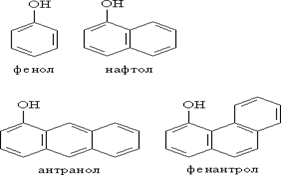
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:
3. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
изомерия положения заместителей в бензольном кольце
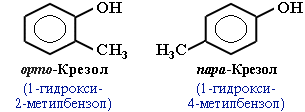
изомерия боковой цепи (строения алкильного радикала и числа радикалов)
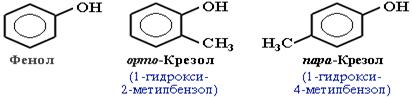
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей
Простейшим представителем этого класса является фенол – С6Н5ОН.
При построении номенклатуры фенолов принято обозначать атомы углерода в бензольном кольце цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группы.
Физические свойства: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
Химические свойства
1. Кислотные свойства. (свойства -ОН группы). Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
|
2C6H5OH + 2Na |
2C6H5ONa |
+ H2 |
|
фенолят натрия |
C6H5OH + NaOH ![]() C6H5ONa
+ H2O
C6H5ONa
+ H2O
Кислотные свойства фенола выражены очень слабо , поэтому даже угольная кислота вытесняет фенол из растворов его солей:
C6H5ONa + H2O + CO2 = C6H5OH + NaHCO3
2.
Замещение
в бензольном кольце.
(свойства бензольного кольца). Наличие гидроксильной группы в качестве
заместителя в молекуле бензола приводит к перераспределению электронной
плотности в сопряженной ![]() -системе бензольного кольца, при этом
увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто-
и пара-положения) и уменьшается у 3-го и 5-го атомов углерода
(мета-положение).
-системе бензольного кольца, при этом
увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто-
и пара-положения) и уменьшается у 3-го и 5-го атомов углерода
(мета-положение).
а) Реакция с бромной водой (качественная реакция):
|
|
+ 3Br2 |
|
+ 3HBr |
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
|
|
+ 3HNO3(конц.) |
|
2,4,6-тринитрофенол (пикриновая кислота)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
FeCl3 - светло-жёлтый раствор
[Fe(C6H5-OH)3](C6H5O)3 - фиолетовый раствор
Получение.
1. выделяют из каменноугольной смолы.
2. Синтетическим способом.
а) Щеолчной гидролиз хлорбензола
t, p
C6H5CI + NaOH = C6H5OH + NaCI
б). Сплавлением солей ароматических сульфокислот с твёрдыми щелочами:
C6H5-SO3Na + NaOH t → Na2SO3 + С6H5 – OH
натриевая соль
бензолсульфокислоты
Применение.
1. Для производства фенолформальдегидных пластмасс;
2. красителей;
3. лекарственных препаратов;
4. взрывчатых веществ.
5. Раствор с массовой долей фенола 3-5% применяют как антисептик в медицине для дезинфекции помещений, хирургических инструментов.
Фенол и его производные ядовитые вещества, опасные для человека, животных и растений. Даже очень малое количество фенола, попавшее в водоем, приводит к изменению вкуса употребляемой в пищу рыбы. На производствах, связанных с получением и переработкой фенола, применяют оборудование, препятствующее проникновению вредных веществ в окружающую среду.
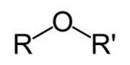
Простыми эфирами называются продукты замещения атома водорода в гидроксиле спирта на углеводородный радикал. Общая формула R- О – R1 где R и R1 — радикалы.
Называют простые эфиры по радикалам, входящим в их состав. По международной номенклатуре простые эфиры обозначают как производные углеводородов, в которых атом водорода замещен алкоксигруппой (RО -). Например:
СН3 – О – СН3 диметиловый эфир
Способы получения простых эфиров.
1. Из спиртов в присутствии водоотнимающих средств (например, Н2SО4) при 140 оС
С2Н5ОН + ННSО4 → С2Н5SО4Н + Н2О
С2Н5SО4Н + НОС2Н5 → С2Н5 – О – С2Н5 + Н2SО4
2. Реакцией алкоголятов с галоидными алкилами
СН3ОК + СIС2Н5 → СН3 – О – С2Н5 + КСI
Химические свойства простых эфиров.
В отличие от спиртов и сложных эфиров, простые эфиры являются химически стойкими веществами. На них не действует едкие щелочи и большинство кислот за исключением концентрированной серной и йодистоводородной кислот.
1. Реакция с конц. серной кислотой
С2 Н5 – О – С2Н5 + Н2SО4 → С2Н5ОSО3Н + С2Н5ОН
2. Реакция с йодистоводородистой кислотой
С2Н5 – О – С2Н5 + НI → С2Н5ОН + С2Н5I
3. Окисление с образованием пероксидных и гидропероксидных соединений
[O]
С2Н5 – О – С2Н5 → С2Н5 – О – О – С2Н5 + С2Н5 – О – О — Н
4. Расщепление металлическим натрием при нагревании (реакция Шорыгина П.П.):
С2Н5 – О – С2Н5 + 2Nа → С2Н5 – ОNа + С2Н5Nа
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители. К важнейшим простым эфирам относятся и гетероциклические кислородсодержащие соединения – этиленоксид (эпоксид) и диоксан.
Альдегиды и кетоны
Альдегиды и кетоны относятся к карбонильным органическим соединениям.
Карбонильными соединениями называют
органические вещества, в молекулах которых имеется группа >С=О (карбонил или
оксогруппа).
Общая формула карбонильных соединений:
|
|
В зависимости от типа заместителя Х эти соединения
подразделяют на: альдегиды ( Х = Н ); кетоны ( Х = R, R' ); карбоновые кислоты
( Х = ОН ) и их производные ( Х =
ОR, NH2, NHR, Hal и т.д.).
Альдегиды - органические соединения, в молекулах которых атом углерода
карбонильной группы (карбонильный углерод) связан с атомом водорода. Общая формула: R–CН=O или
|
|
R = H, алкил, арил |
Функциональная группа –СН=О называется альдегидной.
Кетоны - органические вещества, молекулы которых содержат
карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R2C=O, R–CO–R' или
|
|
R, R' = алкил, арил |
|
|
|
Модели простейших карбонильных соединений |
||
|
Название |
Формула |
Модель |
|
Формальдегид |
H2C=O |
|
|
Ацетальдегид |
СH3-CH=O |
|
|
Ацетон |
(СH3)2C=O |
|
Номенклатура альдегидов и кетонов.
Систематические названия альдегидов строят по названию соответствующего
углеводорода и добавлением суффикса -аль.
Нумерацию цепи начинают с карбонильного атома углерода.
Тривиальные названия производят от тривиальных названий тех кислот, в которые
альдегиды превращаются при окислении.
|
Формула |
Название |
|
|
систематическое |
тривиальное |
|
|
H2C=O |
метаналь |
муравьиный альдегид (формальдегид) |
|
CH3CH=O |
этаналь |
уксусный альдегид (ацетальдегид) |
|
(CH3)2CHCH=O |
2-метил-пропаналь |
изомасляный альдегид |
|
CH3CH=CHCH=O |
бутен-2-аль |
кротоновый альдегид |
Систематические названия кетонов несложного строения производят от названий радикалов (в порядке увеличения) с добавлением слова кетон.
Например:
CH3–CO–CH3 -диметилкетон (ацетон);
CH3CH2CH2–CO–CH3 -метилпропилкетон.
В более общем случае название кетона строится по названию соответствующего
углеводорода и суффикса -он;
нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе
(заместительная номенклатура ИЮПАК). Примеры:
CH3–CO–CH3 -пропанон (ацетон);
CH3CH2CH2–CO–CH3 -пентанон-2;
CH2=CH–CH2–CO–CH3 - пентен-4-он-2.
Изомерия альдегидов и кетонов.
Для альдегидов и кетонов характерна структурная изомерия.
Изомерия альдегидов:
|
изомерия углеродного скелета, начиная с С4 |
|
|
межклассовая изомерия с кетонами, начиная с С3 |
|
|
циклическими оксидами (с С2) |
|
|
непредельными спиртами и простыми эфирами (с С3) |
|
|
Изомерия кетонов: углеродного скелета (c C5) |
|
|
положения карбонильной группы (c C5) |
|
межклассовая изомерия (аналогично альдегидам).
Строение карбонильной группы C=O.
Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
|
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 -связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в -связи С–О, две другие содержат неподеленнные электронные пары. -Связь образована р-электронами атомов углерода и кислорода. |
|
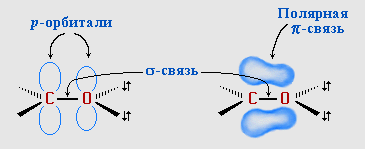
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
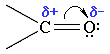
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Химические свойства добавить??
Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот
называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую
группу -СООН, и добавляя к названию соответствующего углеводорода окончание
"овая" и слово "кислота". При этом атому
углерода, входящему в состав карбоксильной группы, присваивается первый номер.
Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН
- 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию
углеводорода добавляют окончание "карбоновая" и слово "кислота",
не включая при этом в нумерацию цепи атом углерода карбоксильной группы.
Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН
- трет-бутилкарбоновая
кислота.
Многие из карбоновых кислот имеют тривиальные
названия (некоторые из них приведены в таблице).
|
Тривиальное название |
Название по ИЮПАК |
Формула |
Название солей |
|
Муравьиная кислота |
Метановая кислота |
HCOOH |
формиаты |
|
Уксусная кислота |
Этановая кислота |
CH3COOH |
ацетаты |
|
Пропионовая кислота |
Пропановая кислота |
C2H5COOH |
пропионаты |
|
Масляная кислота |
Бутановая кислота |
C3H7COOH |
бутираты |
|
Валериановая кислота |
Пентановая кислота |
C4H9COOH |
валераты |
|
Капроновая кислота |
Гексановая кислота |
C5H11COOH |
капраты |
|
Энантовая кислота |
Гептановая кислота |
C6H13COOH |
энантоаты |
|
Каприловая кислота |
Октановая кислота |
C7H15COOH |
каприлаты |
|
Пеларгоновая кислота |
Нонановая кислота |
C8H17COOH |
пеларогоаты |
|
Каприновая кислота |
Декановая кислота |
C9H19COOH |
капринаты |
|
Ундециловая кислота |
Ундекановая кислота |
C10H21COOH |
ундеканоаты |
|
Лауриновая кислота |
Додекановая кислота |
C11H23COOH |
лаураты |
|
- |
Тридекановая кислота |
C12H25COOH |
тридеканоаты |
|
Пальмитиновая кислота |
Гексадекановая кислота |
C15H31COOH |
пальмитаты |
|
Маргариновая кислота |
Гептадекановая кислота |
C16H33COOH |
маргараты |
|
Стеариновая кислота |
Октадекановая кислота |
C17H35COOH |
стеараты |
|
- |
Нонадекановая кислота |
C18H37COOH |
нонадеканоаты |
|
Тривиальное название |
Название по ИЮПАК |
Формула |
Название солей |
|
Щавелевая кислота |
Этандиовая кислота |
HOOCCOOH |
оксалаты |
|
Малоновая кислота |
Пропандиовая кислота |
HOOCСH2COOH |
малонаты |
|
Янтарная кислота |
Бутандиовая кислота |
HOOC(СH2)2COOH |
сукцинаты |
|
Глутаровая кислота |
Пентандиовая кислота |
HOOC(СH2)3COOH |
глутараты |
|
Адипиновая кислота |
Гександиовая кислота |
HOOC(СH2)4COOH |
адипинаты |
Карбоновые кислотные остатки
|
Кислотный остаток |
Название |
||
|
ацилгруппа |
название |
ацилатгруппа |
|
|
Н-CO¯ |
Формил |
H-COO¯ |
Формиат |
|
CH3-CO¯ |
Ацетил |
CH3-COO¯ |
Ацетат |
|
СН3СН2-СО¯ |
Пропионил |
СН3СН2-СОO¯ |
Пропионат |
|
СН3СН2CH2-СО¯ |
Бутирил |
СН3СН2CH2-СОO¯ |
Бутират |
|
С3Н7-СО¯ |
Изобутирил |
С3Н7-СОO¯ |
Изобутират |
|
СН3(СН2)3-СО¯ |
Валериил |
СН3(СН2)3-СОO¯ |
Валериат |
|
С6H5-СО¯ |
Бензоил |
С6H5-СОO¯ |
Бензоат |
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
-ароматические
-алифатические (в том числе предельные и непредельные)
-алициклические
-гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислотыи другие классы соединений.
Получение
· Окисление спиртов
![]()
· Окисление альдегидов
![]()
· Гидролиз тригалогеналканов
![]()
· Карбоксилирование металлорганических соединений
![]()
![]()
· Гидролиз сложных эфиров
![]()
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот
сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные
водородные связи, вследствие того что связи ![]() в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу ![]() Кроме того, у карбоновых
кислот имеется возможность образования водородных связей с кислородом
карбонильногодиполя, обладающим
значительной электроотрицательностью, а не только с кислородом другой
гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые
кислоты существуют в основном в виде циклических димеров.
Кроме того, у карбоновых
кислот имеется возможность образования водородных связей с кислородом
карбонильногодиполя, обладающим
значительной электроотрицательностью, а не только с кислородом другой
гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые
кислоты существуют в основном в виде циклических димеров.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства
карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их
основными гидроксидами дают
соли соответствующих металлов:
![]()
![]()
![]()
2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:
![]()
![]()
3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
![]()
4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
![]()
5. Под действием ![]() карбоновые
кислоты превращаются в соответствующие хлорангидриды:
карбоновые
кислоты превращаются в соответствующие хлорангидриды:
![]()
Применение
Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – фотореагент и собиратель при обогащении руд цветных металлов.
Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Непредельные карбоновые кислоты. Двухосновные карбоновые кислоты
Непредельные карбоновые кислоты – это кислоты, содержащие в своем составе одну или несколько кратных связей (двойных или тройных).
Общая формула кислот: CnH2n - 2O2
Наиболее важные представители непредельных одноосновных карбоновых кислот.
|
Тривиальное название |
Систематическое название |
Название соли и эфира |
Формула кислоты |
|
Акриловая |
Пропеновая |
Акрилат |
CH2=CH–COOH |
|
Кротоновая |
транс-2-Бутеновая |
Кротонат |
СН3 -CH=CH–COOH |
|
Олеиновая |
9- цис-Октадеценовая |
Олеат |
СН3(СН2)7СН=СН(СН2)7СООН С17Н33СООН |
|
Линолевая |
9,12-цис-Октадекадиеновая |
Линолеат |
СН3(СН2)4(СН=СНСН2)2(СН2)6СООН С17Н31СООН-содержит 2 двойные связи |
|
Линоленовая |
9,12,15-цис-Октадекатриеновая |
Линоленоат |
СН3СН2(СН=СНСН2)3(СН2)6СООН С17Н29СООН – имеет три двойные связи |
Номенклатура кислот:
международная
Название кислоты = название главной цепи + ен – У + ов + ая + кислота
У – номер атома углерода при двойной связи
Главную цепь нумеруют от углерода карбоксильной группы.
3 2 1
CH2 = CH – COOH пропен-2-овая кислота; акриловая
18 11-17 10 9 2-8 1
CH3 - (CH2)7 – CH = CH – (CH2)7 – COOH октадецен-9-овая кислота; олеиновая кислота
.Свойства кислот.
а) Поскольку молекула кислоты содержит непрочную π – связь в радикале, способную разрываться, то по радикалу возможны реакции присоединения, окисления, полимеризации, характерные для веществ непредельного строения.
б) Поскольку это класс кислот, то возможны реакции по карбоксильной группе: образование солей, хлорангидридов, ангидридов, сложных эфиров, амидов и др.
Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием замещенных производных.
I. Реакции по двойной связи
1. Акриловая кислота – непредельное соединение.
а) гидрирование
CH2 = CH – COOH + Н2 → CH3 – CH2 – COOH
б) галогенирование
CH2 = CH – COOH + Br2 → CH2 - CH – COOH
| |
Br Br
в) гидрогалогенирование
CH2 = CH – COOH + HCl→ CH2 – CH2 – COOH
|
Br
г) гидратация
CH2 = CH – COOH + Н-ОН → CH2 – CH2 – COOH
|
ОН
д) присоединение аммиака
CH2 = CH – COOH + H-NH2→ CH2 – CH2 – COOH
|
NН2
II. Реакции по карбоксильной группе - СООН
2. Акриловая кислота – класс карбоновых кислот.
а) взаимодействие со щелочью
CH2 = CH – COOH + NaOH → CH2 = CH – COONa + H2O
б) образование ангидрида
2CH2 = CH – COOH + P2O5 → (CH2 = CH – CO)2O + 2HPO3
в) образование хлорангидрида
CH2 = CH – COOH + PCl5 →CH2 = CH – C = O + HCl + POCl3
|
Cl
г) реакция этерификации
CH2 = CH – COOH + HO – C2H5 ↔ CH2 = CH – C = O + H2O
|
O – C2H5
Получение непредельных карбоновых кислот:
Конденсация альдегидов с натриевыми солями карбоновых кислот под влиянием ангидридов кислот (реакция Перкина):
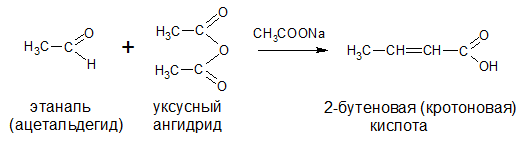
Двухосновные карбоновые кислоты
Двухосновными карбоновыми кислотами называются органические соединения, содержащие в молекуле две карбоксильные группы СООН.
Номенклатура двухосновных карбоновых кислот:
Тривиальные названия основных карбоновых кислот:
HООC – COOH – щавелевая кислота, этандиовая
HООC –СН2- COOH – малоновая кислота, пропандиовая
HООC –СН2-СН2 -COOH - янтарная кислота, бутандиовая
HООC –СН = СН -COOH – малеиновая кислота
Химические свойства.
Двухосновные кислоты вступают во все химические реакции, характерные для одноосновных кислот: образование солей, сложных эфиров, ангидридов и т.д
1. Чем ближе карбоксильные группы, тем выше кислотные свойства соединения.
![]()
При недостатке реагента процесс идет по одной карбоксильной группе с образованием кислой соли (так как вторая карбоксильная группа в реакции не участвует и проявляет кислотные свойства). При избытке реагента процесс идет по двум карбоксильным группам, с образованием средней соли.
Например:
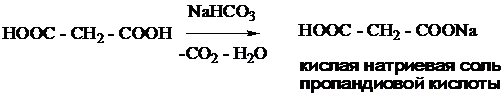
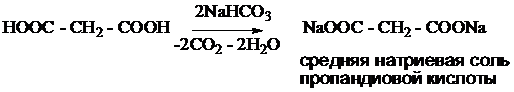

3. Есть особые специфические свойства, которые позволяют различить двухосновные карбоновые кислоты с различным количеством атомов углерода в главной цепи. Это реакция нагревания.
3.1. Если в главной цепи до трех атомов углерода включительно, то при нагревании выделяется углекислый газ (СО2), с образованием одноосновной карбоновой кислоты.
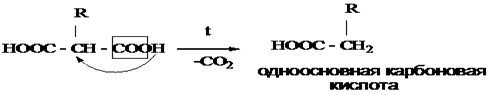
Пример1:
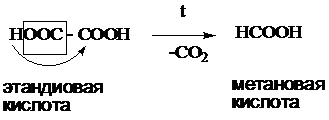
3.2. Если в главной цепи три-четыре атома углерода включительно, то при нагревании выделяется углекислый вода (Н2О), с образованием ангидрида карбоновой кислоты.
Пример 1:
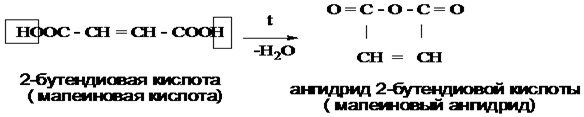
Пример 2:
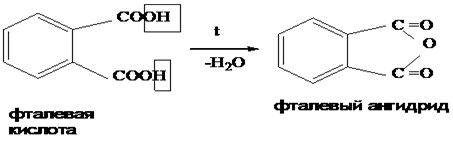
Способы получения двухосновных карбоновых кислот
Способы получения двухосновных кислот повторяют способы получения одноосновных, с той разницей, что получают одновременно или последовательно две карбоксильные группы.
Пример 1:
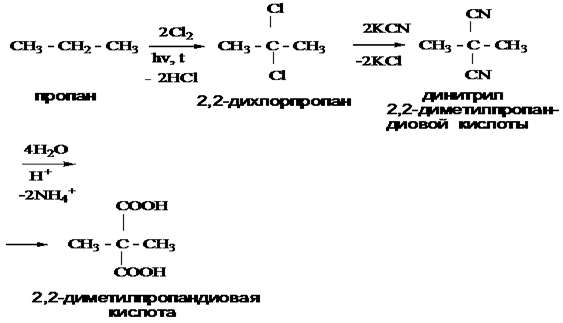
Сложные эфиры
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты
H–COO–R1.
Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Их наличием обусловлены приятные запахи цветов и фруктов. Они даже могут находиться в коре некоторых деревьев.
Посмотрите на экран и рассмотрите состав сложных эфиров, которые придают запах цветам. Демонстрируются слайды: запах жасмина - бензилпропаноат, хризантемы – сложный эфир фенилэтилового спирта и муравьиной кислоты. Как мы видим сложные эфиры, которые имеют цветочные запахи, это чаще всего производные ароматических кислот или ароматических спиртов. А вот сложные эфиры, которые входят в состав известных вам фруктов имеют довольно простой состав.
На экран проектируются слайды: запах вишни - пентилформиат, абрикосов - этилбутаноат, яблок - метилбутаноат, апельсинов – пентилпентаноат, груш – изопентлацетат; и даются формулы эфиров, которые называют учащиеся.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3.
Как могут быть получены сложные эфиры?
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
![]()
Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
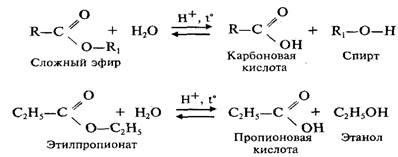
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
![]()
Эта реакция называется омылением сложного эфира.
Изомерия и номенклатура сложных эфиров
|
Структурная изомерия |
Межклассовая изомерия |
|
|
Цепи |
Положения группы |
|
|
CH3 – COO – CH2 – CH2 – CH3 Пропилацетат Пропилэтаноат Пропиловый эфир уксусной кислоты
CH3 – COO – CH – (CH3)2 Изопропилацетат Изопропилэтаноат Изопропиловый эфир уксусной кислоты |
C2H5 – COO – C2H5 Этилпропионат Этилпропаноат Этиловый эфир пропионовой кислоты
CH3 – CH2 – CH2 – COO – CH3 Метилбутират Метилбутаноат Метиловый эфир масляной кислоты |
CH3 – CH2 – CH2 – CH2 – COOH н-Пентановая кислота и ее изомеры
(Сложные эфиры изомерны карбоновым кислотам) |
Применение сложных эфиров очень разнообразно (презентация).
Их применяют в промышленности в качестве растворителей и промежуточных продуктов при синтезе различных органических соединений. Сложные эфиры с приятным запахом используют в парфюмерии и пищевой промышленности. Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
Оксикислоты (спиртокислоты)
Оксикислотами называют органические структуры, содержащие в своем составе две функциональные группы: карбоксильную и гидроксильную. В зависимости от количества карбоксильных групп в молекуле оксикислоты делятся по основности, а в зависимости от количества гидроксильных групп — по атомности. Кроме того, в зависимости от природы углеводородного радикала, связанного с функциональными группами, оксикислоты делятся на алифатические, ароматические и гетероциклические.
Номенклатура. Оксикислоты широко распространены в природе и для большинства из них используются тривиальные названия.
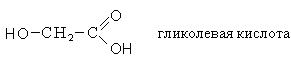
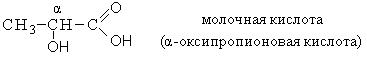
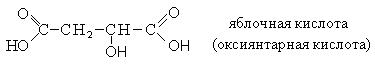
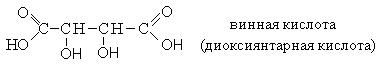
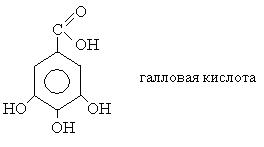
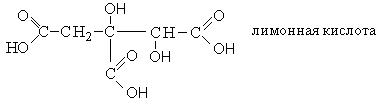
Для названия оксикислот используется также рациональная номенклатура, в соответствии с которой название образуется от соответствующей карбоновой кислоты, а положение гидроксильных групп указывается буквами α, β, γ.
По систематической номенклатуре названия оксикислот образуется от соответствующих карбоновых кислот с окончанием -овая (-диовая, -триовая), положение гидроксильной группы указывается цифрами с приставкой окси- (диокси-, триокси-).
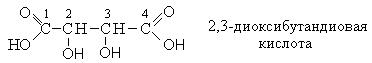
Получение оксикислот.Большинство оксикислот, распространенных в природе, являются продуктами биологического синтеза. Синтетическим путем оксикислоты можно получить из карбоновых кислот, введением гидроксильной группы, или из спирта, введением карбоксильной группы.
1. Гидролиз оксинитрилов:
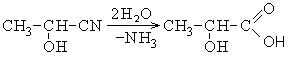
2. Гидролиз галогенпроизводных карбоновых кислот:
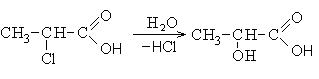
3. Гидролиз непредельных карбоновых кислот:
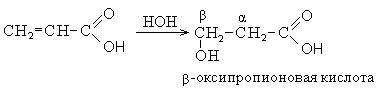
Химические свойства оксикислот. Поскольку оксикислоты являются дифункциональными соединениями, то для них характерны реакции основных функциональных групп: карбоксильной и гидроксильной. Направление химических реакций зависит от реагента и условий проведения реакции.
Как кислоты они вступают в следующие реакции:
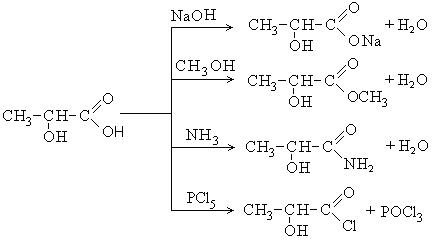
Как спирты оксикислоты вступают в следующие реакции:
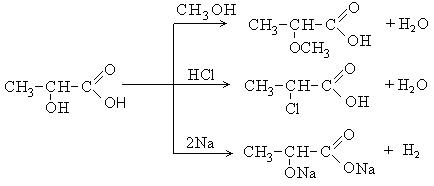
Внутри молекулы происходит постоянная борьба между функциональными группами в соответствии с законом единства и борьбы противоположностей, поэтому оксикислоты вступают в свои специфические реакции, характерные только для них:
реакция дегидратации
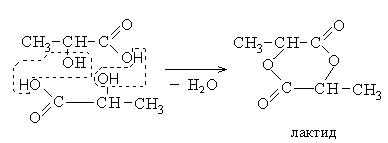
При дегидратации α- оксикислот происходит межмолекулярное отцепление воды с образованием лактидов.
β-оксикислоты дегидратируются с образованием непредельных кислот
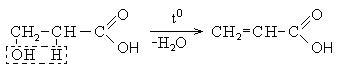
γ- и другие оксикислоты дегидратируются с образованием лактонов
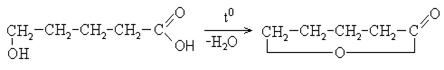
Оптическая изомерия оксикислот и некоторые вопросы стереохимии
Ряд органических соединений обладает оптической активностью, то есть эти вещества реагируют на прохождение через их растворы плоскополяризованного луча света, вращая плоскость поляризации на определенный угол α.
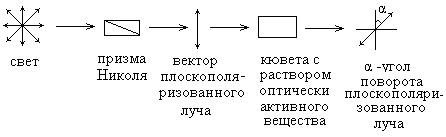
Оптической активностью обладают такие органические структуры, которые содержат в своем составе ассиметрический атом углерода, то есть атом углерода, связанный с четырьмя различными группами атомов.
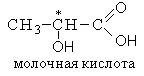
Одни формы оптически активных веществ вращают плоскость поляризации вправо, они называются правовращающими и обозначаются d (+). Другие формы того же вещества вращают плоскость поляризации влево, называются левовращающими и обозначаются l (-). Смесь равных количеств лево- и правовращающей формы называется рацематом, который не обладает оптической активностью.
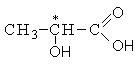
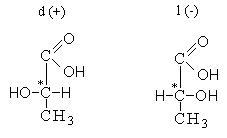
Изображение формул молочной кислоты в виде формул Фишера
Лево- и правовращающие формы молочной кислоты по отношению друг к другу являются оптическими изомерами, то есть относятся друг к другу как предмет к зеркальному изображению и при наложении никогда не совпадают. Существование оптических изомеров молочной кислоты объясняется sp3-гибридизацией ассиметричного атома углерода, который предполагает существование двух тетраэдров с различным расположением функциональных групп.
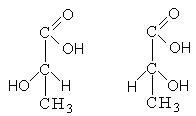
Однако знак вращения не является надежной характеристикой для всех членов ряда.
Для того чтобы произвести классификацию по рядам, за основу выбирается конфигурация. Эталоном для выбора конфигурации выступает глицериновый альдегид.
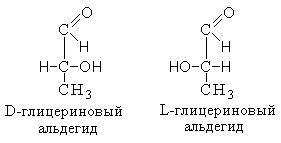
Отнесение соединения к D- или L-ряду проводят путем сравнения строения нижнего тетраэдра данного соединения с D- или L-глицериновым альдегидом. Таким образом, левовращающая форма молочной кислоты относится к D-ряду, а правовращающая – к L-ряду.
Общее количество оптических изомеров N рассчитывается по формуле:
![]() где n
– количество ассиметричных центров в молекуле.
где n
– количество ассиметричных центров в молекуле.
Молочная кислота.
Существует правовращающая форма молочной кислоты, которая называется мясомолочной кислотой. Она присутствует в мышцах животных организмов. Молочная кислота, которая образуется при брожении сахаров под действием молочнокислых бактерий, является оптически не деятельной (рацемат). Процесс образования рацемата молочной кислоты происходит при получении кефира и другой кисломолочной продукции. Процесс молочнокислого брожения протекает под действием молочнокислых бактерий:
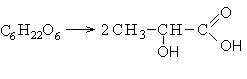
Эфиры молочной кислоты используются в хлебопекарном производстве.
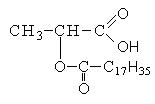
Винная кислота. Винная кислота в виде калиевой соли входит в состав винного камня, образование которого происходит при выдержке вин. Винная кислота используется при изготовлении конфет, безалкогольных напитков, сиропов. В виде натрийкалиевой соли используется для получения реактива Фелинга.
Кетокислоты и альдегидокислоты
К этой группе дифункциональных соединений относятся кислоты, содержащие в своем составе карбонильную и карбоксильную группы:

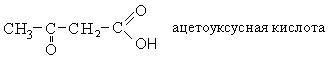
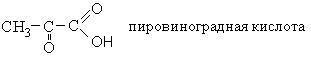
Эти кислоты являются продуктами метаболизма живого организма. Также существуют и синтетические способы получения этих соединений.
В органическом синтезе большое значение имеет этиловый эфир ацетоуксусной кислоты. На его основе проводятся специальные органические синтезы, которые называются синтезы на основе ацетоуксусного эфира.
Для ацетоуксусного эфира характерна кето-енольная таутомерия.
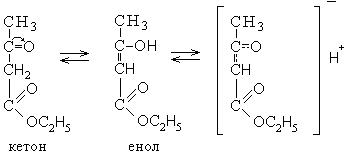
Аминокислоты
Аминокислоты - это производные карбоновых кислот, содержащие в своем составе две функциональные группы: аминогруппу - NH2 и карбоксильную группу - СООН, связанные с углеводородным радикалом. Простейшим представителем этого класса является аминоэтановая или аминоуксусная кислота
H2N – СН2 – СООН
Общая формула аминокислот:
H2N – CH – COOH
|
R
Общая формула предельных аминокислот с одной карбоксильной
и одной аминогруппой - CnH2n+1NН2
Классификация аминокислот:
1. По происхождению аминокислоты делят на: природные и синтетические
Природные (их около 150) были обнаружены в живых организмах. Около 20 из них входит в состав белков. Половина этих аминокислот - незаменимые (они не синтезируются в организме человека), а должны поступать с пищей.
Синтетические получают искусственным путем, например из галогенопроизводных карбоновых кислот, кислотным гидролизом белков.
2. По количеству функциональных групп :
моноаминомонокарбоновые
диаминомонокарбоновые С-С-С-С-С -СООН
׀ ׀
NH2 NH2 2, 6 – диаминогексановая кислота
моноаминодикарбоновые НООС-С-С-С-СООН
|
NH2 2-аминопентандиовая кислота
3. По взаимному расположению функциональных групп:
на примере аминопропановй кислоты: α - и β- кислоты
В биохимии важную роль играют только α -аминокислоты, широко распространенные в живой природе. В биосинтезе белка в живых организмах участвуют 20 аминокислот (таблица 1).
Виды изомерии
- Изомерия углеродного скелета,
- изомерия положения функциональных групп
- межклассовая изомерия – изомерия с классом нитросоединений, сложные эфиры);
-оптическая т. к. содержат асимметрические атомы углерода.
Оптически активные вещества встречаются в виде пар антиподов-изомеров, физические и химические свойства которых одинаковы, за исключением одного – способности вращать плоскость поляризованного луча в противоположные стороны.
Р![]() азличают D-аминокислоты и L-аминокислоты.
азличают D-аминокислоты и L-аминокислоты.
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху.
Гомологи, номенклатура и изомеры аминокислот .
Номенклатура: «амино» + название кислоты
Межклассовыми изомерами для аминокислот являются нитросоединения R—NO2.
1.NH2—CH2—COOH CH3CH2NO2 нитроэтан
аминоэтановая кислота( глицин)
2.![]() CH3CH2CH2—NO2
1-нитропропан
CH3CH2CH2—NO2
1-нитропропан
2-аминопропановая кислота
![]() -аминопропановая кислота
(аланин)
-аминопропановая кислота
(аланин)
NH2—CH2CH2—COOH
3-аминопропановая кислота
![]() -аминопропановая кислота
-аминопропановая кислота
3.
![]()
2-аминобутановая кислота
![]() -аминобутановая кислота
-аминобутановая кислота
2-аминомасляная кислота
![]()
3-аминобутановая кислота
![]() -аминобутановая кислота
-аминобутановая кислота
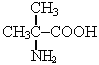
2-амино-2-метилпропановая кислота
CH3CH2CH2CH2—NO2
1-нитробутан
Изомерия аминокислот в основном выражается разным строением углеродной цепи и положением аминогруппы: (записываем на доске)
4 3 2 1
СН3 – СН2 – СН – СООН 2 – аминобутановая кислота
|
NH2
СН3
3 2 | 1
СН2 – СН – СООН 3- амино- 2- метилпропановая кислота
|
NH2
Кроме международной номенклатуры, употребляются еще названия аминокислот, в которых вместо цифр ставят буквы греческого алфавита: α, β, γ и.т.д.
Например: (записываем на доске)
γ β α
СН3 – СН2 – СН – СООН
|
NH2
α – аминобутановая кислота
Получение аминокислот:
Аминокислоты, входящие в состав белков получают путем их гидролиза (видеоролик).
Из карбоновых кислот:
CH3—CH2—COOH + Cl2 ![]() CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + 2NH3 → CH3—CH(NH2)—COOH
+ NH4Cl
Известны также синтетические способы получения аминокислот. Так, например, в молекуле карбоновых кислот атомы водорода в радикале можно заместить на галоген, (записываем на доске)
Р (красный)
СН3 – СООН + СI2 → СН2 – СООН + НСI
|
CI
А затем действуем аммиаком, получая аминогруппу.
СН2 - СООН + NН3 → NН2 – СН2 – СООН + НСI
|
CI
Физические свойства аминокислот
· Бесцветные, кристаллические., хорошо растворимы в воде, но нерастворимы в эфире.
· В зависимости от R могут быть сладкими, горькими или безвкусными.
· Обладают оптической активностью.
· Плавятся с разложением при температуре выше 200º.
Химические свойства
Химические свойства аминокислот определяются наличием в молекуле двух функциональных групп:
1. Аминогруппа – NH2 определяет ОСНОВНЫЕ свойства аминокислот, взаимодействие с кислотами.
Н2N – СН2 – СООН + НСI → [H3N+ – СН2 - СООН]СI-
Карбоксильная группа -СООН характеризует КИСЛОТНЫЕ свойства аминокислот: взаимодействие с щелочами, оксидами металлов, активными металлами, солями, спиртами)
2.H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + Н2О (аминоацетат натрия)
H2N – CH2 – COOH +СН3ОН→ H2N – CH2 – COOСН3 + Н2О (сл эфир
Как называются вещества, которые могут взаимодействовать и с кислотами и с основаниями? ( Амфотерными или амфолитами)
3.Реакция горения аминоуксусной кислоты
4NH2CH2COOH + 13O2 ![]() 8CO2 + 10H2O + 2N2
8CO2 + 10H2O + 2N2
В твердом состоянии и частично в растворах аминокислоты представляют собой "внутренние соли", то есть состоят из биполярных ионов +NH3—R—COO-, образующихся при обратимом переносе протона (H+) от карбоксильной группы к аминогруппе, например:
4. Взаимодействие внутри молекулы – образование внутренних солей. Кроме того, аминогруппа в молекуле аминокислоты вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль.
Н2N – СН2 – СООН ↔ Н3N+ - СН2 – СОО-
5. Взаимодействие аминокислот друг с другом – образование пептидов (ди, три, полипептидов):
(Поликонденсация аминокислот)
O H
|| |
Н2N – СН2 – СООН + Н2N – СН2 – СООН → Н2N – СН2 −C−N− СН2 – СООН
пептидная связь, полипептид
(глицилглицин)
Применение: пищевая, медицинская, химическая, микробиологическая промышленности, получение волокон- полиамидный, капрона.
Аптека
Аминокислоты и их производные используются в качестве лекарственных средств в медицине. В аптеке можно купить глицин в таблетках. Этот препарат оказывает укрепляющее действие на организм и стимулирует работу мозга:
- уменьшает напряжение, конфликтность; - улучшает настроение;
- повышает умственную работоспособность.
Тауфон (глазные капли) является серосодержащей аминокислотой. Препарат способствует улучшению энергетических процессов, стимулирует процессы при заболеваниях тканей глаза. Способствует нормализации функций клеточных мембран. Применяют при травмах роговицы.
Метионин - незаменимая аминокислота. Применяют при лечении печени, профилактика токсического поражения печени.
Глютаминовая кислота заменимая кислота. Применяют при лечении эпилепсии, депрессии, истощения, задержка психического развития.
Белки.
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называютпростыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называютсложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают:нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называютпептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованиюполипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).

Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
Функция
Строительная Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д.
Транспортная Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
Регуляторная Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Защитная В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Двигательная Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
Сигнальная В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку.
Запасающая В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Энергетическая При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
Каталитическая Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках.
Липиды.
Липиды – это сложная смесь продуктов растительного, животного и микробиологического происхождения, нерастворимая в воде, но хорошо растворимая в органических растворителях, таких как хлороформ, эфир, бензол.
Липиды делятся на простые и сложные.
Простые липиды.
К простым липидам относятся нейтральные жиры (глицериды), воски и стериды. Простые липиды по своей химической природе являются сложными эфирами высокомолекулярных карбоновых кислот и спиртов самого различного строения.
Сложные липиды.
К сложным липидам относятся фосфолипиды, гликолипиды, сульфолипиды, содержащие в своей структуре такие элементы, как фосфор, азот, серу.
Нейтральные жиры (глицериды)
Нейтральные жиры также делятся на простые и сложные. Простые ― содержат остатки одной кислоты, а в сложных жирах остатки представлены различными кислотами.
Важнейшими представителями сложных эфиров являются жиры.
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами, и таким образом впервые синтезировал жир.
Впервые
химический состав жиров определил в начале прошлого века французский химик Мишель
Эжен Шеврёль, основоположник химии жиров. Действуя водными растворами
кислот и щелочей на различные жиры, он получил в результате реакции гидролиза
(омыления) открытый еще Шееле глицерин
и неизвестные ранее химические соединения – различные жирные кислоты, многим из
которых он и дал названия. А «сладкое масло» Шееле Шеврёль назвал глицерином.
Жиры (триглицериды) – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Общая
формула: 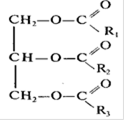 , где R1,
R2, R3 –
УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов
углерода.
, где R1,
R2, R3 –
УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов
углерода.
Название жира складывается из названия входящих в его состав кислот.

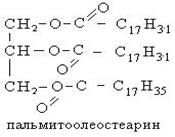
Физические свойства
Жиры в воде не растворяются, но растворяются в органических растворителях (бензине, бензоле, гексане...). Поэтому их можно извлечь экстракцией из измельченных семян растений или из животных продуктов этими растворителями при нагревании. Рассмотрим классификацию жиров:
Классификация жиров
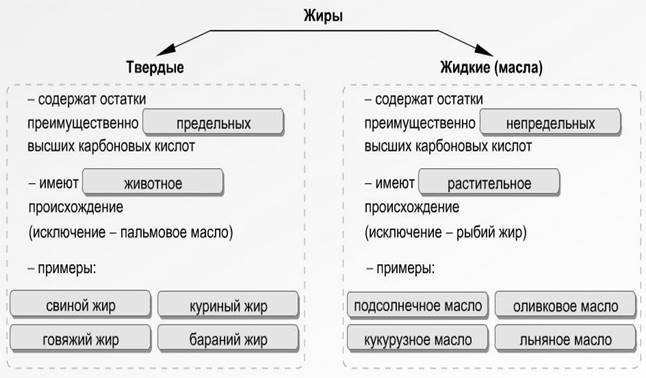
Наиболее важные ВКК, входящие в состав жиров:
|
Насыщенные кислоты |
Ненасыщенные кислоты |
||
|
Эмпирическая формула ВКК |
Название кислоты (кислотного остатка) |
Эмпирическая формула ВКК |
Название кислоты (кислотного остатка) |
|
С15Н31СООН |
Пальмитиновая (пальмитат) |
С17Н33СООН |
Олеиновая (олеат) |
|
С17Н35СООН |
Стеариновая (стеарат) |
С17Н31СООН |
Линолевая (линолеат) |
|
|
|
С17Н29СООН |
Линоленовая |
Получение жиров
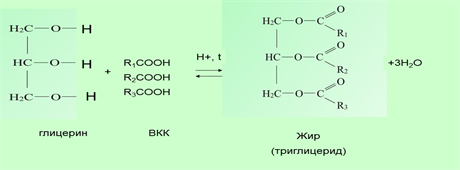
Химические свойства жиров
I. Реакции присоединения
1. Присоединение галогенов (взаимодействие с бромной водой):
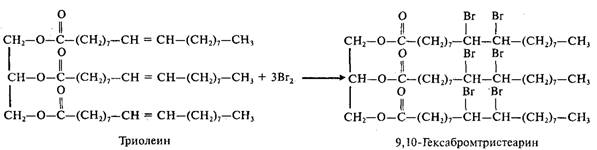
Бромная вода в результате этой реакции обесцвечивается.
2. Гидрирование:
Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина – твердого жира из растительных масел.
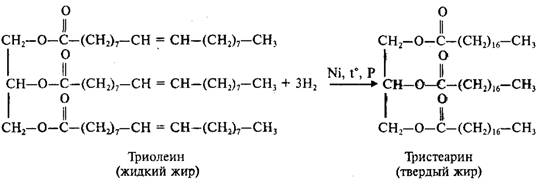
I. Гидролиз
В зависимости от условий гидролиз бывает:
1. Водный (без катализатора, при высоких температуре и давлении),
2. Кислотный (в присутствии кислоты в качестве катализатора),
3. Ферментативный (происходит в живых организмах):
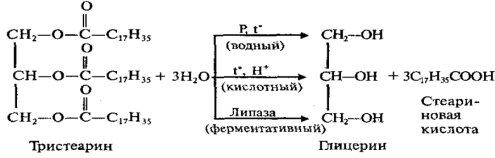
4. Щелочной (под действием щелочей):
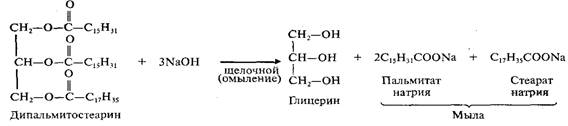
Мыла – натриевые или калиевые соли ВКК.
Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.
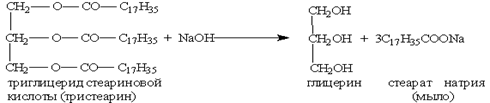
Биологическая роль жиров
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. И первые среди незаменимых - жирные кислоты с несколькими двойными связями в молекуле. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
• строительная (входят в состав клеточных мембран);
• энергетическая (1 г жира при окислении дает 9 ккал энергии);
• защитная (теплорегуляционная, механическая защита органов);
• запасная (запас энергии и воды);
• регулирующая (обмен веществ в организме).
Применение жиров
1. Пищевая промышленность
2. Фармацевтика
3. Производство мыла и косметических изделий
4. Производство смазочных материалов
Весьма важными являются реакции полимеризации масел. По этому признаку растительные масла делят на высыхающие, полувысыхающие и невысыхающие. Высыхающие в тонком слое образуют блестящие тонкие пленки. На этом основано использование этих масел для приготовления лаков и красок (льняное). К полувысыхающим относятся, например, подсолнечное, а к невысыхающим относится оливковое, содержащее мало непредельных кислот.
Константы жиров
Для аналитической характеристики жиров применяются специфические показатели - кислотное число, число омыления, йодное число.
Природные жиры нейтральны. Однако при хранении или переработке могут частично произойти процессы омыления или окисления, вследствие чего образуется примесь свободных жирных кислот. Количество этих кислот может быть охарактеризовано кислотным числом.
Кислотным числом называется показатель, характеризующий содержание в жире свободных жирных кислот. Оно выражается в миллиграммах едкого кали, затраченного на нейтрализацию свободных жирных кислот, содержащихся в 1 г исследуемого вещества. По величине кислотного числа можно определить качество продукции.
Число омыления выражается в миллиграммах едкого кали, необходимого для омыления глицеридов и нейтрализации свободных жирных кислот в 1 г жира или масла. Число омыления для большинства жиров обычно колеблется в пределах от 150 до 195. По числу омыления можно судить о средней молекулярной массе входящих в состав жира жирных кислот и определить при мыловарении количество щелочи, необходимое для омыления жира.
Йодное число – показатель, характеризующий непредельность жирных кислот, входящих в состав жира. Оно выражается количеством граммов йода, которое может присоединиться по двойным связям к 100 г жира. Оно особенно важно для оценки качества высыхающих масел, расчета количества водорода для его гидрогенизации
Виды порчи жиров.
1. Прокисание – начальная стадия порчи жиров. Оно связано с гидролизом жиров, который приводит к накоплению свободных жирных кислот, придающий жиру кислый вкус.
2. Прогоркание – вызывается в первую очередь окислением непредельных жирных кислот, конечными продуктами являются масляная кислота, альдегиды, кетоны и другие соединения, придающие жиру горький вкус. Окисление приводит не только к ухудшению качества пищевых продуктов и снижению пищевой ценности, но и непригодности использования в пищу и большим потерям.
3. Осаливание – наиболее глубокий процесс порчи жиров. Оно связано с окислением непредельных кислот до оксикислот. В процессе осаливания изменяется консистенция жира, повышается температура плавления, жир обесцвечивается и приобретает салистый привкус. Такой жир не может быть использован как пищевой продукт, его применяют для технических целей.
Воски
Воски – это природные соединения, по своей химической природе являющиеся сложными эфирами высокомолекулярных карбоновых кислот и высокомолекулярных спиртов. Кроме этого, в состав воска входят высокомолекулярные предельные углеводороды (парафины), небольшое количество высокомолекулярных спиртов и кислот. Известен пчелиный воск, спермацет, шерстяной жир (ланолин), карнаупский воск (воск пальмы).
Воском покрыты различные фрукты и овощи: виноград, яблоки, капуста. Воск предохраняет плоды от порчи, сохраняя влагу.
Сложные липиды
К сложным липидам относятся фосфолипиды, гликолипиды, сульфолипиды, содержащие в своей структуре такие элементы, как фосфор, азот, серу.
Фосфолипиды. В состав фосфолипидов наряду с остатками высокомолекулярных предельных и непредельных карбоновых кислот входят остатки фосфорной кислоты и органических оснований (холин, этанол, амин).
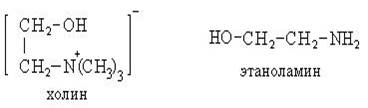
Если в качестве органического основания выступает холин, то данная группа фосфолипидов называется лейцином. Если в качестве основания выступает этаноламин, то данная группа фосфолипидов называется кефалином.
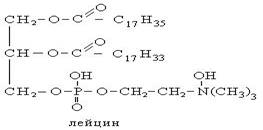
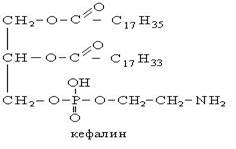
Фосфолипиды в большом количестве содержатся в осадке, образующемся в растительном масле при стоянии. Фосфолипиды обладают биологической ценностью, поэтому их необходимо выделять и использовать.
Гликолипиды. В состав структуры гликолипидов наряду с остатками высокомолекулярных карбоновых кислот входят моносахариды.
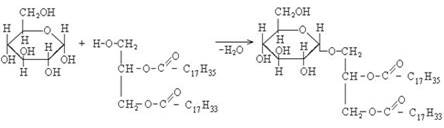
Углеводы. Моносахариды.
Углеводы (сахара)- кислородосодержащие органические вещества природного происхождения, содержащие с своем составе несколько гидроксильных групп (-ОН), карбонильную группу (-С=О), а также их производные.
Название «углеводы» эти соединения получили потому, что состав многих из них выражается общей формулой Сn(H2O)m, т. е. формально являются соединениями углерода и воды. С развитием химии углеводов обнаружены соединения, состав которых не отвечает приведенной формуле, но обладающие свойствами веществ своего класса (например, дезоксирибоза С5Н10О4). Углеводы – это чрезвычайно разнообразный класс соединений, как по составу, так и по строению их молекул.
Функции углеводов.
Структурная. Полисахариды представляют собой материал для опорных элементов. Целлюлоза входит в структуру клеточных стенок, дает растениям жесткость. Хитин входит в состав клеточных стенок грибов, а также используется для построения наружного скелета у членистоногих.
Энергетическая. Углеводы обеспечивают до 70 % потребности организма в энергии. При окислении 1 г углеводов выделяется 17,6 кДж энергии. Углеводы окисляются до воды и углекислого газа.
Защитная. Из этих элементов состоят шипы и колючки растений. Например, камеди (смолы, выделяющиеся при повреждении стволов и веток растений), препятствующие проникновению в раны болезнетворных микроорганизмов, являются производными моносахаридов.
Запасающая. Углеводы запасаются в виде крахмала в структуре растений и гликогена у животных. При дефиците энергии эти вещества расщепляются до глюкозы.
Осмотическая.
Вещества способствуют регулированию осмотического давления.
Классификация углеводов.
По способности к гидролизу углеводы можно разделить на 3 основные группы:

Моносахариды (монозы, или простые сахара) – углеводы, которые не способны гидролизоваться с образованием более простых углеводов. Состоят из одной молекулы и представляют собой твердые кристаллические вещества, бесцветные и хорошо растворимые в воде. Почти все они обладают приятным сладким вкусом. Общая формула Сn Н2nОn
Классификация моноз:
1.По числу углеродных атомов в молекуле моносахариды делятся на
тетрозы n=4 С4 Н8О4
пентозы n=5 С5 Н10О5
гексозы n=6 С6 Н12О6
и т. д.
Наиболее широко распространены в животном и растительном мире пентозы и гексозы. Пентозы представлены такими важными соединениями, как рибоза (С5Н10О5) и дезоксирибоза (С5Н10О4). В дезоксирибозе около одного из атомов углерода отсутствует кислород, отсюда и название этого углевода. Рибоза и дезоксирибоза входят в состав мономеров нуклеиновых кислот – ДНК и РНК, а также в состав АТФ.
Из гексоз наиболее широко распространены глюкоза, фруктоза и галактоза. Их общая формула С6Н12О6.
2. По функциональной группе различают альдозы (альдегидная группа имеется) и кетозы (кетонная группа) и несколько гидроксильных групп,.
Моносахариды с альдегидной группой называются альдозами, а с кетогруппой – кетозами.
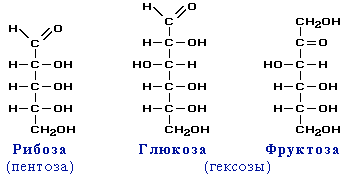
Глюкоза и фруктоза являются межклассовыми изомерами. Глюкоза является альдегидоспиртом, а фруктоза кетоноспиртом. С6 Н12О6
Для глюкозы характерна и оптическая изомерия:
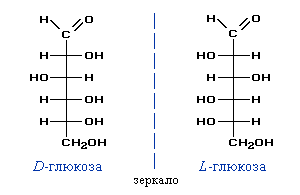 Строение
Строение
Таутомерия (мутаротация). Для всех моносахаридов характерно явление мутаротации, т.е. существование в циклической и нециклической формах. Таутомерия - самопроизвольная перестройка атомов в молекуле, находящейся в растворе.
Рассмотрим это явление на примере молекулы глюкозы. Поскольку в пространстве углерод-углеродная цепь глюкозы изогнута, то карбонильная группа располагается близко к –ОН группе пятого атома углерода. Происходит взаимодействие этих двух групп одной молекулы и цикл замыкается с образованием внутреннего полуацеталя.
Вновь образовавшийся гидроксил (выделен на рис. синим цветом) носит название полуацетального, или гликозидного и может по разному располагаться в пространстве относительно цикла. Если полуацетальный гидроксил располагается по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду, то такой изомер называется α-изомером, если по разные стороны – β-изомером. Циклическая и открытая формы легко переходят друг в друга и находятся в динамическом равновесии. При комнатной температуре преобладает циклическая, при нагревании – открытая форма.
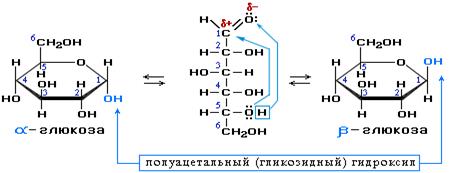
D- глюкоза
Внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов.
Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. Формулы, отображающие строение циклических форм моносахаридов, были предложены У. Хеуорсом в 20-х годах прошлого века.
Запомнить! При написании структурных формул по Хеуорсу гидроксильная группа при атоме С1 должна быть расположена ниже плоскости кольца в α-форме, а в β-форме - выше плоскости кольца.
Фруктоза является изомером глюкозы. В отличие от молекулы глюкозы, в молекуле фруктозы содержится кетонная группа, в циклической форме фруктозы содержится пять атомов углерода, а не шесть, как в молекуле глюкозы.
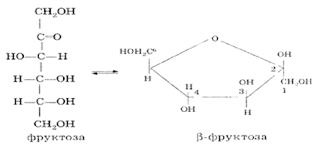
Фруктоза является кетоноспиртом.
Химические свойства.
Химические свойства глюкозы обусловлены наличием альдегидной группы и гидроксильных групп.
I. Реакции по альдегидной группе
1. Окисление. Глюкоза легко окисляется и образует глюконовую кислоту.
А) Взаимодействие с солями двухвалентной меди при нагревании. выпадает осадок красного цвета – оксид меди (I). Эту реакцию можно использовать для качественного обнаружения глюкозы.
CuSO4 + 2NaOH→ Na2SO4 + Cu(OH)2↓
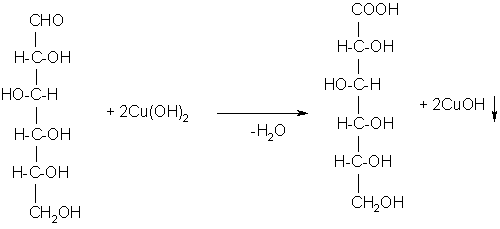
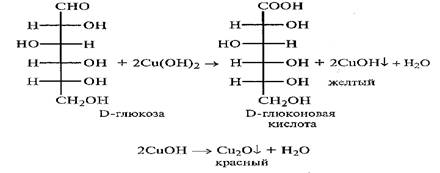
Б) Реакция с аммиачным раствором оксида серебра (I) - реакция "серебряного зеркала" - (качественная реакция на альдегидную группу)
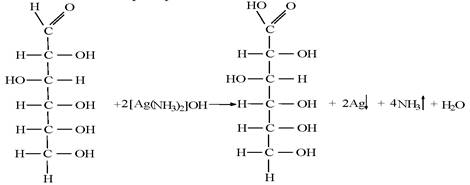
К особенностям протекания реакций окисления можно отнести
В. Реакция с бромной водой
В реакции глюкозы с бромной водой образуется глюконовая кислота и происходит обесцвечивание раствора брома. Поэтому эту реакцию можно использовать для качественного определения альдегидной группы в глюкозе.
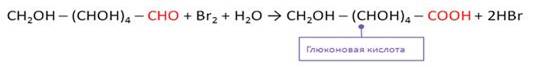
2.Реакция восстановления. Так, при восстановлении глюкозы водородом в присутствии катализатора, образуется шестиатомный спирт – сорбит.
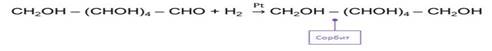
II. Реакции на спиртовую группу
1.Качественная реакция на гидроксильную группу
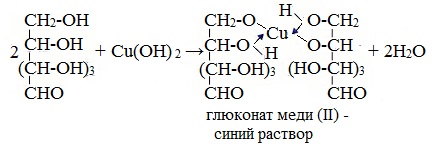

2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
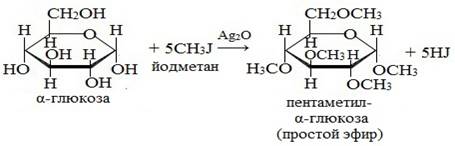
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
3. Ацилирование или реакция этерификации-взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
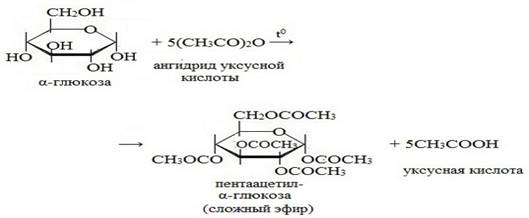
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
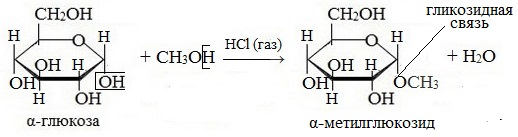
III. Специфические свойства: брожение - расщепление под действием микроорганизмов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
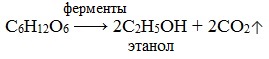
2) Молочнокислое брожение
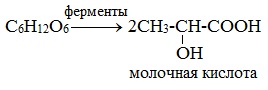 (образуется
в организмах высших животных при мышечных сокращениях).
(образуется
в организмах высших животных при мышечных сокращениях).
3) Маслянокислое брожение
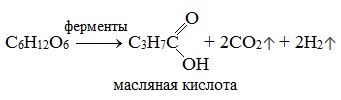
4) Лимоннокислое брожение
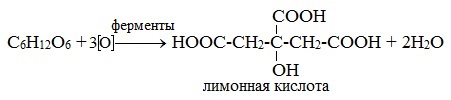
Получение
1.В природе глюкоза образуется в процессе фотосинтеза в зелёных растениях под действием солнечного света при участии хлорофилла.
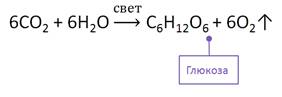
2.Синтез глюкозы из муравьиного альдегида осуществил в 1861 году А. М. Бутлеров.
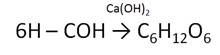
3.В промышленности глюкозу получают гидролизом крахмала
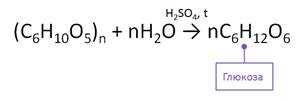
Дисахариды
Дисахариды – это углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Классификация
Дисахариды состоят из двух остатков моносахаридов, соединенных между собой О-гликозидной связью. Если один полуацетальный гидроксил остается свободным, а дисахариды проявляют альдегидные свойства, то такие дисахариды называются восстанавливающими. Если же связь между двумя остатками моносахаридов осуществляется
посредством обоих полуацетальных гидроксилов, то для таких дисахаридов альдегидные свойства не характерны и они называются невосстанавливающими. Примеры дисахаридов данных типов приведены на схеме.
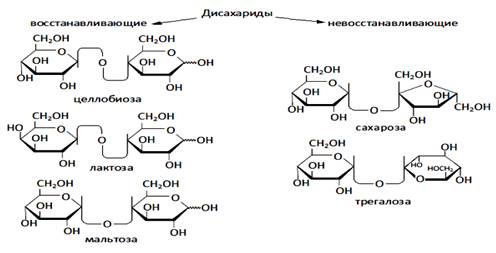
Для дисахаридов первого типа сохраняется возможность кольчато-цепной таутомерии и способность к мутаротации.
Для
невосстанавливающих их дисахаридов эти явления не характерны 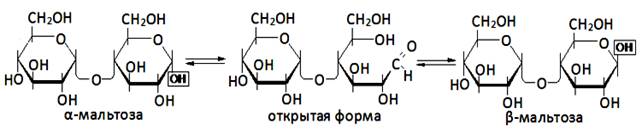
Восстанавливающие дисахариды часто называют гликозо-гликозидами, а невосстанавливающие – гликозидо-гликозидами.
Номенклатура.
Для восстанавливающих дисахаридов, название начинается с невосстанавливающего звена, которое рассматривают как заместитель в восстанавливающем. Звено восстанавливающего моносахарида составляет коренное слово. Между названиями моносахаридных звеньев ставят в скобках цифры, указывающие номера атомов углерода этих звеньев, связанных через кислород. Цифры соединяют запятой или стрелкой, направленной от углеродного атома, являющегося гликозидным центром. Таким образом, название мальтозы в соответствии с номенклатурой будет α-D-глюкопиранозил[1→4]-D-глюкопираноза, а лактозы – β-D-галактопиранозил[1→4]-D-глюкопираноза.
В случае невосстанавливающих дисахаридов название одного из мономерных моносахаридов входит в общее название
с суффиксом “ил”, а другого – с суффиксом “ид”.
Если в состав дисахарида входят два одинаковых остатка моносахаридов, то не имеет значения, какой из них будет назван первым. Примером такого дисахарида является трегалоза, систематическое название которой будет α-D-глюкопиранозил-α-D-глюкопиранозид. Если же в состав дисахарида входят остатки двух разных моносахаридов, то начинать название можно с любого из них. В этом случае традиционное название сахарозы будет α-D-глюкопиранозил-β-D-фруктофуранозид (но не β-D-фруктофуранозил-α-D-глюкопиранозид).
Химические и физические свойства
Дисахариды, как и моносахариды, представляют собой кристаллические вещества, хорошо растворимые в воде, плохо – в спирте и практически нерастворимы в неполярных органических растворителях
Гидролиз
Гидролиз дисахаридов протекает достаточно легко в связи с тем, что связь между моносахаридными звеньями ацетальная.
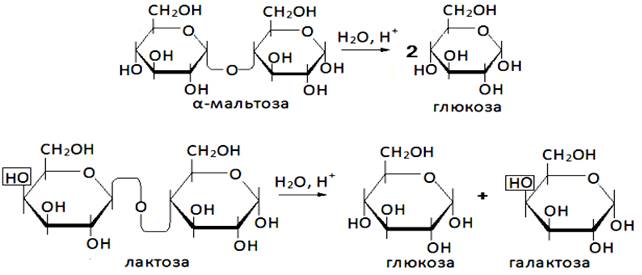
Окисление
Как уже отмечалось ранее, для восстанавливающих дисахаридов в качестве окислителей можно использовать реактив Толленса, Фелинга, бром и другие вещества, окисляющие альдегиды.
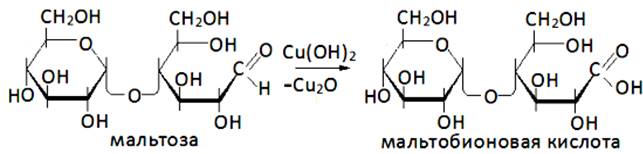
Различия химических свойств дисахаридов и моносахаридов обусловлены наличием в молекулах первых лабильной гликозидной связи. Например, весьма трудно идет реакция получения из дисахаридов меркапталей. Это объясняется тем, что для синтеза необходима сильнокислая среда, т.е. условия, в которых гликозидные связи легко расщепляются.
Невосстанавливающие дисахариды по своему химическому поведению имеют сходства, например, алкил- или арилгликозидами. Так, полуацетальная группировка в них блокирована, и карбонильная функция не проявляется.
Отдельные представители
Восстанавливающие
Целлобиоза — 4-(β-глюкозидо)-глюкоза, дисахаридов, состоящий из двух остатков глюкозы, соединённых β-глюкозидной связью; основная структурная единица целлюлозы.
Белое кристаллическое вещество, хорошо растворимое в воде и в 45 — 48°-ном спирте. Плохо растворима в 96°-ном спирте иэфирах. Молекулярная масса = 342,30 г/моль. Температура плавления = 225 °C. Оптически активна, мутаротирует в растворе.
При кислотном гидролизе или под действием фермента β -глюкозидазы расщепляется с образованием 2 молекул глюкозы:
С12Н22О11 + Н2О = 2С6Н12О6
Получают целлобиозу ферментативным гидролизом целлюлозы. В свободном виде целлобиоза содержится в соке некоторых деревьев
Мальтоза — солодовый сахар, 4-О-α-D-глюкопиранозил-D-глюкоза, природный дисахарид, состоящий из двух остатков глюкозы; содержится в больших количествах в проросших зёрнах (солоде) ячменя, ржи и других зерновых; обнаружен также в томатах, в пыльце и нектаре ряда растений.
Биосинтез мальтозы из β-D-глюкопиранозилфосфата и D-глюкозы известен только у некоторых видов бактерий. В животном и растительном организмах мальтоза образуется при ферментативном расщеплении крахмала и гликогена.
Мальтоза легко усваивается организмом человека. Генетически обусловленное отсутствие этого фермента в слизистой оболочке кишечника человека приводит к врождённой непереносимости мальтозы — тяжёлому заболеванию, требующему исключения из рациона мальтозы, крахмала и гликогена или добавления к пище фермента мальтазы.
При кипячении мальтозы с разбавленной кислотой и при действии фермента мальтаза гидролизуется. Образуется две молекулы глюкозы.
Лактоза ( C12H22O11 ) — углевод группы дисахаридов, содержится в молоке и молочных продуктах. Молекула лактозы состоит из остатков молекул глюкозы и галактозы. Лактозу иногда называют молочным сахаром.
Применяют для приготовления питательных сред, например при производстве пенициллина. Используют в качестве вспомогательного вещества (наполнителя) в фармацевтической промышленности.
Из лактозы получают лактулозу - ценный препарат для лечения кишечных расстройств, например, запора. Несмотря на употребление лактозы в лечебных целях, у многих людей лактоза не усваивается и вызывает нарушения в работе пищеварительной системы, в том числе диарея, боли и вздутие живота, тошноту и рвоту после употребления молочных продуктов. У этих людей отсутствует или производится в недостаточном количестве фермент лактаза.
Невосстанавливающие.
Сахароза (C12H22O11) или свекловичный сахар, тростниковый сахар, в быту просто сахар. Состоит из двух моносахаридов — α-глюкозы и β-фруктозы.
Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах, плодах и ягодах. Особенно велико содержание сахарозы в сахарной свёкле и сахарном тростнике, которые и используются для промышленного производства пищевого сахара.
Сахароза имеет высокую растворимость. В химическом отношении сахароза довольно инертна, так как при перемещении из одного места в другое почти не вовлекается в метаболизм. Иногда сахароза откладывается в качестве запасного питательного вещества.
Полисахариды
Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (обычно гексоз), связанных гликозидными связями.
Важнейшие природные представители: крахмал, гликоген, целлюлоза. Это природные полимеры (ВМС), мономером которых является глюкоза. Их общая эмпирическая формула (C6H10O5)n. Важнейшими полисахаридами являются крахмал, гликоген, целлюлоза, хитин, муреин.
Xитин широко распространен в природе, являясь опорным компонентом клеточной стенки большинства грибов и некоторых водорослей, наружной оболочки членистоногих и червей, некоторых органов моллюсков.
Муреин- полисахарид, выполняющий опорную функцию в оболочках бактериальных клеток. По своей структуре он схож с хитином и в его молекуле также содержится азот.
Нахождение крахмала и целлюлозы в природе
Крахмал и целлюлоза широко распространены в природе.
Крахмал входит в состав многих растений. В пшенице содержание крахмала составляет 64 %, в рисе – 75 %, в кукурузе – 70 % и в картофеле – 24 %.
Целлюлоза – основной материал клеток растений, она придает прочность стеблям и веткам. Больше всего – 98 % целлюлозы в хлопковом волокне, до 85 % её содержится в льняном волокне. Древесина содержит до 50 % целлюлозы, а в соломе её 30 %.
Строение крахмала и целлюлозы
Состав этих полисахаридов выражается общей формулой (C6H10O5)n Число повторяющихся звеньев в макромолекуле крахмала может колебаться от нескольких сотен до нескольких тысяч. Целлюлоза же отличается значительно большим числом звеньев и, следовательно, молекулярной массой, которая достигает нескольких миллионов.
Крахмал
1. Физические свойства
Это белый порошок, нерастворимый в холодной воде и образующий коллоидный раствор (крахмальный клейстер) в горячей воде. Существует в двух формах: амилоза – линейный полимер, растворимый в горячей воде, амилопектин – разветвлённый полимер, не растворимый в воде, лишь набухает.
2. Нахождение в природе
Крахмал – основной источник резервной энергии в растительных клетках – образуется в растениях в процессе фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 + 6H2O свет, хлорофилл → C6H12O6 + 6O2
nC6H12O6 → (C6H10O5)n + nH2O
глюкоза крахмал
Содержится в клубнях картофеля, зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал), образуется в печени и мышцах животных.
3. Строение
Состоит из остатков α - глюкозы.
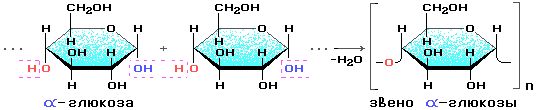
В состав крахмала входят:
· амилоза (внутренняя часть крахмального зерна) – 10-20%
· амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.

Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1 - 6 млн.
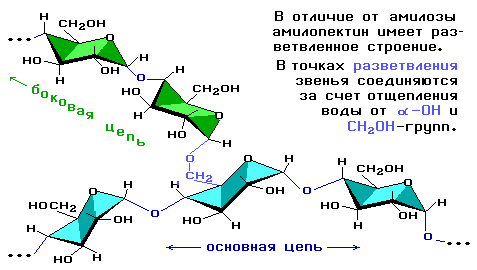
Амилоза и амилопектин гидролизуются под действием кислот или ферментов до глюкозы, которая служит непосредственным источником энергии для клеточных реакций, входит в состав крови и тканей, участвует в обменных процессах. Поэтому крахмал – необходимый резервный углевод питания.
Подобно амилопектину построен гликоген (животный крахмал), макромолекулы которого отличаются большей разветвлённостью:

4. Применение
Крахмал широко применяется в различных отраслях промышленности (пищевой, бродильной, фармацевтической, текстильной, бумажной и т.п.).
· Ценный питательный продукт.
· Для накрахмаливания белья.
· В качестве декстринового клея.
5. Химические свойства полисахаридов
Гидролиз:
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
В пищеварительном тракте животных крахмал подвергается сложному ступенчатому гидролизу:
крахмал → декстрины → мальтоза → глюкоза.
Организм человека не приспособлен к перевариванию целлюлозы, так как не имеет ферментов, необходимых для разрыва связей между остатками β-глюкозы в макромолекуле целлюлозы.
Лишь у термитов и жвачных животных (например, коров) в пищеварительной системе живут микроорганизмы, вырабатывающие необходимые для этого ферменты.
Качественная реакция:
Охлаждённый крахмальный клейстер + I2 (раствор) = синее окрашивание, которое исчезает при нагревании.
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев α-глюкозы.
При взаимодействии амилозы с йодом в водном растворе молекулы йода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная проба).
Целлюлоза (клетчатка)
- растительный полисахарид, являющийся самым распространенным органическим веществом.
1. Физические свойства
Это вещество белого цвета, без вкуса и запаха, нерастворимое в воде, имеющее волокнистое строение. Растворяется в аммиачном растворе гидроксида меди (II) – реактиве Швейцера.
2. Нахождение в природе
Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. В большом количестве целлюлоза содержится в тканях древесины (40-55%), в волокнах льна (60-85%) и хлопка (95-98%). Основная составная часть оболочки растительных клеток. Образуется в растениях в процессе фотосинтеза.
Древесина состоит на 50% из целлюлозы, а хлопок и лён, конопля практически чистая целлюлоза.
Хитин (аналог целлюлозы) – основной компонент наружного скелета членистоногих и других беспозвоночных, а также в составе клеточных стенок грибов и бактерий.
3. Строение
Состоит из остатков β – глюкозы
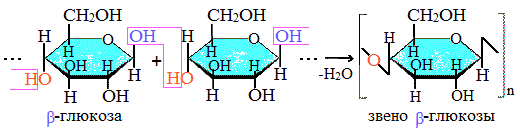
4. Получение
Получают из древесины
5. Применение
Целлюлоза используется в производстве бумаги, искусственных волокон, пленок, пластмасс, лакокрасочных материалов, бездымного пороха, взрывчатки, твердого ракетного топлива, для получения гидролизного спирта и др.
· Получение ацетатного шёлка – искусственное волокно, оргстекла, негорючей плёнки из ацетилцеллюлозы.
· Получение бездымного пороха из триацетилцеллюлозы (пироксилин).
· Получение коллодия (плотная плёнка для медицины) и целлулоида ( изготовление киноленты, игрушек) из диацетилцеллюлозы.
· Изготовление нитей, канатов, бумаги.
· Получение глюкозы, этилового спирта (для получения каучука)
6. Химические свойства
Гидролиз
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал декстрины мальтоза глюкоза
Реакции этерификации
Целлюлоза – многоатомный спирт, на элементную ячейку полимера приходятся три гидроксильных группы. В связи с этим, для целлюлозы характерны реакции этерификации (образование сложных эфиров). Наибольшее практическое значение имеют реакции с азотной кислотой и уксусным ангидридом. Целлюлоза не дает реакции "серебряного зеркала".
2. Образование сложных эфиров. Крахмал может образовывать эфиры за счет гидроксильных групп, однако эти эфиры не нашли практического применения. Другое дело целлюлоза. Целлюлоза может вступать в реакции, характерные для многоатомных спиртов:
а)нитрование взаимодействие с неорганическими кислотами. При обработке целлюлозы смесью азотной и серной кислот получают в зависимости от условий моно-, ди- и тринитроцеллюлозу:
|
||||||||||||||
|
||||||||||||||
|
Полностью этерифицированная клетчатка известна под названием пироксилин, который после соответствующей обработки превращается в бездымный порох. В зависимости от условий нитрования можно получить динитрат целлюлозы, который в технике называется коллоксилином. Он так же используется при изготовлении пороха и твердых ракетных топлив. Кроме того, на основе коллоксилина изготавливают целлулоид.
Б). Взаимодействие с уксусной кислотой:
При действии уксусного ангидрида или уксусной кислоты в присутствии небольшого количества серной кислоты целлюлоза превращается в триацетат целлюлозы.
[C6H7O2 (OH) 3] n + 3n CH3COOH → [C6H7O2 (OCOCH3)3] n + 3n H2O
Образуется смесь моно-, ди- и триацетатов целлюлозы.
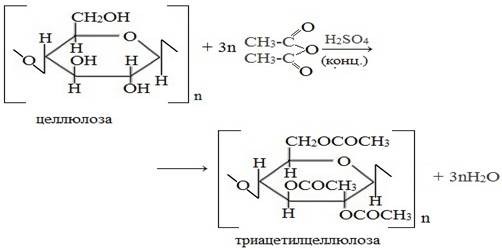
Полученное вещество является представителем широкого спектра текстильных материалов – искусственных волокон.
Мысль о получении искусственных волокон впервые была высказана в ХVII в., но промышленное производство их было осуществлено лишь в конце ХIХ в. Первым видом искусственных волокон целлюлозного происхождения был нитратный шелк, полученный в 1890 г. Несколько позже был найден способ промышленного производства медно-аммиачного волокна, а в 1898 г. получено самое распространенное в настоящее время искусственное волокно - вискозное. К концу первой мировой войны был разработан метод производства ацетатного волокна.
Вискозное волокно
По химическому составу вискозные волокна представляют собой гидратцеллюлозу, отличающуюся от природной целлюлозы меньшей длиной молекулярной цепи (n = 300 - 400) и меньшей степенью ориентации макромолекул в волокне, что и объясняет различие их свойств.
Сырьем для производства вискозного волокна является древесная целлюлоза в виде листов, полученная варкой древесной еловой щепы в растворе бисульфита кальция. Процесс производства вискозного волокна состоит из следующих этапов: подготовка целлюлозы, получение прядильного раствора, формование волокна, отделка вискозного волокна.
Вискозные волокна характеризуются хорошими показателями гигроскопичности, светостойкости, теплостойкости, разрывной нагрузки. Недостатками вискозного волокна являются малая доля упругого удлинения, отчего изделия из этого волокна плохо противостоят смятию; большая потеря прочности при увлажнении волокна, объясняющаяся прониканием молекул воды в межмолекулярные пространства волокон, что приводит к ослаблению поперечных связей молекул, в значительной степени определяющих прочность волокон; недостаточная стойкость к истиранию. Горят вискозные волокна, как хлопок.
Ацетатное волокно
По химическому составу ацетатные волокна представляют собой уксуснокислый эфир целлюлозы. Они отличаются от вискозных тем, что имеют меньшие гигроскопичность, теплостойкость, разрывную нагрузку и стойкость к истиранию, меньше набухают в воде и меньше теряют прочность в мокром состоянии. Вследствие большей упругости ацетатных волокон изделия из них лучше сохраняют форму и более износостойки, чем из вискозных волокон. Сырьем для производства ацетатного волокна служит хлопковая или высококачественная древесная целлюлоза.
Ацетатное волокно окрашивают специальными дисперсными красителями, которыми не могут окраситься вискозные волокна. Это позволяет на изделиях из смеси ацетатных и вискозных волокон получать разнообразные колористические эффекты. Ацетатное волокно окрашивается более глубоко и равномерно, чем вискозное, кроме того, ему можно придать повышенную белизну. Ацетатное волокно в отличие от вискозного характеризуется более высокими теплоизоляционными свойствами, светостойкостью и стойкостью к действию микроорганизмов, пропускает ультрафиолетовые лучи.
Ацетатное волокно горит желтым пламенем, распространяя специфический кисловатый запах и образуя наплыв темного цвета, который после охлаждения легко раздавливается пальцами. Если пламя погасить, то волокно медленно тлеет с выделением струйки дыма.
Триацетилцеллюлоза (или ацетилцеллюлоза) является ценным продуктом для изготовления негорючей кинопленки.
Говоря о применении целлюлозы, нельзя не сказать о том, что большое количество целлюлозы расходуется для изготовления различной бумаги. Бумага – это тонкий слой волокон клетчатки, проклеенный и спрессованный на специальной бумагоделательной машине.
3.Для целлюлозы
Горение
– полное окисление: (C6H10O5)
n + 6nO2 → 6nCO2 + 5nH2O
4. Для целлюлозы
Термич. разложение без доступа воздуха:
(C6H10O5) n → древесный уголь + H2O + летуч. орг. в-ва.
Витамины
Витамины - это низкомолекулярные органические соединения различной химической природы выполняющих важнейшие функции в живых организмах. Современной науке известно более 25 витаминов.
Витамины делятся на жирорастворимые и водорастворимые. Жирорастворимые витамины это А,Д,Е,К. Водорастворимые витамины это В,С.
Авитаминоз - это полное отсутствие какого-либо витамина- заболевание цинга, рахит, бери-бер.
Гиповитаминоз – это частичная недостаточность вызывает недомогание, раздражительность, утомление.
Гипервитаминоз – это избыточное употребление витаминов- спортсмены, бодибилдингом.
Витамины не обладают энергетической ценностью. Единица измерения витаминов -мг%- миллиграмм витамина на 100г. продукта. Потребность человека в витаминах зависит от возраста, состояния, времени года, содержания в них основных компонентов.
Роль витаминов была открыта в 1881 г. русским врачом Николем Ивановичем Луниным (1853-1937). Дело Лунина продолжил польский биохимик Казимир Функ (1884-1967). Кстати, и ныне всем знакомое слово "витамин" придумал Функ - от латинского слова vita - "жизнь".
Жизнь без витаминов невозможна. Их роль в обмене веществ сродни какой-нибудь маленькой гаечке в огромном самосвале: ее и не разглядишь, но если гаечка не на месте, многотонная махина не сдвинется с места. Так же и витамины. Нужно их совсем немного. Витамина В1 нужно не более 30 г за всю жизнь, но горе тому, кто эти граммы не доберет. В чем же здесь секрет?
Оказывается, витамины в микроскопических количествах встраиваются в молекулы ферментов и помогают им обеспечивать обмен веществ в организме. Нет витамина - и обмен веществ останавливается
Витамины обозначаются буквами латинского алфавита. Познакомимся с некоторыми из них:
Витамин А содержится в жире камбалы и палтуса, молоке, масле, куриных яйцах.
Он помогает организму бороться с инфекциями, улучшает зрение, регулирует работу гормональных желез, стимулирует обновление клеток кожи, поддерживает нервную систему и заставляет детские кости расти строго по графику, а зубы быть ровными и белыми. Его недостаток приводит к "куриной слепоте".
Витамин В - комплекс из 15 различных веществ. Важнейшие В1, В6, В9, В12.
Прячутся эти витамины в оболочках и зародышах злаков, отрубях, печени и почках животных, зелени, мясе, яйцах, молоке.
Он помогает нервам передавать импульсы мышцам. Продолжи Функ свой опыт дальше, он довел бы несчастных птичек до болезни "бери-бери", которой раньше страдали жители Китая, питавшиеся лишь очищенным рисом. Признаки болезни - потеря сил, истончение и слабость мышц, боли и спазмы в конечностях.
Витамин С, или аскорбиновая кислота "прославлен" знакомыми каждому с детства сладко-кислыми "аскорбинками". Аскорбиновой кислотой богаты свежие фрукты и овощи: цитрусовые, смородина, клубника, дыня, помидоры, картофель, салат, перец. Он необходим и для роста зубов; и для образования клеток крови и для выработки иммунных антител. Недостаток витамина приводит к цинге - заболеванию, при котором выпадают зубы.
Витамин К содержится в аппетитных овощах и зелени - капусте, шпинате, петрушке стережет наши сосуды, регулируя образование веществ, которые помогают крови сворачиваться, а не вытекать через маленькую ранку.
Витамин Д. Под его личиной прячутся сразу 5 родственников Д1-Д5.
Раньше для пополнения Д3 детям давали рыбий жир. Сейчас жировая ткань морских животных накапливает все то вредное, что сливает в Мировой океан промышленность. В организме человека этот витамин может вырабатываться сам из холестерина в коже под воздействием ультрафиолетовых лучей.
Он отвечает за правильный рост костей. Если его не хватает, у детей возникает рахит.
Витамин Е или токоферол есть в зародышах пшеницы, растительном масле, листьях салата, мясе, печени, молоке, масле, яичном желтке. защищает человека от стрессов, т. е. он оказывает положительное влияние на нервную систему, укрепляет её.
Для правильного роста и развития человек должен получать с пищей необходимое количество витаминов. Для этого нужно знать, что витамины - очень неустойчивые вещества. Так, например, они разрушаются при термической обработке пищи. Поэтому надо соблюдать нормы термической обработки продуктов. Яблоки, собранные осенью, теряют витамины к новому году. Витамины разрушаются от соприкосновения с металлом и т.д.
Существует много витаминов синтезированных искусственным путем. Но специалисты ВОЗ считают, что свежие овощи и фрукты куда полезнее витаминных препаратов, ибо "природный витамин совсем не то же, что таблетка, рожденная в пробирке".
Например, чтобы получить необходимую суточную норму витамина В1 в 1,4 мг, нужно съедать 700-800 г хлеба из муки грубого помола или килограмм нежирного мяса. А сколько хлеба едите вы? Как вы думаете, получаете ли вы необходимое количество витаминов? Значит можно сделать вывод, что мы получаем их с пищей недостаточно.
Ферменты.
Все обменные процессы протекают при участии биологических катализаторов - ферментов.
Термин «фермент» (от лат. fermentum – закваска) был предложен в начале XVII века голландским ученым Ван Гельмондом.
Ферменты – это белковые молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые проходят с большой скоростью при температурах, подходящих для данного организма, то есть в пределах от 5 до 40 градусов. На сегодняшний день известно более двух тысяч ферментов.
По строению ферменты делят на 2 группы:
ферменты-протеины (однокомпонентные, т.е. состоят только из белка).
ферменты-протеиды (двухкомпонентные, состоящие из белка и небелковой части).
Свойства ферментов.
1. Термолабильность - изменчивость фермента под влиянием температуры.
При возрастании температуры активность фермента сначала растет, а затем, выше
определенной температуры, начинает снижаться.
При t= 70° и выше большинство ферментов полностью утрачивают свою активность из-за денатурации белка.
Каждый фермент характеризуется температурным оптимумом. Для ферментов животного происхождения topt = 40-50°, для ферментов растительного происхождения -50-60°, для человека ~ 37°.
При понижении t° ферменты теряют свою активность, но при создании нормальных условий они вновь начинают функционировать.
2. Влияние РН на активность ферментов.
Различные ферменты имеют различное значение РН:
А) амилаза слюны: РН = 7 (нейтральная среда);
Б) пепсин желудочного сока действует в кислой среде (РН=1,5-2,5),
В) трипсин кишечного сока имеет РН = 8-9 (щелочная среда).
Применение ферментов
Многочисленные отрасли пищевой промышленности: виноделие, хлебопечение, сыроварение, производство чая, спирта — основаны на широком применении ферментов.
В фармацевтической промышленности с помощью ферментов получают различные препараты:
витамины, лекарства, антибиотики.
Виды ферментов и их роль
|
Группа |
Катализируемая реакция |
|
Оксидоредуктазы. 480 ферментов, большая роль в энергетических процессах |
Катализирует реакции окисления – восстановления, перенос атомов H и O или электронов от одного к другому. |
|
Трансферазы |
Перенос определенных группы атомов от одного вещества к другому |
|
Гидролазы. 460 ферментов, к ним относятся пищеварительные ферменты, входящие в состав лизосом и других органоидов, где они способствуют распаду более крупных биомолекул на простые |
Реакции гидролиза, при которых из субстрата образуются два продукта. |
|
Лиазы. 230 ферментов, участвующих в регуляциях синтеза и распада промежуточных продуктов обмена |
Ферменты, катализируемые реакции разрыва связей, в субстрате без присоединения воды или окисления. |
|
Изомеразы. 80 ферментов |
Ферменты, катализирующие превращения в пределах одной молекулы, они вызывают внутримолекулярные перестройки. |
|
Лигазы (синтетазы) (около 80 ферментов) |
Катализируемое соединение 2-х молекул с использованием энергии фосфатной связи, сопряжено с распадом АТФ. |
Пищевые добавки
Пищевые добавки - природные, идентичные природным или искусственные вещества, сами по себе не употребляемые как пищевой продукт или обычный компонент пищи. А вводятся в продукт для придания им свойств: вкуса, цвета, запаха; для сохранения пищевой ценности; улучшения условий обработки, хранения, транспортировки.
КЛАССИФИКАЦИЯ
Обычно пищевые добавки разделяют на несколько групп:
1. Вещества, улучшающие внешний вид пищевых продуктов (красители, стабилизаторы окраски, отбеливатели);
2. Вещества, регулирующие вкус продукта (ароматизаторы, вкусовые добавки, подслащивающие вещества, кислоты и регуляторы кислотности);
3. Вещества, регулирующие консистенцию и формирующие текстуру (загустители, гелеобразователи, стабилизаторы, эмульгаторы и др.);
4. Вещества, повышающие сохранность продуктов питания и увеличивающие сроки хранения (консерванты, антиоксиданты и др.).
К пищевым добавкам не относят соединения, повышающие пищевую ценность продуктов питания и причисляемые к группе биологически активных веществ, такие как витамины, микроэлементы, аминокислоты и др.
1. ВЕЩЕСТВА, УЛУЧШАЮЩИЕ ВНЕШНИЙ ВИД ПИЩЕВЫХ ПРОДУКТОВ
Пищевые красители – это категория добавок, которая в международной классификации обозначается кодами от Е100 до Е199 (182). Их основная цель – подкрашивать продукты питания, делая их внешне более привлекательными и аппетитными.
Пищевые красители добавляют в напитки (особенно газированные), мороженное, леденцы, кондитерские изделия, мясные и рыбные продукты, соусы.
Для окраски пищевых продуктов используют натуральные (природные) или синтетические (органические и неорганические) красители.
Природные: кармин – красный краситель. Получают из кошенели насекомых, живущих на кактусах, которые растут в Африке и Южной Америке.
Алканнин – красно-бордового цвета, получают из корней растений.
Каркума – желтый краситель, получают из травянистых ратсений семейства имбирных.
Энокраситель – получают из выжимок красных сортов винограда и ягод бузины. В последнее время начали использовать пигменты чая, столовой свеклы, сок кизила, красной и черной смородины, клюквы, брусники.
Сахарный колер (карамель) – темно-окрашенный продукт карамелизации сахара.
Синтетические: индигокармин – имеет интенсивно синей цвет; татразин желтый и др.
Отбеливающие вещества – диоксид серы; растворы сернистой кислоты и ее соли; нитрат и нитрит калия ; бромат калия.
2.Вещества, регулирующие вкус продукта (ароматизаторы, вкусовые добавки, подслащивающие вещества, кислоты и регуляторы кислотности);
А) подслащивающие в-ва – мед, соки, плоды растений, сахароза, солодовый экстракт, лактоза; сорбит и ксилит (многоатомные спирты). Из синтетических веществ сахарин, цикломаты, аспартам, тауматин (1г на 1т воды).
Б) Ароматизаторы – вещества, усиливающие вкус и аромат продуктов: ванилин, хмель, эфирные масла, эссенции, настои.
Усилителями вкуса и аромата являются производные глутаминовой, гуаниловой, инозиновой кислот, рибонуклеотиды и производные мальтола.
3. Вещества, регулирующие консистенцию и формирующие текстуру (загустители, гелеобразователи, стабилизаторы, эмульгаторы и др.).
Стабилизаторы и загустители используются для сохранения консистенции продуктов, повышения вязкости, сохранения вкуса и цвета пищевых продуктов. Стабилизаторы уничтожают микробы, что обеспечивает сохранение консистенции, вкуса и цвета продуктов питания. Стабилизаторы применяются в производстве мясных продуктов, таких, как колбасы, сосиски и другие полуфабрикаты. А, также, в сухих супах, соусах, варенье, джеме, кондитерских изделиях и сгущенном молоке.
Загустители используются для изменения консистенции и текстуры продуктов питания. Чаще всего используются в таких отраслях пищевой промышленности, как молочная и мясоперерабатывающая отрасли, а так же в выпечке и кондитерском производстве. Кроме мясных и молочных продуктов, мороженного, выпечки и различных десертов, пищевые загустители используются в соусах и супах быстрого приготовления.
Эмульгаторы создают и поддерживают однородную смесь из тех продуктов, которые не смешиваются в природе. Пищевые эмульгаторы используются для создания однородной смеси воды и жира или для добавления в пищевой продукт воздуха и образования стабильной пены.
Применяются эмульгаторы, например, в маргарине, майонезе, сливочном масле, различных десертах и соусах. В сухих продуктах (например, в сухом молоке, сливках, супах) эмульгаторы применяются для облегчения разведения этих продуктов в воде. Применение пищевых эмульгаторов в хлебе и выпечке увеличивает объем пищевых изделий и замедляет очерствение.
Стоит обратить внимание на пищевые эмульгаторы Е338 - 341 - они могут вызвать расстройство желудка. Эмульгатор Е477 считается подозрительным.
К ним относят желатин, пектин. альгинат натрия, агар-агар, агароиды, крахмал растительные камеди и слизи
4.Вещества, повышающие сохранность продуктов питания и увеличивающие сроки хранения (консерванты, антиоксиданты и др.).
Консерванты делают возможным длительное хранение пищи. Они убивают бактерии, грибы, бактериофаги и таким образом удлиняют сроки годности пищевых продуктов. Человек не погибает от употребления в пищу консервантов, потому что обладает большой массой и, к тому же, консерванты частично разрушаются в желудке под воздействием соляной кислоты. Консерванты бывают натуральные и синтетические. К натуральным консервантам относятся, например, уксусная и молочная кислота. Натуральные консерванты считаются безопасными.
Используют сернистый газ, сернистую кислоту и ее соли, сорбиновую кислоту, бензойную кислоту и ее соли, муравьиную кислоту и ее соли. Синтетические пищевые консерванты могут вызвать рак, каменно-почечную болезнь, расстройство кишечника, аллергию (дерматит, астму). Некоторые консерванты могут нарушать артериальное давление. Такой распространенный консервант, как Е 211, разрушает печень, нарушает работу нервной системы, а в соединении с витамином С вызывает рак. Также консерванты могут вызывать такие симптомы отравления, как головная боль и тошнота.
В настоящее время, можно с уверенностью сказать, что пищевые консерванты присутствуют почти во всех продуктах. В напитках, кондитерских изделиях, мясных и рыбных продуктах и т.д. Молоко, купленное в магазине, благодаря консервантам не скисает, а гниет. Даже фрукты не избежали этой участи - например, цитрусовые (лимоны, апельсины и т.д.) обрабатываются дифенилом Е230. Эта пищевая добавка - крайне опасное и ядовитое вещество, которое вызывает рвоту, если его случайно вдохнуть. Попадая в организм этот консервант вызывает рак, заболевания почек, печени, сосудов и нервной системы.
Просто информация.
Е100–Е199 – КРАСИТЕЛИ (усиливают и восстанавливают цвет продуктов);
Е200–Е299 – КОНСЕРВАНТЫ (удлиняют срок годности продукта);
Е300 – Е399 – АНТИОКИСЛИТЕЛИ (замедляют окисление, предохраняя продукты от порчи);
Е400–Е499 – СТАБИЛИЗАТОРЫ (сохраняют заданную консистенцию продуктов);
Е500–Е599 – ЭМУЛЬГАТОРЫ (поддерживают определённую структуру продуктов питания);
Е600–Е599 – УСИЛИТЕЛИ ВКУСА И АРОМАТА
Далеко не все эти добавки безвредны для человека! В России запрещены следующие добавки (некоторые из которых Европа, между прочим, вовсю употребляет): Е121, Е123 - красители, Е240 - консервант, Е924, Е924а - улучшители муки и хлеба. С 2005 года к ним добавились консерванты Е216 и Е217.
Такие авторитетные органы, как Госсанэпиднадзор и Общество защиты прав потребителей, не рекомендуют употреблять продукты питания, содержащие добавки с маркировками:
Е131, Е141, Е215 – Е218, Е230 – Е232, Е239 не рекомендуются аллергикам;
Е121, Е123, Е216, Е217, Е924 способны вызывать желудочно-кишечные расстройства, а в больших дозах – и пищевые отравления;
Е211, Е240, Е442 содержат канцерогены, то есть могут провоцировать образование опухолей.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.