
федеральное государственное бюджетное образовательное учреждение высшего образования
«Мичуринский государственный аграрный университет»
Центр-колледж прикладных квалификаций
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ РАБОТ
по дисциплине
ЕН.03 ХИМИЯ
программы подготовки специалистов среднего звена (ППССЗ)
по специальности 19.02.05 Технология бродильных производств и виноделие
Базовая подготовка
Преподаватель: Филиппова Татьяна Ивановна
Рассмотрен на заседании ЦМК технических специальностей
Протокол № 1 от «31» августа 2021 г.
Председатель ЦМК________/ В.В.Кусова/
Мичуринск, 2021
Методические указания по выполнению практических работ по дисциплине ЕН.03 Химия разработаны на основе рабочей программы учебной дисциплины ЕН.03 Химия, Федерального государственного образовательного стандарта (далее – ФГОС) по специальности 19.02.05 Технология бродильных производств и виноделие, утверждённого приказом Министерства образования и науки Российской Федерации от 22 апреля 2014 года № 375 ,рабочей программы дисциплины
Содержание
Введение……………………………………………………………………........4
Перечень практических работ:
Практическое занятие №1. Углеводороды. Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре JUPAC. Решение расчетных задач ……………………………………………..5
Практическое занятие №2. Производные углеводородов. Решение расчетных задач по теме. Выполнение упражнений по закреплению знаний химических свойств……………….……………………………..…………………………..11
Практическое занятие №3. Биоорганические соединения. Выполнение упражнений по закреплению знаний химических свойств углеводов……….…………………………...........................................................15
Практическое занятие №4. Основы химической термодинамики. Вычисление тепловых эффектов химических реакций……………………..17
Практическое занятие №5 Строение мицелия гидрозоля. Составление формул и схем мицелл… ……………………………………………………20
Практическое занятие №6. Теоретические основы аналитической химии. Решение расчетных задач. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. ...…………………25
Литература………………………………………………………………………30
Приложение …………………………………………………………………….31
Введение
Химия является общепрофессиональной дисциплиной, устанавливающей базовые знания для освоения специальных дисциплин. Состоит из трех разделов: органическая химия, физическая и коллоидная химия; аналитическая химия. Для закрепления обучающимися теоретических знаний и приобретения необходимых умений и навыков программой учебной дисциплины предусмотрено проведение практических работ.
Практические занятия направлены на повторение, закрепление, обобщение, систематизацию и совершенствование знания, подтверждение теоретических положений и формирование учебных, профессиональных практических умений обучающихся и составляют важную часть их профессиональной подготовки.
Методические рекомендации практических занятий способствуют интеграции мыслительной и практической деятельности обучающихся, развитию коммуникативных способностей, профессиональной самостоятельности и мобильности. Данные методические рекомендации позволяют обучающимся оптимально организовать самостоятельную работу, проводить расчеты по химическим формулам и уравнениям реакции; тепловой эффект химических реакций, термохимические уравнения; - окислительно-восстановительные реакции,
В каждой работе даны контрольные вопросы для проверки приобретенных навыков. В конце рекомендаций приведены справочные материалы, литература.
Практическое занятие №1
Тема: Углеводороды. Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре JUPAC. Решение расчетных задач.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме углеводороды (по алканам, алкенам, алкинам, аренам).
Ход работы.
I. Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре JUPAC.
1. Контрольные вопросы.
1. Какие вещества называются углеводородами?
2. На какие типы подразделяются углеводороды?
3. Какие углеводороды называются предельными (алканами)? Приведите примеры.
4. Какие углеводороды называются непредельными?
5. Какие углеводороды называются алкенами? Приведите примеры.
6. Какие углеводороды называются алкинами? Приведите примеры.
7. Какие углеводороды называются диенами? Приведите примеры.
8. Что такое ароматические углеводороды? Приведите примеры.
9. Какую структурную формулу бензола предложил Кекуле? Что не могла объяснить эта формула?
10. Что такое гомологический ряд, гомологическая разность, гомологи?
11. Что такое изомеры?
12. Какие заместители являются орто- и пара-ориентирами? Приведите примеры.
13. Какие заместители являются мета-ориентирами? Приведите примеры.
2.Вспомним номенклатуру и составление формул структурных изомеров.
При изучении номенклатуры необходимо пользоваться алгоритмом составления названия органических соединений, алгоритмом изображения структурной формулы вещества по его названию и алгоритмом составления формул структурных изомеров. Детально знакомимся с правилами номенклатуры ИЮПАК, дополняя и конкретизируя правила по мере изучения последующих классов веществ. Рассматриваем общие положения, например:
«Алгоритм называния веществ ациклического строения».
1. Выбрать самую длинную углеродную цепь.
2. Пронумеровать ее с той стороны, к которой ближе радикалы, или старший заместитель, или кратная связь, или функциональная группа.
3. Указать в префиксе положение (номер атома углерода) и название радикала, заместителя, функциональной группы в алфавитном порядке.
4. Записать корень, соответствующий числу атомов углерода в главной цепи.
5. Если есть двойная связь, то после корня поставить суффикс –ен с указанием положения связи в цепи, для тройной связи использовать суффикс –ин. Если кратных связей нет – суффикс –ан.
6. После этого указать суффикс, соответствующий спирту, альдегиду, кетону или кислоте, если есть соответствующие функциональные группы.
7. Если в веществе несколько одинаковых радикалов, заместителей, связей или функциональных групп, то они называются вместе, с использованием числительных: 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д.
8. При написании названия все цифры отделяются друг от друга запятыми, а от букв – дефисами.
Пример:
СН3
½
НО - СН2- С – СН2 – СН3 СН2=СН-СН2-СН2-СН3
ï пентен-1
СН3
2,2 – диметилбутанол- 1 СН3-СН2-СН3
пропан
Алгоритм изображения структурной формулы вещества по его названию (для алканов)
1. В названии вещества выделить корень. Обвести его значком корня.
2. Изобразить углеродный скелет в соответствии с наименованием корня.
3. Пронумеровать атомы углерода в углеродном скелете (с любой стороны).
4. Проставить символы радикалов у соответствующих атомов углерода.
5. Дополнить свободные валентности атомов углерода символами атомов водорода (учитывая, что углерод четырехвалентен).
Например, построить структурную формулу
2,2-диметил-3-этилгексан. 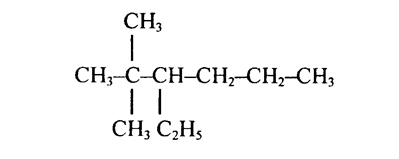
По мере изучения последующих классов веществ мы дополняем и конкретизируем эти правила.
Алгоритм составления формул структурных изомеров:
1. Изобразить структурную формулу вещества в развернутом виде – изомер №1.
2. Уменьшить основную углеродную цепь на один атом углерода.
3. Подставить этот атом углерода ко второму атому в основной цепи. Получится изомер №2.
4. Рассмотреть вариант подстановки этого атома к третьему атому углерода основной цепи (будет ли новый изомер отличаться от изомера №2). Возможно, получится изомер №3.
5. Продолжить подставлять атом углерода к четвертому и т.д. атомам углерода в зависимости от длины основной углеродной цепи.
6. Уменьшить основную цепь еще на один атом углерода. Обратиться к изомеру №2. Подставить второй «свободный» атом углерода к третьему атому углерода основной углеродной цепи.
7. Менять положения двух «свободных» атомов углерода по отношению друг к другу.
8. По возможности (исходя из длины основной углеродной цепи) уменьшить ее длину еще на один атом углерода. Повторить действия, описанные в пп.3-7.
9. Дать названия всем полученным изомерам по современной номенклатуре.
Например:
1. СН3- СН2 – СН2 – СН2 - СН3
н-пентан
2.СН3- СН – СН2 – СН3
ï
СН3
2-метилбутан
3. СН3
½
СН3- С – СН3
ï
СН3
2,2 – диметилпропан
Ароматическими соединениями называют вещества, в молекулах которых содержится особая группировка из шести атомов углерода, называемая бензольным ядром, или бензольным кольцом. Большое значение имеют правила замещения в бензольном кольце. При изучении реакций замещения в бензольном ядре было установлено, что если в бензольном ядре уже содержится какая- либо замещеющая группа, то вторая вводимая вступает в кольцо в совершенно определенное положение в зависимости от характера первого заместителя. Каждый заместитель в бензольном кольце обладает направляющим, ориентирующим действием. Все заместители по характеру своего направляющего действия делятся на две группы:
1.Заместители первого рода направляют последующие вводимые группы в орто- и пара- положение:
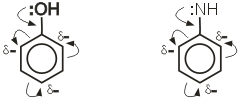
К заместителям первого рода относятся следующие группы:
- NR2 ; - NH2; - ОН; - СН3 и другие радикалы, I; С1 ; Вr.
Для получения орто – и пара – изомеров в бензольное кольцо надо вначале ввести заместитель первого рода.
Например, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и ортоположения:
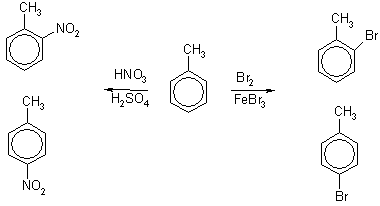
2. Заместители второго рода направляют последующие вводимые группы в мета – положение:
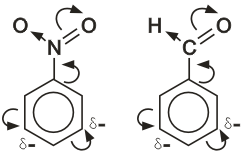
К заместителям второго рода относятся следующие группы: -NO2; -C≡ N; -SО3Н; - СOН, -COOH.
Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение :
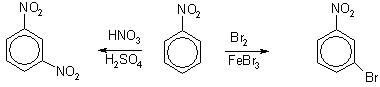
Для получения мета- изомера надо вначале ввести в бензольное ядро заместитель второго рода. Правила замещения в бензольном ядре дают возможность выбрать правильный путь синтеза того или иного нужного вещества. Например, надо решить задачу: в какой последовательности должны быть проведены реакции галогенирования и сульфирования для получения орто – изомера из бензола, ортохлорбензолсульфокислоты. В бензольное ядро надо ввести заместитель первого рода. В данном случае заместителем первого рода является хлор. Значит, сначала бензол надо хлорировать, а затем полученный хлорбензол – сульфировать.
3.Задания для самостоятельного выполнения упражнений.
1. Напишите структурные формулы: а) 2-метилбутан; б) 2,3 – диметилбутан; в) 3-пропилгептана.
2. Напишите структурные формулы: а) 2-метилбутен-2; б) 2,3 – диметилгексен-3; в) 2,2,6-триметил-4-этилгептен-3
3. Напишите структурные формулы: а) бутин-1; б) пентин-2; в) 4,4 диметилпентина-2.
4. Составьте структурные формулы изомеров гексана и назовите их по номенклатуре ИЮПАК.
5. Какие вещества являются изомерами и какие гомологами (допишите атомы водорода в веществах и назовите их):
а) С – С – С - С б) С – С – С – С – С в) С – С – С
ï
С
С
ï
г) С – С – С – С д) С – С – С
ï ï
С С
6. Назовите по номенклатуре ИЮПАК следующие углеводороды и напишите их сокращенную структурную формулу:
а) С – С – С –С = С б) С – С ≡ С –С – С – С
│ | |
С С С- С
7.Построить структурную формулу 2,4,4- триметилпентана и найти в этой формуле первичные, вторичные, третичные и четвертичные атомы углерода.
8.В какой последовательности должны быть проведены реакции хлорирования и нитрования для получения из бензола ортонитрохлорбензола?
9.В какой последовательности должны быть проведены реакции бромирования и нитрования для получения из бензола метабромнитробензола?
II.Решение расчетных задач
Массовая доля вещества – отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) =m(Х)/m,
где ω(X)– массовая доля вещества Х,
m(X) – масса вещества Х,
m – масса всей системы.
Массовая доля – безразмерная величина. Её выражают в долях от единицы или в процентах.
Зная относительную плотность исходного вещества по водороду, воздуху найдем молярную массу вещества:
M = 2 х D(H2)
M = 29 х Dвозд
Вывод формул соединений
Задача №1
Найти эмпирическую формулу оксида марганца MnхOу, содержащего 63,2% марганца.
Дано:
ω(Mn) =63,2%
Найти: формулу MnхOу
Решение.
Атомные массы марганца и кислорода равны соответственно 55 и 16. Поэтому массы марганца и кислорода в составе оксида относятся как 55х : 16у. Массовая доля марганца равна 63,2%, тогда массовая доля кислорода равна:
100% - 63,2% = 36,8%
Следовательно: 55х : 16у = 63,2 : 36,8,
Откуда х : у = ![]() :
: ![]() = 1,15 : 2,3
= 1,15 : 2,3
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них:
х : у = ![]() :
: ![]() = 1 : 2
= 1 : 2
Таким образом эмпирическая (простейшая) формула оксида марганца: MnO2.
Ответ: MnO2
Задача №2
Найти молекулярную формулу газообразного вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Дано:
ω(С) =93,75%;
ω(Н) =6,25%;
Найти:
СхН у
Решение:
х : у = ![]() :
: ![]() = 7,81 : 6,25 = 1,25 :
1 = 5 : 4
= 7,81 : 6,25 = 1,25 :
1 = 5 : 4
Эмпирическая формула С5Н 4
М ( С5Н 4)= 12*5 + 1*4 = 64
Определяем истинную молекулярную массу вещества, исходя из его плотности
по воздуху:
М ( С5Н 4)= 29 х Dвозд = 29 *4,41 = 128
Таким образом, истинная молекулярная масса в два раза больше по его эмпирической формуле. Следовательно, молекулярная формула вещества: С10Н 8
Ответ: С10Н 8
Задачи для самостоятельного решения.
1. Массовые доли элементов в соединении составляют С – 82,8%, Н – 17,2%. Относительная плотность паров этого вещества по водороду равна 29. Определите формулу этого соединения.
2. Рассчитать массовые доли С в соединениях: а) С2Н2; б) пропилене.
Литература. Нечаев А.П. Органическая химия с.25-86.
Практическое занятие №2
Тема: Производные углеводородов. Решение расчетных задач по теме. Выполнение упражнений по закреплению знаний химических свойств.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме производные углеводородов (по спиртам, альдегидам и кетонам, карбоновым кислотам, аминокислотам).
Ход работы.
Спирты (алкоголи) – это производные углеводородов, в которых один или несколько атом водорода замещены на гидроксильную группу – ОН.
Общая формула одноатомных предельных спиртов СпН2п +1ОН. Функциональной группой спиртов является гидроксильная группа - ОН и она определяет их важнейшие свойства. Введением этой группы обуславливается большая химическая активность спиртов.
Основные принципы названия спиртов по международной номенклатуре:
Название спирта = название УВ +(префикс) + ол + (n1,n2,n3….nn), где префикс обозначает число гидроксильных групп в молекуле – ди, три, тетра, - указывает положение гидроксильных групп в главной углеродной цепи. Например:
СН3 – СН – СН2 –СН - СН2- СН3
│ │
ОН ОН
гександиол-2,4
Альдегиды и кетоны.
Альдегиды – органические соединения, молекулы которых содержат карбонильную группу >С=О, соединенную с углеводородным радикалом и водородом.
O
//
Общая формула альдегидов R-C –Н (R –СОН). Название альдегидов по международной номенклатуре образуется от названия соответствующего алкана с добавлением окончания – аль. Нумерацию углеродной цепи начинают от карбонильной группы (альдегидной группы -–СОН).
У кетонов карбонильная группа связана с двумя радикалами R –СО- R1. В названии окончание –он. Нумерацию начинают с того атома углерода, к которому ближе располагается карбонильная группа
Карбоновые кислоты – производные УВ, содержащие функциональную карбоксильную группу - СООН.
Общая формула предельных одноосновных кислот: CnH2n+1COOH или R – СООН, или Сn Н2nО2
Изомерия одноосновных предельных карбоновых кислот начинается с масляной кислоты; она обусловлена различным строением углеводородного радикала. По международной номенклатуре к названию соответствующего углеводорода добавляется окончание овая, нумерацию углеродной цепи начинают с атома углерода карбоксильной группы.
Водород в карбоксильной группе отличается большой подвижностью, поэтому карбоновые кислоты диссоциируют на катион водорода и анион кислотного остатка:
R - СООН ↔R СОО- + Н+
Анион остатка уксусной кислоты СН3СОО- называется ацетат-ион; муравьиной кислоты НСОО- – формиат-ион.
Сложные эфиры – это вещества, которые образуются в результате взаимодействия органических кислот со спиртами (реакция этерификация).
СН3 - СОО - С2Н5 - этилацетат, или этиловый эфир уксусной кислоты;
С2Н5- СОО - СН3 - метилпропинат, или метиловый эфир пропионовой кислоты.
Оксикислоты - соединения со смешенными функциями. Они содержат одновременно гидроксильные и карбоксильные группы т.е обладают и свойствами карбоновых кислот, и свойствами спиртов.
Аминокислоты – это производные УВ, содержащие аминогруппу -NH2 и карбоксильную группу–СООН. Общая формула( NH2) n R( СООН) m. Являются амфотерными соединениями, обладают одновременно основными и кислотными свойствами.
I. Решение расчетных задач по теме.
Задачи на выход продукта
Схемы расчетов по химическим уравнениям основываются на законе сохранения массы веществ и справедливы, если в реакцию вступают абсолютно чистые вещества и их взаимодействие протекает без потерь. Однако на практике продуктов реакции всегда образуется меньше, чем должно было получиться в соответствии с расчетами. Поэтому одна из важнейших характеристик химико-технологического процесса - практический выход продукта реакции т.е. η = [mp(X) •100]/m(X) (4)
Где η– выход продукта, %;
mp(X) - масса продукта Х, полученного в реальном процессе;
m(X) – рассчитанная масса вещества Х.
В тех задачах, где выход продукта не указан, предполагается, что он – количественный (теоретический), т.е. η=100%.
Задача №1.При пропускании сероводорода объемом 2,8 л (нормальные условия) через избыток раствора сульфата меди (II) образовался осадок массой 11,4 г. Определите выход продукта реакции.
Дано: V(H2S)=2,8 л;
m(осадка)= 11,4 г; н.у.
Найти:
η =?
Решение:
Записываем уравнение реакции взаимодействия сероводорода и сульфата меди (II).
H2S + CuSO4 = CuS ↓+ H2SO4
Определяем количество вещества сероводорода, участвующего в реакции:
ν(H2S) = V(H2S) / Vm = 2,8/22,4 = 0,125 моль.
Из уравнения реакции следует, что ν(H2S) = ν(СuS) = 0,125 моль.
Значит можно найти теоретическую массу СuS.
m(СuS) = ν(СuS) • М(СuS) = 0,125 • 96 = 12 г.
Теперь определяем выход продукта, пользуясь формулой (4):
η = [mp(X) •100]/m(X)= 11,4 • 100/ 12 = 95%.
Ответ: η = 95%
Задача №2. В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Решение.
3C2H2 (650 оС, активированный уголь) = C6H6
ν (C2H2) = V(C2H2)/ VM = 120 л : 22,4 л/моль = 5,35 моль
ν (C6H6)теор = 1/3 х ν(C2H2) = 1/3 х 5,35 моль = 1,785 моль
ν (C6H6)практ = m(C6H6)/ M(C6H6) = 60 г : 78 г/моль = 0,77 моль
h = (nпракт : nтеор) х 100% = (0,77 : 1,785) х 100% = 43%
Ответ. 43%.
Задача №3. Рассчитайте количество вещества формальдегида, который содержится в растворе объемом 3 л ( ρ= 1,06г/мл), массовая доля СН2О в котором равна 20%. (Ответ: 21,2 моль)
Дано: V(CH2O)=3, л;
W(CH2O) = 20%
ρ= 1,06г/мл
Найти:
n(CH2O) =?
Решение
m р-ра (CH2O) = Vр-ра(CH2O) *ρр-ра(CH2O) = 3000 мл*1,06г/мл = 3180г
m (CH2O) = m р-ра (CH2O)*W(CH2O) = 3180г * 0,2 = 636 г
n(CH2O)
= ![]() = 21,2 моль
= 21,2 моль
Ответ: n(CH2O) = 21,2 моль
Задача №4. Рассчитайте массу пропилата натрия, который образуется при взаимодействии пропанола-1 массой 30г с натрием массой 9,2 г. (ответ 32,8г)
Дано:
m (C3H7OH) = 30г
m (Na) = 9,2 г
Найти:
m (C3H7O Na ) ?
Решение.
2СН3-СН2-СН2ОН + 2 Na → 2СН3-СН2-СН2О Na + Н2
Выясним, какое вещество взято в избытке, рассчитав химические количества:
n(C3H7OH) = ![]() = 0,5 моль
= 0,5 моль
n(Na) = ![]() =
= ![]() = 0,4 моль
= 0,4 моль
По уравнению видно, что вещества должны взаимодействовать 1:1, а у нас 0,5:0,4. Значит, взят избыток спирта. Расчет ведем по недостатку – натрию Na.
Из 2 моль Na получается 2 моль C3H7ONa (по уравнению)
Из 0,4 моль Na получается х моль C3H7ONa (по уравнению)
Отсюда: х= 0,4моль
m (C3H7O Na ) = n(C3H7O Na )* М(C3H7O Na) = 0,4моль *82 г/моль = 32,8г
М(C3H7O Na) = 82г/моль
Ответ: m (C3H7O Na ) = 32,8г
Задача №5. Рассчитайте массу кислоты и массу спирта, которые необходимы для получения уксуснометилового эфира массой 29,6г, если массовая доля его выхода составляет 80%. (Ответ: 30г кислоты и 16г спирта)
Дано:
m (СН3СООCН3) = 29,6г
W = 80%
Найти:
m (СН3ОН ) ?
m (СН3СООН ) ?
Решение.
Н+
СН3ОН + СН3СООН → СН3СООСН3 + Н2О
С учетом выхода:
mтеор (СН3СООCН3) = ![]() =
= ![]() = 37г
= 37г
𝖞теор(СН3СООСН3)
= ![]() =
= ![]() = 0,5моль
= 0,5моль
По уравнению видно, что сколько моль СН3СООСН3 образуется, столько моль СН3ОН и СН3СООН вступает в реакцию (по 0,5 моль).
М(CH3OН) = 32г/моль
М(СН3СООН) = 60г/моль
m (СН3ОН ) = n(CH3OН )* М(CH3OН) = 0,5 моль * 32г/моль = 16г
m (СН3СООН ) = n(СН3СООН)* М(СН3СООН) = 0,5моль * 60г/моль = 30г
m теор(СН3СООСН3
) = ![]() =
= ![]() = 37г
= 37г
Ответ: m (СН3ОН) = 16г
(СН3СООН) = 30г
Задания для самостоятельного решения задач.
1. Сколько мл 40%-ной азотной кислоты (плотность 1,2г/см3) потребуется для получения 11,35г тринитрата глицерина? Ответ 8мл.
1. Какой объем займет муравьиный альдегид ( н.у.), полученный из 100г метилового спирта?
2. Сколько граммов этилового спирта нужно взять для получения 200 г диэтилового эфира, если выход эфира равен 80% от теоретически возможного? Ответ: 310,8г
3. Сколько граммов металлического серебра выделится при реакции «серебреного зеркала», если в нее вступили 200 г ацетальдегида?
4. Какие массы этановой кислоты и этанола потребуются для получения 8,8 г эфира, если выход составляет 90%? (Ответ: 5,4г; 4,14г)
5. Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола?
6. При восстановлении 92,25г нитробензола получили 66г анилина по реакции Зинина. Какой выход (в %) продукта реакции? (Отвт: 94,6%)
II. Выполнение упражнений по закреплению знаний химических свойств
1. Напишите уравнения реакций следующих превращений и назовите продукты реакций:
С2Н6 → С2Н5Сl → С2Н5ОН→ СН3-СОН →СН3СООН→ СН3-СОО-С3Н7
2. Осуществите следующие превращения:
С→ СаС2→ С2Н2 →С2Н4 →С2Н5ОН →С2Н5ОNa
3. Напишите уравнения реакций получения следующих простых эфиров:
а) метилэтилового; б)этилпропилового; в)моноэтилового эфира этиленгликоля
4. Напишите структурные формулы сложных эфиров, образующихся из: а) уксусной кислоты и пропанола-1; б) муравьиной кислоты и этанола. Назовите сложные эфиры.
5. В двух пробирках находятся уксусной альдегид и этиленгликоль. С помощью каких реакций можно определить эти вещества? Напишите уравнения реакций.
6. Составьте уравнения реакций получения сложных эфиров: а)этилформиата; б)пропилпропионата.
7. Напишите уравнения реакций взаимодействия аланина с: а) гидроксидом натрия;
б) хлороводородной кислотой.
8. Напишите уравнение реакции взаимодействия молочной кислоты с:
а) гидроксидом натрия; б) уксусной кислотой; в) этиловым спиртом. Назовите полученные вещества.
9. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН2=СН2 → СН3-СН2-ОН → СН3СОН → СН3СООН → СН2BrСООН → СН2NH2СООН
Литература. Нечаев А.П. Органическая химия с.104-170,198, 207-210.
Практическое занятие №3
Тема: Биоорганические соединения. Выполнение упражнений по закреплению знаний химических свойств углеводов.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме биоорганические соединения (по белкам, жирам углеводам).
Ход работы.
Белки – высокомолекулярные органические соединения, построенные из остатков α-аминокислот, соединенных пептидной связью.
Липиды - это группа органических веществ различной структуры, не растворимых в воде, но растворяющих в органических растворителях. К липидам относят жиры и масла, фосфатиды, воски и стерины.
Наибольшее внимание следует уделить изучению жиров и масел.
Жиры представляют собой смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Изучите структуру природных жиров, являющихся смесью различных глицеридов. В состав жиров входят, в основном, триглицериды, но присутствуют моно- и диглицериды
Углеводы - обширный класс природных соединений, которые играют важную роль в жизни человека, животных и растений. В состав углеводов входят три элемента: водород, углерод и кислород. Состав большинства углеводов можно выразить общей формулой C n (H2О) m т.е. формально являются соединениями углерода и воды.
Углеводы подразделяются на две группы: простые углеводы (или простые сахара) и сложные углеводы (или сложные сахара). В основу классификации углеводов положена реакция гидролиза.
Простыми углеводами (моносахаридами или монозами), называют такие углеводы, которые не способны гидролизоваться. Наиболее распространенными являются глюкоза и фруктоза – С6Н12О6.
Сложные углеводы - это углеводы, молекулы которых состоят из двух или большего числа остатков моносахаридов и способны гидролизоваться с образованием более простых углеводов.
Дисахариды - сложные сахара, каждая молекула которых при гидролизе распадается на две молекулы моносахарида. Наибольшее значение имеет сахароза – свекловичный или тростниковый сахар С12Н22О11.
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
глюкоза фруктоза
Полисахариды – высокомолекулярные несахароподобные углеводы, содержащие от десяти до сотен тысяч остатков моносахаридов (гексоз). Наибольшее значение имеет крахмал и клетчатка (С6Н10О5) n.
(С6Н10О5) n + n Н2О → n С6Н12О6
глюкоза
Выполнение упражнений по закреплению знаний химических свойств углеводов.
1. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
А) углекислый газ → крахмал → глюкоза → этиловый спирт → уксусный альдегид → уксусная кислота → триацетилцеллюлоза;
Б) крахмал → мальтоза → глюкоза → этиловый спирт → уксусноэтиловый эфир → ацетат натрия;
В) целлюлоза→ глюкоза→ этиловый спирт→ бутадиен-1,3 → бутадиеновый каучук;
Г) крахмал → глюкоза → этанол → оксид углерода(IV) → крахмал
2. Напишите уравнения реакций, характеризующих фруктозу как многоатомный спирт.
3. Напишите уравнения реакций, характеризующих глюкозу как альдегид.
4. Напишите уравнения реакций спиртового и молочнокислого брожения глюкозы.
5. Напишите уравнение реакции взаимодействия целлюлозы с тремя молекулами азотной кислоты.
6. Используя формулу Хеуорса, напишите реакцию взаимодействия глюкозы с этанолом. Назовите полученное вещество.
7. Даны: глицерин, сахароза, этанол, глюкоза, этиленгликоль. Какое из этих соединений при нагревании с гидроксидом меди (II) образует осадок красного цвета? Какие из этих соединений при обычной температуре растворяют Сu(ОН)2 с образованием сине-фиолетового раствора? Напишите уравнения реакции.
Литература. Нечаев А.П. Органическая химия с.230-290.
Практическое занятие №4
Тема: Основы химической термодинамики. Вычисление тепловых эффектов химической реакции.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме тепловой эффект химических реакций.
Ход работы.
I. Контрольные вопросы
1. Что изучает термохимия?
2. Какие уравнения называются термохимическими?
3. Чем отличаются химические реакции от термохимических?
4. Какой процесс называется экзотермическим?
5. Какой процесс называется эндотермическим?
6. Что такое тепловой эффект реакции.
7. Как читается закон Гесса?
8. Дайте определение теплоты сгорания и образования?
9. Что называется теплотой сгорания?
10. Какие нужны справочные величины для расчета теплового эффекта реакции?
II. Расчеты по термохимическим уравнениям
Химические уравнения, в которых указывают тепловой эффект реакции, называют термохимическими.
Такие расчеты проводят на основании закона сохранения массы веществ.
Для того чтобы решить такую задачу, можно воспользоваться алгоритмом:
- составить термохимическое уравнение;
- под формулами в уравнении записать количество вещества (массы, объем для газов) одного из исходных веществ или продуктов реакции – согласно условию задачи;
- над формулами в уравнении записать количество вещества (массы, объем для газов) одного из исходных веществ или продуктов реакции – согласно условию задачи, над значением теплового эффекта – х;
- составить пропорцию:
- решить пропорцию, определить количество теплоты, которое выделится или поглотится в процессе реакции;
- записать ответ.
Закон Гесса: тепловой эффект химической реакции при постоянном давлении и объеме не зависит от пути реакции (т.е. от промежуточных стадий), а определяется начальным и конечным состоянием системы (т.е. состоянием исходных веществ и продуктов реакции (газ, жид., тв.)
A Расчет по термохимическому уравнению
Задача №1
|
Термохимическое уравнение реакции разложения известняка: CaCO3 = CaO + CO2 – 157 кДж Сколько теплоты затрачивается на разложение 1кг известняка?
|
|
|
Дано: m(CaCO3)=1кг=1000г Q р = - 157 кдж |
Решение 1) Записываем уравнение химической реакции: CaCO3 = CaO + CO2 – 157 кДж 2) По уравнению химической реакции составляем пропорцию: 1000г х кДж CaCO3 = CaO + CO 2 – 157кДж 100г по ур. р. 100г CaCO3 ----- 157 кДж по у.з. 1000г CaCO3 ----- х кДж 3) Решаем пропорцию:
4) Ответ: Q = 1570 кДж
|
|
Q = ? М(CaCO3) = 100г/моль |
|
|
|
|
Задача №2 С помощью термохимического уравнения
H2S(г) + 3/2O2 = SO2(г) + H2O(ж) + 562,8 кДж oпределите объем сгоревшего сероводорода, если известно, что в результате реакции выделилось 281,4 кДж теплоты.
Решение: проведем расчет по уравнению и определим V(H2S)
хл 281,4 кДж
![]() H2S(г) + 3/2O2 = SO2(г) + H2O(ж) + 562,8 кДж
H2S(г) + 3/2O2 = SO2(г) + H2O(ж) + 562,8 кДж
22,4л
![]() =
= ![]() Х = V(H2S) = 11,2л.
Х = V(H2S) = 11,2л.
Ответ: V(H2S) = 11,2л.
Б. Вычисление теплового эффекта реакции, составление термохимического уравнения
Задача №3
|
При сжигании 18г алюминия в кислороде выделилось 547кДж теплоты. Составьте термохимическое уравнение этой реакции.
|
||
|
Дано: m (Al) =18 г Q = 547 кДж |
Решение 1) Составляем уравнение химической реакции: 4Al + 3O2 = 2Al2O3 + Qр 2) По уравнению химической реакции составляем пропорцию: 18г 547 кДж 4Al + 3O2 = 2Al2O3 + Q 4. 27г по ур.р: 108г Al ---- Х кДж по у.з: 18г Al ---- 547 кДж
|
|
|
Qр = ? |
|
|
|
М(Al) = 27г/моль |
|
|
Х = ![]() = 3282
кДж
= 3282
кДж
Ответ: Qр = 3282 кДж
Термохимическое уравнение: 4Al + 3O2 =2Al2O3 +3282 кДж
В. Вычисление теплового эффекта реакции при стандартных условиях:
Из закона Гесса следует, что тепловой эффект реакции равен разности между теплотами (энтальпиями) образования продуктов реакции и теплотами (энтальпиями) образования исходных веществ.
Δ Н0р = Σ (Δ Н0конеч) – Σ(Δ Н0исход)
При суммировании теплот образования веществ, участвующих в реакции, необходимо учитывать стехиометрические коэффициенты.
Задача №4
Вычислить тепловой эффект реакции при стандартных условиях:
Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г), если теплота образования:
Fe2O3(т) = -821,3 кДж/моль; CO(г) = - 110,5 кДж/моль; CO2(г), = - 393,5 кДж/моль.
Решение.
Fe2O3(т) + 3CO(г) = 2Fe(т) + 3CO2(г)
Δ Н0р = Σ (Δ Н0конеч) – Σ(Δ Н0исход)
Δ Н0р = 2Δ Н0с (Fe) + 3Δ Н0с(CO2) – [ 3Δ Н0с(CO) + 2Δ Н0с (Fe2О3)] =
= 0 + 3(-393,5) – 3(- 110,5) – 2(-821,3) = 788,2 кДж/моль
Ответ: Δ Н0р = 788,2 кДж/моль
Задача №5
Вычислить тепловой эффект реакции получения гидроксида кальция
СаО(т) + Н2О(ж) = Са(ОН)2(т), если теплота образования СаО(т) = 635701,5Дж/моль;
Н2О(ж) = 285835,5Дж/моль; Са(ОН)2(т) = 986823 Дж/моль.
Решение:
Δ Н0р = Σ (Δ Н0конеч) – Σ(Δ Н0исход)
Δ Н0р = 986823 – (635701,5 + 285835,5) = 65286 Дж.
Ответ: Δ Н0р = 65286 Дж.
III. Задания для самостоятельного решения задач.
1. Какое количество энергии необходимо затратить для получения 10литров метана (н.у) согласно термохимическому уравнению:
С + 2Н2→ СН4 + 147кДж
СН4 + 2О2 → СО2 + 2Н2О +893кДж
3. Термохимическое уравнение реакции сгорания ацетилена:
2C2H2 +5O2 = 4CO2 + 2H2O + 2610 кдж
Сколько теплоты выделится, если будет израсходовано:
а) 13г ацетилена;
б) 1,12л ацетилена;
в) 1моль ацетилена.
4. При сжигании 6,5г цинка выделилось 34,8кдж теплоты.
Составьте термохимическое уравнение этой реакции.
5. Путем сжигания серы получили 32г оксида серы(IV), причем выделилась теплота, равная 146,3кдж. Составьте термохимическое уравнение этой реакции.
6. Определить теплоту сгорания этилена, исходя из следующих данных:
QобрС2Н4 = - 62,01 кДж/моль; QобрСО2 = 394 кДж/моль ; QобрН2О = 285 кДж/моль
7. Определите теплоту сгорания спирта С2Н5ОН +3О2 = СО2 + 3Н2О +Q
исходя из следующих данных: Qобр С2Н5ОН = 287,2 кДж/моль;
QобрСО2 = 394 кДж/моль ; QобрН2О = 285 кДж/моль
Литература Лукьянов А.Б. «Физическая и коллоидная химия» с.40-42
Практическое занятие №5
Тема: Строение мицелия гидрозоля. Составление формул и схем мицелл.
Цель занятия: закрепить знания по составлению формул и схем мицелл.
Ход работы.
Гидрозолями называются коллоидно-дисперсные системы твердых частиц в воде. Гидрозоль состоит из твердой дисперсной фазы (мицеллы) и дисперсионной среды (воды), в которой содержатся растворенные электролиты и неэлектролиты. В центре мицеллы находится ядро, состоящее из молекул или атомов нерастворимого вещества, образующего золь. Ядро окружено адсорбционным слоем, прочно удерживаемым ядром, к нему примыкает диффузный слой, слабо связанный с ним.
Рассмотрим строение коллоидной частицы на примере получения гидрозоля бромида серебра методом конденсации
AgNО3+KBr = AgBr↓ + KNО3
Раствор содержит небольшой избыток КВг, который играет роль стабилизатора золя. Для получения золя необходимо, чтобы вещество дисперсной фазы было практически нерастворимо в дисперсионной среде. Скопление частиц нерастворимого бромида серебра будет образовывать ядро мицеллы m(AgBr). На поверхности ядра из дисперсионной среды адсорбируются ионы того или иного знака из вещества, взятого в избытке (КВг) nKBr↔nK+ + nBr-. По правилу Фаянса-Пескова на ядре обычно адсорбируются ионы, входящие в состав ядра. В нашем примере это ионы Вг_. Ядро приобретает отрицательный заряд m(AgBr)* nВг-.
Ионы, адсорбирующиеся на поверхности ядра и обуславливающие величину и знак заряда частицы, называются потенциалопределяющими ионами (Вг~).
Ионы противоположного знака (противоионы) притягиваются к ядру. В нашем примере противоионы К+. Часть противоионов тесно примыкает к ядру (n — х) К+ и прочно удерживается возле него, образуя неподвижный адсорбционный слой.
Ядро с адсорбционным слоем называют гранулой. Гранула имеет заряд, знак которого определяется потепцналоиределяющими ионами. Остальные противоионы располагаются в жидкости вблизи гранулы и удерживаются слабо, создавая диффузный (подвижный) слой.
Гранула и диффузный слой образуют мицеллу, формулу которой можно записать следующим образом:
![]()
![]() [m (AgBr) *n* Вг-( n - х) К +]-
* x*k+
[m (AgBr) *n* Вг-( n - х) К +]-
* x*k+
![]()
![]()
![]() ядро |
адсорбционный
ядро |
адсорбционный
слой
![]()
![]()
![]()
![]() гранула
гранула
![]()
![]() мицелла
мицелла
Основной фактор устойчивости золей — заряд (электростатическое отталкивание частиц). Это происходит следующим образом. На поверхности ядра коллоидной частицы образуется двойной электрический слой, состоящий из адсорбционного слоя, прилегающего непосредственно к поверхности ядра и прочно связанного с ним, и диффузного слоя, расположенного в слое жидкости, прилегающей к частице. На границе раздела фаз возникают два потенциала:
1) φ (фи) термодинамический потенциал, который определяется разностью потенциалов, создаваемых поверхностями потенциалопределяющих ионов (—) и суммарным зарядом всех протнвоионов ( + );
2) g (дзета) электрокинетический потенциал, который возникает на границе скольжения частицы (гранулы) и ионов диффузного слоя
{ m(AgBr)*n • Br- I (n — х) К+ } хК+.
Коагуляцией называется процесс слипания коллоидных частиц под действием межмолекулярных сил притяжения и образование более крупных агрегатов. Коагуляция сопровождается переходом части или всей дисперсной фазы в осадок Золь устойчив до тех пор, пока существует двойной электрический слой. Поэтому, если нужно вызвать коагуляцию, различными способами разрушают двойной электрический слой: нагревание, механическое воздействие, длительный диализ, радиация, ультразвук, освещение и т. п. Один из самых эффективных способов коагуляции — добавление электролита, который имеет заряд иона, противоположный заряду гранулы.
В приведенном выше примере образования золя AgNО3 гранула имеет отрицательный заряд. Нейтрализовать его могут положительно заряженные ионы. Например, при добавлении к золю раствора AgNО3 или большого избытка КВг ионы Ag+ или К+ будут понижать заряд гранулы и при некоторой концентрации ионов Ag+- заряд гранулы станет равным нулю. Такое состояние золя называется изоэлектрическим. Мицелла золя в изоэлектрическом состоянии имеет формулу
(m(AgBr) *nBr-*nK+ }°
Ядра, лишенные диффузного слоя, и потерявшие свой заряд, слипаются и выпадают в виде осадка, который называется гелем.
Различают две стадии коагуляции:
1) скрытая — слипание частиц началось, но незаметно;
2) явная — выражается в изменении цвета, помутнении раствора, выпадании хлопьев и т. д.
Количество электролита, необходимое для стабилизации золя, строго ограничено. Избыток электролита вызывает коагуляцию. Минимальная концентрация электролита, которая вызывает явную коагуляцию, называется порогом коагуляции. Коагуляцию вызывает не весь электролит, а ион, знак заряда которого противоположен заряду частицы. Чем больше заряд иона, вызвавшего коагуляцию, тем меньше порог коагуляции. По правилу Шульце — Гарди коагулирующее действие оказывают лишь те ионы добавляемого электролита, которые имеют знак заряда, противоположный грануле; действие ионов-коагуляторов во много раз усиливается с повышением их валентности. Процесс, обратный коагуляции, называется пептизацией, когда часть осадка переходит в раствор, образуя золь. Чтобы пептизация произошла, надо вернуть коллоидным частицам заряды. Это можно сделать добавлением электролита — пептизатора. Коллоидные частицы могут избирательно адсорбировать потепциалопределяющие ноны электролита, образуя двойной электрический слой. Между частицами возникают силы отталкивания, частицы отрываются друг от друга, осадок (гель) превращается в золь. Пептизации могут подвергаться только свежеприготовленные рыхлые осадки. Старые осадки трудно поддаются пептизации.
Под агрегативной устойчивостью коллоидных систем понимают способность частиц дисперсной фазы оказывать сопротивление их слипанию (противостоять укрупнению) и тем самым удерживать определенную степень дисперсности. Агрегативная устойчивость объясняется влиянием стабилизатора. Агрегативно устойчивая система состоит из фазы, среды и стабилизатора
Пример. Составить формулу мицеллы сульфата бария, полученного при взаимодействии хлорида бария с избытком серной кислоты.
Решение
Пишем уравнение реакции
BaCl2+H2SО4= BaSО4↓ + 2HCl
Ядро m(BaSО4) выпадает в осадок. Стабилизатор золя H2SО4 взят в избытке.
Потенцналопределяющие ионы — SО42-, (общие в осадке и веществе, взятом в избытке), противоион — Н+.
Формула мицеллы сульфата бария примет вид
![]() [m (BaSО4 • nSО42-
* 2 (n — х)Н+]2-*
2хН+
[m (BaSО4 • nSО42-
* 2 (n — х)Н+]2-*
2хН+
![]()
![]() Ядро | адсорбционный
| диффузный слой
Ядро | адсорбционный
| диффузный слой
![]() слой
слой
![]()
![]() гранула
гранула
![]()
![]() мицелла
мицелла
Задания для самостоятельного выполнения
1.Составить формулу и схему мицеллы гидрофобного золя иодида серебра, полученного при взаимодействии иодида калия с избытком нитрата серебра. Указать знак заряда коллоидной частицы.
2.Составить формулу и схему мицеллы золя сульфата бария, стабилизированного сульфатом натрия.
Строение коллоидных мицелл
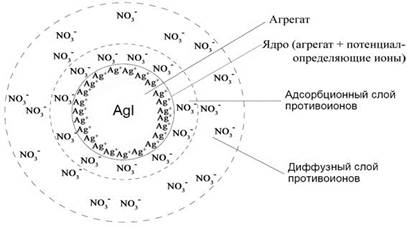
Коллоидные системы состоят из дисперсной фазы и дисперсионной среды. Частицу дисперсной фазы вместе с двойным электрическим слоем называют мицеллой. Мицелла – сложное структурное образование, состоящее из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Как правило, агрегат состоит из большого числа молекул или атомов кристаллического или аморфного строения. Агрегат электронейтрален, но обладает большой адсорбционной способностью и способен адсорбировать на своей поверхности ионы из раствора – потенциалопределяющие ионы (ПОИ).
При выборе потенциалопределяющих ионов пользуются эмпирическим правилом Фаянса-Панета-Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
- входят в состав агрегата;
- способны достраивать кристаллическую решетку агрегата;
- образуют малорастворимое соединение с ионами агрегата;
- изоморфны с ионами агрегата.»
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, обладающее большим зарядом, притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует плотную оболочку, часть двойного электрического слоя (адсорбционный слой).
Ядро с противоионами плотной части двойного электрического слоя образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов
Коллоидную частицу (гранулу) окружают противоионы
диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Схема строения мицеллы золя иодида серебра
Вопросы для самопроверки
1.Что такое мицелла?
2.Что такое агрегат?
3.Какие ионы называются потенциалопределяющими и противоионами?
4.Какой слой ионов называют адсорбционным и какой — диффузным?
Практическое занятие №6
Тема: Теоретические основы аналитической химии. Решение расчетных задач. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Вычисление величины произведения растворимости в и растворимости для бинарных соединений.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме теоретические основы аналитической химии .
Ход работы.
I. Решение расчетных задач по теме «Ионное произведение воды»
Контрольные вопросы.
1. Что называется ионным произведением воды?
2. Какова концентрация ионов водорода в нейтральной, щелочной и кислой средах?
3. Что такое водородный показатель? Для каких целей он служит?
Ионное произведение воды.
Произведение концентраций ионов водорода и гидроксид-ионов в воде называют ионным произведением воды.
Кв = [H+]*[OH-] = 10-14
[H+]*[OH-] = 10-14
Отсюда, зная концентрацию одного из ионов, можно вычислить концентрацию другого иона в растворе:
[H+]
= ![]() [OH-]
=
[OH-]
= ![]()
Для измерения концентрации ионов водорода введена особая единица, называемая водородным показателем.
Водородный показатель – это отрицательный десятичный логарифм концентрации ионов водорода и обозначается pH:
pH= -lg[H+].
В нейтральной среде pH=7; в кислой - pH < 7, в щелочной - pH > 7.
Во всяком водном растворе pH + pOH = 14.
Задача №1. Вычислить pH раствора, в котором концентрация ионов [H+] равна 0, 01 моль/л. Указать среду.
Решение. Число 0, 01 можно представить как 1*10-2,
тогда pH = - lg [H+] = - lg [10-2] = - [-2] = 2.
Так как pH < 7, то среда раствора кислая.
Задача №2. pH = 10. Определить концентрацию ионов водорода.
Решение. pH = - lg [H+]; [H+] = 10-10.
Задача №3. pH раствора равен 2. Что надо добавить к этому раствору (кислоту или щелочь), чтобы довести pH до 10?
Решение. Если pH = 2, то реакция среды кислая. При pH = 10 реакция среды щелочная, поэтому надо к раствору добавить щелочь.
Выполнение упражнений по решению расчетных задач.
1. Чему равен водородный показатель, если [OH-]= 10-6 г-ион/л. Укажите реакцию среды.
2. Водородный показатель равен 4.Чему равна [OH-]?
3. Вычислите рН раствора, в котором концентрация ионов [OH-] равна 0,00001 г-ион/л.
4. Чему равен гидроксидный показатель, если концентрация ионов водорода 0,0000001 г-ион/л?
5. Концентрация ионов водорода 10-2г-ион/л. Чему равен водородный показатель?
II. Вычисление величины произведения растворимости в и растворимости для бинарных соединений
Контрольные вопросы
1. Что называется произведением растворимости? Приведите примеры.
2. Как определить растворимость по произведению растворимости и наоборот?
3. Каковы условия образования и растворения осадков?
4. Как следует назвать раствор СаSO4, если значение его ПР: а)не достигнуто;
б) достигнуто; в) превышено?
Произведение растворимости.
Нужно научиться по произведению растворимости вычислять растворимость вещества, а по растворимости - произведение растворимости.
В расчетах можно использовать следующие математические выражения:
ПР = Р2;
Р = ![]()
где ПР - произведение растворимости малорастворимого электролита;
Р - растворимость этого электролита, моль/л.
Эта формула применима, если растворимость выражена в моль/л, если же
Р г/л
![]() растворимость выражена в
г/л, Рмоль/л =
растворимость выражена в
г/л, Рмоль/л =
М
Задача №1. Растворимость хлорида серебра при 200С равна 1, 25 * 10-5 моль/ л. Вычислить произведение растворимости AgCl.
Дано Решение
РAgCl = 1, 25 * 10-5моль/л Так как для AgCl концентрация ионов
![]() t
= 200С [Ag+]
и [Cl-]
будет численно равна раст-
t
= 200С [Ag+]
и [Cl-]
будет численно равна раст-
воримости AgCl, то [Ag+] = [Cl-] = Р =
ПР - ? = 1, 25 * 10-5 моль/л.
ПРAgCl = [Ag+] * [Cl-] = P2 = (1, 25 * 10-5)2 = 1, 56 * 10-10.
Ответ: ПРAgCl=1,56*10-10
Задача №2. Вычислить растворимость углекислого бария, выраженную в молях/л и в г/л, если произведение растворимости углекислого бария равно 8 * 10-9.
Дано Решение
![]() ПРBaCO3
=
8 * 10-9 1. Вычисляем растворимость BaCO3,
вы-
ПРBaCO3
=
8 * 10-9 1. Вычисляем растворимость BaCO3,
вы-
раженную в моль/л:
![]()
![]() Р BaCO3 - ?
Р BaCO3 - ?
![]() Р = ПР
BaCO3 = 8 * 10-9 = 8,945 * 10-5 моль/л.
Р = ПР
BaCO3 = 8 * 10-9 = 8,945 * 10-5 моль/л.
2.Вычисляем растворимость данного вещества, выраженную в г/л:
М BaCO3 = 197, 35 г/моль;
Рг/л = Рмоль/л * М BaCO3 = 8, 9 * 10-5 * 197, 35 = 1, 76г/л.
Ответ: Р = 8,9*10-5моль/л; Р = 1,76г/л
Выполнение упражнений по решению расчетных задач.
1. Растворимость карбоната кальция СаCO3 равно 0,0069 г/л. Найдите произведение растворимости карбоната кальция.
2. Произведение растворимости сульфата свинца PbSO4 равно 2,2*10-8. Чему равна его растворимость? Растворимость выразить в г/л и моль/л.
3. Приведите математическое выражение произведения растворимости хлорида серебра AgCl, сульфата кальция CaSO4, сульфида меди CuS.
III. Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Контрольные вопросы.
1. Какие реакции называются окислительно – восстановительными?
2. Почему металлы в соединениях проявляют только положительные степени окисления, а неметаллы – как положительные,так и отрицательные?
3. Какие вещества называются окислителями и какие восстановителями?
4. Для каких сложных веществ характерны только окислительные свойства?
5. В каких случаях сложные вещества могут выступать в роли окислителей и восстановителей?
6. Как называется: а)процесс отдачи электронов; б) процесс присоединения электронов?
7. Какое правило лежит в основе метода электронного баланса?
Окислительно-восставновительные реакции
Химические процессы, при которых элементы или ионы, участвующие в реакции, изменяют свою степень окисления, называются реакциями окисления – восстановления.
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит из ионов. Степень окисления может иметь отрицательное, положительное и нулевое значение. При составлении окислительно – восстановительных реакций нужно иметь в виду:
1. Атомы элементов до отдачи или присоединения электронов заряда не имеют ( Н20; Cl20; Fe0; Al0 );
2. При отдаче атомом электронов количество протонов в ядре будет больше количества электронов – атом превращается в положительно заряженный ион. Атом, отдающий электроны, называется восстановителем;
Na0 – ē = Na+ (Na0 – восстановитель)
3. Атом, получивший лишние электроны, будет заряжен отрицательно, т. к. при этом общая сумма электронов, вращающаяся вокруг ядра, будет больше заряда ядра. Атом, присоединяющий электроны, называется окислителем.
Cl0 + ē = Cl- (Cl0 – окислитель)
4. Процесс отдачи атомом, молекулой или ионов электронов, называется окислением, процесс присоединения электронов – восстановлением.
Аl0 – 3ē = Аl3+ - окисление
S0 + 2ē = S2- - восстановление
Оба процесса протекают одновременно – окислитель восстанавливается, а восстановитель окисляется. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Происходит лишь перераспределение электронов.
5. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
Степень окисления атомов в сложных соединениях легко вычислить. Например, степень окисления азота в азотной кислоте (HNO3) равна +5; т. к. степень окисления водорода +1, кислорода –2, то азота Х, тогда +1+Х+(-2*3) = 0; Х = +5
H+1NO3-2 H+1N+5O3-2
При составлении уравнения окислительно – восстановительной реакции методом электронного баланса необходимо соблюдать следующую последовательность действий:
1. Установить состав и формулы взятых и полученных веществ;
2. Определить степень окисления участвующих в реакции элементов в исходных и полученных веществах;
3. Установить, что является окислителем и восстановителем в данной реакции, а также определить количество перемещенных электронов;
4. Подобрать коэффициенты в левой части уравнения на основе правила электронного баланса и в правой части – согласно закону сохранения массы ( баланса атомов ).
Задача №1. Составить уравнение окислительно – восстановительной реакции между хлоридом железа и хлором.
Решение. 1. Записываем схему реакции:
FeCl2 + Cl2 → FeCl3
2. Определяем степень окисления участвующих в реакции элементов:
Fe 2+Cl2 + Cl20 → Fe3+Cl3-
3. Составляем электронные уравнения и определяем окислитель и восстановитель в данной реакции:
![]()
![]() Fe2+
- ē
= Fe3+
2 окисление
Fe2+
- ē
= Fe3+
2 окисление
Cl20 + 2 ē = 2Cl- 1 восстановление
Следовательно, катион Fe2+ - восстановитель; молекула Cl20 – окислитель.
4. Находим коэффициенты при окислителе и восстановителе.
Уравнение принимает вид: 2FeCl2 + Cl2 = 2FeCl3.
Задача № 2. Составить уравнение реакции окисления сульфата железа (II ) перманганатом калия в кислой среде.
Решение. Реакция идет по схеме:
Fe+2SO4 + KMn+7O4 + H2SO4 → Fe+3(SO4)3 + Mn+2SO4 + K2SO4 + H2O.
2. Составляем электронные уравнения:
![]()
![]() Fe+2
- ē →
Fe+3 5
окисление
Fe+2
- ē →
Fe+3 5
окисление
Mn+7 + 5ē → Mn+2 1 восстановление
Следовательно, катион Fe+2 – восстановитель; катион Mn+7 – окислитель.
3. Находим коэффициенты, и уравнение принимает вид:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Выполнение упражнений.
Методом электронного баланса расставьте коэффициенты в уравнениях реакций, укажите окислитель и восстановитель:
а) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
б) PbO2+HCl → PbCl2+Cl2+H2O.
в) HCl+MnO2 → Cl2+MnCl2+H2O.
г) H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O.
Литература Цитович И.К. Курс аналитической химии. с.25-71
Литература
Основные источники:
1.Кудряшева, Н. С. Физическая и коллоидная химия : учебник и практикум для СПО / Н. С. Кудряшева, Л. Г. Бондарева. — 2-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 379 с. Режим доступа: https:// biblio-online.ru/book/72CA68BF-9F1C-405D-9725-2CE497E5EEF8
2. Никитина, Н. Г. Аналитическая химия : учебник и практикум для СПО / Н. Г. Никитина, А. Г. Борисов, Т. И. Хаханина ; под ред. Н. Г. Никитиной. — 4-е изд., перераб. и доп. — [Электронный ресурс] — Электрон. дан. —М. : Издательство Юрайт, 2017. — 394 с. Режим доступа: https:// biblio-online.ru/book/26720D82-A41A-43A0-83E6-2FB7129B060E
3. Хаханина, Т. И. Органическая химия : учебное пособие для СПО / Т. И. Хаханина, Н. Г. Осипенкова. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 396 с. Режим доступа: https:// biblio-online.ru/book/FD017744-5BA8-43EC-A5CC-478A5262A741
Дополнительные источники:
1.Александрова, Э. А. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа : учебник и практикум для СПО / Э. А. Александрова, Н. Г. Гайдукова. — 2-е изд., испр. и доп. ——[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 551 с. Режим доступа: https:// biblio-online.ru/book/AC648233-762B-4860-88AE-AED256523957
2. Александрова, Э. А. Аналитическая химия в 2 книгах. Книга 2. Физико-химические методы анализа : учебник и практикум для СПО / Э. А. Александрова, Н. Г. Гайдукова. — 2-е изд., испр. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 359 с. Режим доступа: https://biblio-online.ru/book/C8AA2771-4B4F-4FE5-8AE5-812C90E34D37
3. Борисов, А. Н. Аналитическая химия. Расчеты в количественном анализе : учебник и практикум для СПО / А. Н. Борисов, И. Ю. Тихомирова. — 2-е изд., испр. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 118 с. Режим доступа: https://biblio-online.ru/book/32E4797E-E52E-4065-B345-A6013C34646E
4.Гавронская, Ю. Ю. Коллоидная химия : учебник и практикум для СПО / Ю. Ю. Гавронская, В. Н. Пак. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 287 с. Режим доступа: https:// biblio-online.ru/book/B19A4FB7-18AD-48F2-8659-97AEE0D7A393
5. Грандберг, И. И. Органическая химия. Практические работы и семинарские занятия : учебное пособие для СПО / И. И. Грандберг, Н. Л. Нам. — 6-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 349 с. Режим доступа: https:// biblio-online.ru/book/2D02E3DD-35E0-4CB2-B6CC-8E05192B3206.
Интернет-ресурсы:
1.ООО «ЭБС ЛАНЬ» (https://e.lanbook.com/) (договор на оказание услугот 10.03.2020 № ЭБСУ 437/20/25(Сетевая электронная библиотека)
2. ООО «ЭБС ЛАНЬ» (https://e.lanbook.com/) (договор на оказание услуг по предоставлению доступа к электронным экземплярам произведений научного, учебного характера, составляющим базу данных «ЭБС ЛАНЬ»от 15.03.2021 № б/н)
3. ООО «Издательство Лань» (https://e.lanbook.com/) (договор на оказание услуг по предоставлению доступа к электронным изданиям ООО «Издательство Лань» от 01.04.2021 № б/н)
4. База данных электронных информационных ресурсов ФГБНУ ЦНСХБ (договор по обеспечению доступа к электронным информационным ресурсам ФГБНУ ЦНСХБ через терминал удаленного доступа (ТУД ФГБНУ ЦНСХБ) от 11.03.2021 № 05-УТ/2021)
5.Электронно-библиотечная система «AgriLib» ФГБОУ ВО РГАЗУ (http://ebs.rgazu.ru/) (дополнительное соглашение на предоставление доступа от 12.03.2021 № 21/22 к Лицензионному договору от 04.07.2013 № 27)
6. Электронные базы данных«Национальный цифровой ресурс «Руконт»: Коллекции «Базовый массив» и «Колос-с. Сельское хозяйство» (https://rucont.ru/) (договор на оказание услуг по предоставлению доступа от 17.03.2021 № 123 21/22)
7. ООО «Электронное издательство ЮРАЙТ» (https://urait.ru/)(договор на оказание услуг по предоставлению доступа к образовательной платформе ООО «Электронное издательство ЮРАЙТ»от 24.03.2021№ 4004/21/22)
8.Электронно-библиотечная система «Вернадский» (https://vernadsky-lib.ru) (договор на безвозмездное использование произведений от 26.03.2020 № 14/20/25)
9.База данных НЭБ «Национальная электронная библиотека» (https://rusneb.ru/) (договоро подключении к НЭБ и предоставлении доступа к объектам НЭБот 01.08.2018 № 101/НЭБ/4712)
10.Библиотечно-информационные и социокультурные услуги пользователям университета из числа инвалидов по зрению, слабовидящих, инвалидов других категорий с ограниченным доступом к информации лиц, имеющих трудности с чтением плоскопечатного текста ТОГБУК «Тамбовская областная универсальная научная библиотека им. А.С. Пушкина» (https://www.tambovlib.ru) (соглашение о сотрудничестве от 15.09.2017 № б/н)
11. Программы АСТ-тестирования для рубежного контроля и промежуточной аттестации обучающихся (договор от 25.09.2019№ Л-103/19)
12.Программная система для обнаружения текстовых заимствований в учебных и научных работах «Антиплагиат ВУЗ» (https://docs.antiplagiaus.ru) (лицензионный договор от 04.03.2021№ 3497)
13. Программные комплексы НИИ мониторинга качества образования: «Федеральный интернет-экзамен в сфере профессионального образования (ФЭПО)» (лицензионный договор от 13.04.2021№ ФЭПО -2021/1/108)
14. Справочная правовая система КонсультантПлюс (договор поставки и сопровождения экземпляров от 28.01.2021 № 10618 /13900/ЭС)
15. Электронный периодический справочник «Система ГАРАНТ» (договор на услуги по сопровождению от 11.02.2021 № 194-01/2021)
16. База данных нормативно-правовых актов информационно-образовательной программы «Росметод» (договор от 20.07.2020 № 1312)
Интернет-ресурсы:
1. Договор от 13.06.2017 № 435/17 на предоставление доступа к электронно-библиотечной системе ООО «Издательство Лань» (https://e.lanbook.com/)
2. Договор от 01.03.2018 № 13 – УТ/2018 по обеспечению доступа к электронным информационным ресурсам ФГБНУ ЦНСХБ
3. Дополнительное соглашение от 12.04.2018 № ПДД 18/19 к Лицензионному договору от 04.07.2013 № 27 на предоставление доступа к электронно-библиотечной системе «AgriLib» ФГБОУ ВО РГАЗУ (http://ebs.rgazu.ru/)
4. Контракт от 20.03.2018 №0702/2222-2018 на оказание услуг попредоставлению доступа к электронным базам данных«Национальный цифровой ресурс «Руконт» Коллекция «Базовый массив» (https://rucont.ru/)
5. Договор от 12.05.2017 № 2949 на оказание услуг по предоставлению доступа к ЭБС «Электронно-библиотечной системе «ЭБС ЮРАЙТ www.biblio-onlaine.ru» (www.biblio-onlaine.ru)
6.Программы АСТ-тестирования для рубежного контроля и промежуточной аттестации обучающихся (договор Л-21/16 от 18.10. 2016)
7.Программные комплексы НИИ мониторинга качества образования: «Федеральный интернет-экзамен в сфере профессионального образования (ФЭПО)» (договор №ИАС -2018/1/0205 от 15 марта 2018 г.)
8.Договор № 9012 /13900/ЭС поставки и сопровождения экземпляров систем Консультант Плюс от 20.02.2018
9.Договор № 194 – 01/2018СД на услуги по сопровождению Электронного периодического справочника «Система ГАРАНТ» от 09.01.2018
Приложения
Приложение 1
Таблица1
Периодическая система Д.И. Менделеева
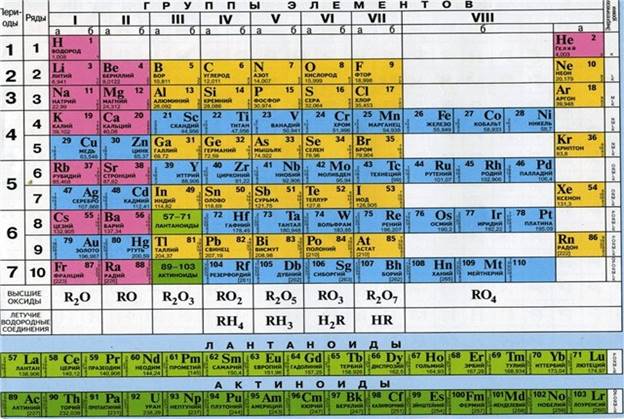
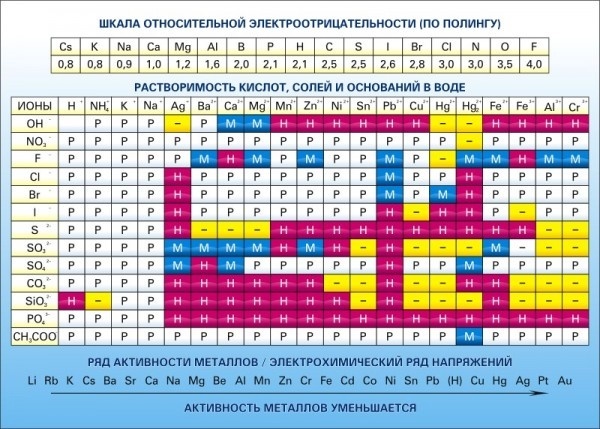
Таблица 2
Таблица растворимости кислот, оснований и солей
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.