
федеральное государственное бюджетное образовательное учреждение высшего образования
«Мичуринский государственный аграрный университет»
Центр-колледж прикладных квалификаций
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ВЫПОЛНЕНИЮ ПРАКТИЧЕСКИХ РАБОТ
по дисциплине
ОУД.10 ХИМИЯ
программы подготовки специалистов среднего звена (ППССЗ)
по специальности 19.02.05 Технология бродильных производств и виноделие
Базовая подготовка
Преподаватель: Филиппова Татьяна Ивановна
Рассмотрен на заседании ЦМК технических специальностей
Протокол № 1 от «31» августа 2020 г.
Председатель ЦМК________/ В.В.Кусова/
Мичуринск, 2020
Методические указания по выполнению практических работ по дисциплине ОУД.10 Химия разработаны на основе рабочей программы учебной дисциплины ОУД.10 Химия, Федерального государственного образовательного стандарта (далее – ФГОС) по специальности 19.02.05 Технология бродильных производств и виноделие, утверждённого приказом Министерства образования и науки Российской Федерации от 22 апреля 2014 года № 375 ,рабочей программы дисциплины
Содержание
Введение…………………………………………………………………….4
Практическое занятие № 1. Решение расчетных задач. Выполнение упражнений на составление структурных формул изомеров, названий по систематической номенклатуре и составление формул, исходя из их названий……………..……………………………………………………………..5
Практическое занятие № 2. Осуществление генетической связи между углеводородами и кислородосодержащими соединениями………….………13
Практическое занятие № 3. Решение расчетных задач по определению состава и количества вещества………………………………………………….15
Практическое занятие № 4. Составление электронных и графических формул атомов, определение степеней окисления…………….…………………………...17
Практическое занятие № 5. Составление уравнений окислительно-восстановительных реакций методом электронного баланса………...…………...20
Практическое занятие № 6. Генетическая связь между классами неорганических соединений…………………………………………………….23
Литература……………………………………………………………………….25 Приложения……………………………………………………………………...277
Введение
Химия является общеобразовательной дисциплиной, формирующей базовые знания, необходимые для усвоения специальных дисциплин. Для закрепления обучающихся теоретических знаний и приобретения необходимых умений и навыков программой учебной дисциплины предусмотрено проведение практических работ.
Практические работы направлены на повторение, закрепление, обобщение, систематизацию и совершенствование знания, подтверждение теоретических положений и формирование учебных, профессиональных практических умений обучающихся и составляют важную часть их профессиональной подготовки.
Методические рекомендации практических работ способствуют интеграции мыслительной и практической деятельности обучающихся, развитию коммуникативных способностей, профессиональной самостоятельности и мобильности. Данные методические рекомендации позволяют обучающимся оптимально организовать самостоятельную работу по выполнению практических работ.
В каждой работе даны контрольные вопросы для проверки приобретенных навыков. В конце рекомендаций приведены справочные материалы, литература.
Практическое занятие №1
Тема: Углеводороды. Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре JUPAC. Решение расчетных задач.
Цель занятия: повторить, закрепить, обобщить, систематизировать и совершенствовать знания по теме углеводороды (по алканам, алкенам, алкинам, аренам).
Ход работы.
II.Решение расчетных задач
Массовая доля вещества – отношение массы данного вещества в системе к массе всей системы, т.е. ω(Х) =m(Х)/m,
где ω(X)– массовая доля вещества Х,
m(X) – масса вещества Х,
m – масса всей системы.
Массовая доля – безразмерная величина. Её выражают в долях от единицы или в процентах.
Зная относительную плотность исходного вещества по водороду, воздуху найдем молярную массу вещества:
M = 2 х D(H2)
M = 29 х Dвозд
Вывод формул соединений
Задача №1
Найти эмпирическую формулу оксида марганца MnхOу, содержащего 63,2% марганца.
Дано:
ω(Mn) =63,2%
Найти: формулу MnхOу
Решение.
Атомные массы марганца и кислорода равны соответственно 55 и 16. Поэтому массы марганца и кислорода в составе оксида относятся как 55х : 16у. Массовая доля марганца равна 63,2%, тогда массовая доля кислорода равна:
100% - 63,2% = 36,8%
Следовательно: 55х : 16у = 63,2 : 36,8,
Откуда х : у =
![]() :
:
![]() =
1,15 : 2,3
=
1,15 : 2,3
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на меньший из них:
х : у = ![]() :
:
![]() =
1 : 2
=
1 : 2
Таким образом эмпирическая (простейшая) формула оксида марганца: MnO2.
Ответ: MnO2
Задача №2
Найти молекулярную формулу газообразного вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Дано:
ω(С) =93,75%;
ω(Н) =6,25%;
Найти:
СхН у
Решение:
х : у = ![]() :
:
![]() =
7,81 : 6,25 = 1,25 : 1 = 5 : 4
=
7,81 : 6,25 = 1,25 : 1 = 5 : 4
Эмпирическая формула С5Н 4
М ( С5Н 4)= 12*5 + 1*4 = 64
Определяем истинную молекулярную массу вещества, исходя из его плотности
по воздуху:
М ( С5Н 4)= 29 х Dвозд = 29 *4,41 = 128
Таким образом, истинная молекулярная масса в два раза больше по его эмпирической формуле. Следовательно, молекулярная формула вещества: С10Н 8
Ответ: С10Н 8
Задачи для самостоятельного решения.
1. Массовые доли элементов в соединении составляют С – 82,8%, Н – 17,2%. Относительная плотность паров этого вещества по водороду равна 29. Определите формулу этого соединения.
2. Рассчитать массовые доли С в соединениях: а) С2Н2; б) пропилене.
I. Выполнение упражнений на составление структурных формул изомеров и названий их по номенклатуре JUPAC.
1. Контрольные вопросы.
1. Какие вещества называются углеводородами?
2. На какие типы подразделяются углеводороды?
3. Какие углеводороды называются предельными (алканами)? Приведите примеры.
4. Какие углеводороды называются непредельными?
5. Какие углеводороды называются алкенами? Приведите примеры.
6. Какие углеводороды называются алкинами? Приведите примеры.
7. Какие углеводороды называются диенами? Приведите примеры.
8. Что такое ароматические углеводороды? Приведите примеры.
9. Какую структурную формулу бензола предложил Кекуле? Что не могла объяснить эта формула?
10. Что такое гомологический ряд, гомологическая разность, гомологи?
11. Что такое изомеры?
12. Какие заместители являются орто- и пара-ориентирами? Приведите примеры.
13. Какие заместители являются мета-ориентирами? Приведите примеры.
2.Вспомним номенклатуру и составление формул структурных изомеров.
При изучении номенклатуры необходимо пользоваться алгоритмом составления названия органических соединений, алгоритмом изображения структурной формулы вещества по его названию и алгоритмом составления формул структурных изомеров. Детально знакомимся с правилами номенклатуры ИЮПАК, дополняя и конкретизируя правила по мере изучения последующих классов веществ. Рассматриваем общие положения, например:
«Алгоритм называния веществ ациклического строения».
1. Выбрать самую длинную углеродную цепь.
2. Пронумеровать ее с той стороны, к которой ближе радикалы, или старший заместитель, или кратная связь, или функциональная группа.
3. Указать в префиксе положение (номер атома углерода) и название радикала, заместителя, функциональной группы в алфавитном порядке.
4. Записать корень, соответствующий числу атомов углерода в главной цепи.
5. Если есть двойная связь, то после корня поставить суффикс –ен с указанием положения связи в цепи, для тройной связи использовать суффикс –ин. Если кратных связей нет – суффикс –ан.
6. После этого указать суффикс, соответствующий спирту, альдегиду, кетону или кислоте, если есть соответствующие функциональные группы.
7. Если в веществе несколько одинаковых радикалов, заместителей, связей или функциональных групп, то они называются вместе, с использованием числительных: 2 – ди, 3 – три, 4 – тетра, 5 – пента и т.д.
8. При написании названия все цифры отделяются друг от друга запятыми, а от букв – дефисами.
Пример:
СН3
½
НО - СН2- С – СН2 – СН3 СН2=СН-СН2-СН2-СН3
ï пентен-1
СН3
2,2 – диметилбутанол- 1 СН3-СН2-СН3
пропан
Алгоритм изображения структурной формулы вещества по его названию (для алканов)
1. В названии вещества выделить корень. Обвести его значком корня.
2. Изобразить углеродный скелет в соответствии с наименованием корня.
3. Пронумеровать атомы углерода в углеродном скелете (с любой стороны).
4. Проставить символы радикалов у соответствующих атомов углерода.
5. Дополнить свободные валентности атомов углерода символами атомов водорода (учитывая, что углерод четырехвалентен).
Например, построить структурную формулу
2,2-диметил-3-этилгексан. 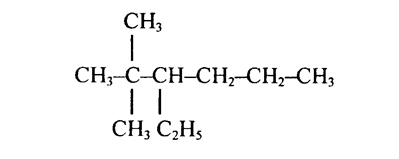
По мере изучения последующих классов веществ мы дополняем и конкретизируем эти правила.
Алгоритм составления формул структурных изомеров:
1. Изобразить структурную формулу вещества в развернутом виде – изомер №1.
2. Уменьшить основную углеродную цепь на один атом углерода.
3. Подставить этот атом углерода ко второму атому в основной цепи. Получится изомер №2.
4. Рассмотреть вариант подстановки этого атома к третьему атому углерода основной цепи (будет ли новый изомер отличаться от изомера №2). Возможно, получится изомер №3.
5. Продолжить подставлять атом углерода к четвертому и т.д. атомам углерода в зависимости от длины основной углеродной цепи.
6. Уменьшить основную цепь еще на один атом углерода. Обратиться к изомеру №2. Подставить второй «свободный» атом углерода к третьему атому углерода основной углеродной цепи.
7. Менять положения двух «свободных» атомов углерода по отношению друг к другу.
8. По возможности (исходя из длины основной углеродной цепи) уменьшить ее длину еще на один атом углерода. Повторить действия, описанные в пп.3-7.
9. Дать названия всем полученным изомерам по современной номенклатуре.
Например:
1. СН3- СН2 – СН2 – СН2 - СН3
н-пентан
2.СН3- СН – СН2 – СН3
ï
СН3
2-метилбутан
3. СН3
½
СН3- С – СН3
ï
СН3
2,2 – диметилпропан
.
3.Задания для самостоятельного выполнения упражнений.
1. Напишите структурные формулы: а) 2-метилбутан; б) 2,3 – диметилбутан; в) 3-пропилгептана.
2. Напишите структурные формулы: а) 2-метилбутен-2; б) 2,3 – диметилгексен-3; в) 2,2,6-триметил-4-этилгептен-3
3. Напишите структурные формулы: а) бутин-1; б) пентин-2; в) 4,4 диметилпентина-2.
4. Составьте структурные формулы изомеров гексана и назовите их по номенклатуре ИЮПАК.
5. Какие вещества являются изомерами и какие гомологами (допишите атомы водорода в веществах и назовите их):
а) С – С – С - С б) С – С – С – С – С в) С – С – С
ï
С
С
ï
г) С – С – С – С д) С – С – С
ï ï
С С
6. Назовите по номенклатуре ИЮПАК следующие углеводороды и напишите их сокращенную структурную формулу:
а) С – С – С –С = С б) С – С ≡ С –С – С – С
│ | |
С С С- С
7.Построить структурную формулу 2,4,4- триметилпентана и найти в этой формуле первичные, вторичные, третичные и четвертичные атомы углерода.
8.В какой последовательности должны быть проведены реакции хлорирования и нитрования для получения из бензола ортонитрохлорбензола?
9.В какой последовательности должны быть проведены реакции бромирования и нитрования для получения из бензола метабромнитробензола?
Алгоритм 2.3. Решение расчетных задач на вывод молекулярной формулы
вещества по массовым долям элементов.
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8%
углерода и 18,2% водорода. Относительная плотность вещества по азоту равна
1,57.
Решение:
1. Записать условие задачи.

2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной
плотности:
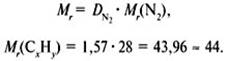
3. Найти индексы х и y по отношению : ![]()
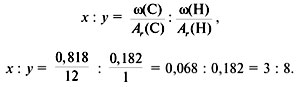
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 –
истинная формула.
Задача 2. Найти молекулярную формулу предельного
углеводорода, массовая доля углерода в котором 83,3%.
Решение:
1. Записать условие задачи.
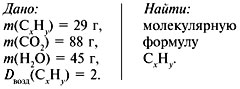
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
![]()
следовательно, простейшая формула – C2H5
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная
формула – С4Н10.
Алгоритм 2.4. Решение расчетных задач на вывод молекулярной формулы
вещества по массе (объему) продуктов сгорания.
Задача 1. При сжигании 29 г углеводорода образовалось 88 г
углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна
2. Найти молекулярную формулу углеводорода.
Решение:
1. Записать условие задачи.
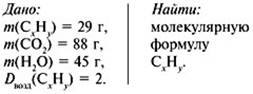
2. Найти относительную
молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
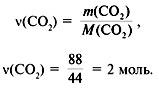
4. Найти количество вещества углерода в сожженном веществе:
n(C) = (CO2) = 2 моль.
5. Найти количество вещества воды:
n(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
n(H) = 2n(H2O),
n(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) : (Н) = 2 : 5, следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58, следовательно, истинная формула – C4H10.
Задача 2. При сжигании 5,6 л (н.у.) газообразного
органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г
воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его
молекулярную формулу.
Решение:
1. Записать условие задачи.
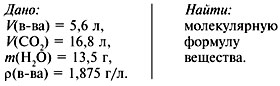
2. Найти молекулярную массу
вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
n(CO2) = 16,8/22,4 = 0,75 моль,
n(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
n(H2O) = 13,5/18 = 0,75 моль,
n(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
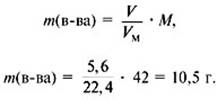
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) : (H) = 0,75 : 1,5 = 1 : 2, следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3, следовательно, истинная формула –
С3Н6.
Контрольные вопросы:
1. Какие углеводороды называют предельными?
2. Строение метана.
3. Физические свойства алканов.
4. Виды изомерии алканов и циклоалканов.
5. Причины инертности алканов.
6. Какие типы химических реакций характерны для алканов, циклоалканов и
галогеналканов?
7. Какова последовательность замещения атомов водорода на галоген в алканах,
содержащих более двух углеродных атомов?
8. Каков механизм реакции замещения?
9. Каковы способы получения алканов, галогеналканов и циклоалканов?
10. Дайте определения следующим понятиям: гомологи, изомеры, заместитель.
Задания:
1. Назвать предельные углеводороды:
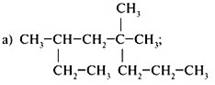
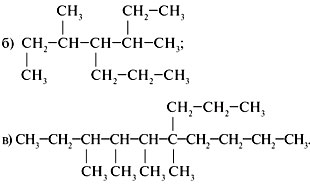
2. Составить структурную формулу
2,4,5,5-тетраметил-3-этилоктана. Указать все первичные, вторичные, третичные и
четвертичные углеродные атомы.
3. Составить структурные формулы
трех углеводородов, содержащих четвертичный углеродный атом, выбирая из первых
семи членов ряда алканов С1–С7. Назвать эти углеводороды.
4. Привести структуры и названия продуктов взаимодействия следующих алканов с
хлором (в мольном соотношении 1:1):
а) пропан;
б) 2,2-диметилбутан;
в) 2,3-диметилбутан.
5. Написать уравнения реакций, которые нужно провести для осуществления
следующих превращений:
CH3COONa CH4 CH3Br C2H6 CO2 CO
CH4 C3H8.
6. Привести уравнения реакций получения и названия дигалогеналканов,
необходимых для получения следующих соединений:
а) 1,2-диметилциклобутан;
б) пропилциклобутан;
в) метилциклопропан.
7. Органическое вещество содержит 84,21% углерода и 15,79% водорода. Плотность
паров вещества по воздуху 3,93. Определить формулу вещества. Ответ. С8Н18.
8. Алкан имеет плотность паров по воздуху 4,414. Определить формулу алкана.
Ответ. С9Н20.
9. При сгорании 3,6 г алкана получили 5,6 л оксида углерода(IV) (н.у.). Какие
объемы кислорода и воздуха затратились на эту реакцию? Ответ. 8,96 л О2 и 42,67
л воздуха.
10. Углеводород содержит 82,76% углерода и 17,24% водорода (по массе). При
монохлорировании этот углеводород образует два изомерных алкилхлорида –
первичный и третичный. Определить строение исходного углеводорода. Ответ.
2-метилпропан.
Литература. Нечаев А.П. Органическая химия с.25-86.
Практическая работа №2
Тема: Осуществление генетической связи между углеводородами и кислородосодержащими соединениями.
Цели: рассмотреть генетическую связь между типами углеводородов и кислородосодержащими соединениями; развивать умения приводить примеры и составлять уравнения химических реакций, раскрывающих генетические связи между веществами различных классов соединений; обобщить и систематизировать знания учащихся об углеводородах и их производных на основе сравнительной характеристики их свойств; формировать навык самообразования обучающихся.
Оборудование:
Периодическая система элементов Д.И.Менделеева.
Теоретические основы
Генетической связью – называется связь между веществами разных классов,
основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ. Что же означает понятие «генетическая связь»
1.Превращение веществ одного класса соединений в вещества других классов.
2.Химические свойства веществ.
3.Возможность получения сложных веществ из простых.
4.Взаимосвязь простых и сложных веществ всех классов веществ.
Понятие генетического ряда веществ, который является частным проявлением генетической связи.
Генетическим называют ряд веществ – представителей разных классов веществ
являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающими общность происхождения этих веществ.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле. Например:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3 – COOH →CH2Cl – COOH →NH2CH2COOH
Этан этен этанол этаналь уксусная кислота хлорэтановая кислота аминоэтановая к-та
алкан алкен алканол алканаль карбоновая кислота хлоркарбоновая кислота аминокислота
1.C2H6 → C2H4 + H2 ; 2.C2H4 + H2O → C2H5 OH
3.C2 H5OH + [O] → CH3CHO + H2O; 4.CH3CHO + [O] → CH3COOH
5.CH3COOH + Cl2 → CH2Cl - COOH; 6.CH2Cl - COOH + NH3 → NH2 CH2 – COOH + HCl
Между гомологическими рядами углеводородов существует генетическая связь, которая обнаруживается в процессе взаимного превращения этих веществ. Для перехода от одной группы веществ к другой используют процессы: дегидрирование, гидрирование, циклообразование и другие. Так можно осуществить большинство переходов, однако, этот способ получения углеводородов не является универсальным. Стрелками в схеме указаны углеводороды, которые непосредственно можно превратить друг в друга одной реакцией.
Схематически это выглядит так:
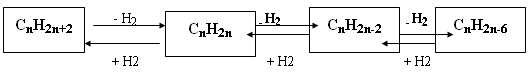
Углеводороды, спирты, альдегиды и карбоновые кислоты генетически связаны между собой. При этом можно проследить постепенное усложнение строения веществ. Перечисленными классами далеко не исчерпывается круг органических соединений. Разнообразные преобразования кислот и других веществ обусловливают появление новых классов и, таким образом, дальнейшее развитие разнообразия органических соединений. Прослеживая связь веществ в направлении их усложнения, можно заметить, что простейшими первичными «кирпичиками» являются углеводороды, от которых можно перейти к галогенопроизводным, спиртам и т.д.
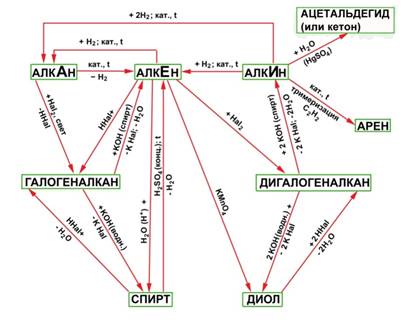
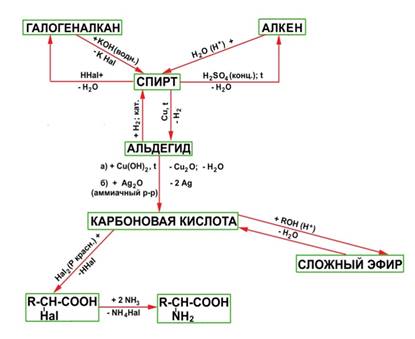
Задания для практической работы:
Напишите уравнения реакций, с помощью которых можно осуществить превращения. Назовите получившиеся вещества. Укажите условия протекания реакций.
Задание № 1. С→ СН4→С2Н6→С2Н4→С2Н2→—>С6Н6→С6Н5СI
Задание № 2.СаСО3 → СаО → СаС2 → С2Н2→ тримеризация, С(акт) Х
Задание № 3.СН4 ![]() С3Н8
С3Н8 ![]() С3Н7Сl
С3Н7Сl ![]() Х
Х ![]() СО2.
СО2.
Задание № 4. Этан→ этен→ этин→бензол.
Задание № 5. С3Н8→С3Н6→С3Н7СI→С6Н14→C6Н12→С6Н6 → С6Н5Вr.
Задание № 6. Ацетилен → → этилен → этанол → уксусный альдегид → уксусная кислота.
Задание № 7. С→ СН4→С2Н2→ C6Н6 → С2Н5Br →С6Н5 ОН
Задание №8. CН4 → C2H2 → СН3-СН=О → СН3-СООН→этиловый эфир уксусной кислоты
↓
C2H5ОН
Задание № 9. CН4 → C2H2 → C2H4→ C2H5ОН → СН3-СН=О → СН3-СООН
Задание № 10. СaC2 → C2H2 → C2H4 → C2H5CI → C2H5ОН → СН3-СН=О→ СН3-СООН
↓
C2H5ОН
Задание № 11. СН4 → СO2 → С6Н12О6 → (С6Н10O5)n
Вопросы для закрепления теоретического материала к практическому занятию:
1.Дайте определения понятий: «генетическая связь», «генетический ряд веществ».
2.В чем выражается генетическая связь между углеводородами?
3. Перечислите названия реакций, которые вы записывали при выполнении заданий.
4.Какая группа веществ лежит в основе большинства генетических цепочек?
Список рекомендуемой литературы:
1.Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей технического профиля, учебник для студ. учреждений сред. проф. образования. — М., 2011.
2. Габриелян О.С., Лысова Г.Г. Химия. Тесты, задачи и упражнения, учеб. пособие для студ. учреждений сред. проф. образования. — М., 2011.
Практическая работа № 3
Решение расчетных задач на вычисление количества вещества
по массе и объему. Число Авогадро.
Цель работы: совершенствование умений производить простейшие
расчеты по формулам, связывающим физические величины: «масса», «молярная
масса», «объём», «молярный объём», «число частиц», «количество вещества»,
«постоянная Авогадро».
Оборудование: Периодическая система химических элементов Д.И.Менделеева, калькулятор.
Теоретическая часть.
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) (ню) или n (эн). связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями: M = ρ▪Vm
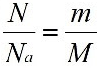
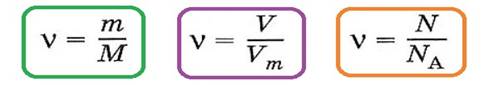 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль,
м3/кмоль) при н.у.,- молярный объем
Na = 6,02 • 1023моль-1 (постоянная
Авогадро),
N – число частиц данного вещества;
ρ – плотность вещества. г/мл
М - молярная масса численно равна относительной молекулярной массе вещества:

1 моль любого вещества содержит 6,02 • 1023 частиц этого вещества. NА = 6,02 • 1023 моль-1.
Например: 1 моль кислорода содержит 6,02 • 1023 молекул O2.
1 моль серной кислоты содержит 6,02 • 1023 молекул H2SO4.
2 моль серы содержит 12,04 • 1023 атомов S.
0,5 моль серы содержит 3,01 • 1023 атомов S.
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины. Например:
ν =![]() , моль М =
, моль М = ![]() ,г/моль m =М* ν, г
,г/моль m =М* ν, г
Образцы решения задач
Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль.
![]() Дано:
Решение:
Дано:
Решение:
ν(Fe)=0,5 моль m = M · ν
![]() M(Fe) = Ar(Fe) = 56
г/моль (из Периодической системы)
M(Fe) = Ar(Fe) = 56
г/моль (из Периодической системы)
Найти: m(Fe) - ? m (Fe) = 56 г/моль · 0,5 моль = 28 г
Ответ: m (Fe) =28 г
Задача №2. Вычислите массу (г) 12,04 · 1023 молекул
оксида кальция CaО.
![]() Дано: Решение:
Дано: Решение:
N(CaO)= 12,04 * 1023 молекул m = M · υ, υ= N/NА,
![]() следовательно, формула для расчёта m = M · (N/NА)
следовательно, формула для расчёта m = M · (N/NА)
Найти: m(СaO) - ? M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль
m= 56 г/моль · (12,04 * 1023/6,02 · 1023 1/моль) = 112 г
Ответ: m= 112 г
Задача №3. Какой объем занимает 0,2 моль N2 при н.у.?
![]() Дано:
н.у. Решение:
Дано:
н.у. Решение:
Vm = 22, 4 л/моль ν (N2) = V(N2 ) / Vm , следовательно
ν (N2) = 0,2 моль V (N2 ) = ν (N2) · Vm = 0,2 моль · 22,4 л / моль = 4,48 л
Найти: Ответ: V (N2 ) =4,48 л
V - ?
![]()
Задача №4. Какое количество вещества содержит водород объемом 33,6 л при н.у.?
![]() Дано:
н.у. Решение:
Дано:
н.у. Решение:
Vm = 22, 4 л/моль ν (Н2) = V(N2 ) / Vm = 33,6 л / 22,4 л/моль = 1,5 моль
V (H2) = 33,6 л Ответ: ν (Н2) = 1,5 моль
![]() Найти:
Найти:
υ(Н2)- ?
Задача №5. Какой объем займут 56 г газа СО при н.у.?
Дано: н.у. Решение:
![]() Vm =
22, 4 л/моль υ (CO) = V(CO) / Vm ,
следовательно V(CO ) = υ (CO) · Vm
Vm =
22, 4 л/моль υ (CO) = V(CO) / Vm ,
следовательно V(CO ) = υ (CO) · Vm
m (CO) = 56 г Неизвестное количество вещества найдём по формуле: υ = m/M
![]() Найти: M(CO) = Ar(C) + Ar(O)
= 12 + 16 = 28 г/моль
Найти: M(CO) = Ar(C) + Ar(O)
= 12 + 16 = 28 г/моль
V(CO) -? υ (СО) = m/M = 56 г / 28 г/моль = 2 моль
V (CO ) = υ(CO) · Vm = 2 моль · 22,4 л/моль = 44,8 л
Ответ: V (CO ) = 44,8 л
Задачи для самостоятельного решения.
1. Определить относительную молекулярную массу карбоната кальция СаСО3.
2. Какое количество вещества соответствует180г воды?
3. Вычислите объем при н.у., который займет углекислый газ (СО2) количеством 6 моль.
4. Вычислите массу метана СН4, объем которого составляет 67,2л.
5. Определить массу 5 моль алюминия (Al).
6. Сколько молей составляет и сколько молекул содержит 8г кислорода О2?
7. Рассчитайте массу и объем сернистого газа SO2 количеством вещества 0,8 моль.
Вопросы для самопроверки.
1. На какие два типа делятся все вещества? Привести примеры веществ.
2. Что называется аллотропными модификациями? Привести примеры.
3. Кто сформулировал закон сохранения массы веществ?
Практическая работа №4
Тема: Составление электронных и графических формул атомов, определение степеней окисления.
Цель работы: закрепить умения и навыки составления электронных формул атомов химических элементов, а также их графических изображений. Сформировать понятия “степень окисления”, Оборудование: ПСХЭ
Ход занятия.
I.Составление электронных и графических формул атомов
1. Задание. Напишите электронные и графические формулы следующих атомов: водорода Н, 2 периода – углерода С, азота N, кислорода O, фтора F, неона Nе .
3 периода - натрия Na, магния Mg,, алюминия Al, кремния Si, фосфора Р, серы S, хлора Сl, аргона Аr; используя образец.
Образец.
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и подуровням.

Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.


Примеры электронного строения атомов:

II. Валентность и степень окисления
А)Валентность – одно из основных понятий химии, которое было введено в науку в середине 19в. Валентность – это свойство атомов химического элемента присоединять определенное число атомов других химических элементов, или валентность – это способность атомов образовывать соединения.
Валентные электроны - это все внешние электроны, а также плюс предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6. Высшая валентность атома равна номеру группы и обозначается римским цифрами (I, II, III, IV, V, VI, VII, VIII).
Выполнение упражнений с использованием таблиц
Методика: (все записать)
При составлении химических формул можно соблюдать следующий порядок действий:
1. Пишут рядом химические знаки элементов, которые входят в состав соединения.
2. Над знаками химических элементов проставляют их валентность.
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов.
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут).
III I I II
AlCl3; H2O
Задание 2. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III
LiO, BaO, PO, SnO, KO, PN, MnO, FeO, BO, HS, NO, CrCl.
Задание 3. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (III).
Б) Для характеристики состояния атомов в соединениях введено понятие степени окисления.
Степень окисления(СО) – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов.
Степень окисления может иметь отрицательное, положительное и нулевое значения, которые обычно выражаются арабскими буквами со знаками и ставят над символом элемента, например:
![]()
Запомнить. (все записать)
1. Нулевую степень окисления имеют атомы в молекулах простых веществ. Например: H20; О20; Сl20 или Hg0, Cu0, Fe0.
2. Постоянная СО у элементов главных подгрупп I-А, II-А, III-А– группы, все другие элементы имеют переменную СО.
3. В соединениях СО всегда:
а )водорода +1, исключение с металлами равна -1: (NaH-1, H+1Cl).
б) фтора -1: (HF-1, CaF-12).
в) кислорода -2 (NO-2, Al2O-23), исключение в пероксидах -1, с фтором +1 (H2O-12, O+1F2)
5. В соединениях сумма значений степени окисления равна «нулю». Это позволяет вычислить степень окисления одного химического элемента, если известны степени окисления других химических элементов в данном соединении: K2+1Cr2O7-2:
(+1)* 2+х* 2+(-2)*7 =0
2+2х-14= 0
2х = 14-2; 2х =12; х=6.
А в сложном ионе-заряду иона [MgxO4-2]2- x+(-2) 4 =-2, x = -2+8, x = +6; +6 +(-2) 4 + -2.
6. Высшая степень окисления элемента равна (+№ группы).
Алгоритм определения степеней окисления по формуле (все записать):
Задание 4. Расставить степени окисления в соединениях: Na; K2O; Fe; CaCO3; AlCl3; Li3N; BaSO4; Zn; H2CO3; O3; OF2; CuSO4; NaOH; O2; SO3; KH; KOH; BaH2; H2O; NH3.
Алгоритм составления формул по названиям (все написать)
Задание 5.Составить формулы веществ по названиям:
Пример: Al+32O-23 – оксид алюминия; Cu+2O-2 – оксид меди (II); Cu+2 Cl-12 – хлорид меди (II)
Cl-1 – хлорид; O-2 – оксид; Н-1 – гидрид; S-2 – сульфид; C-4 – карбид; N-3 – нитрид; P-3 — фосфид; Si-4 — силицид.
1. хлорид кальция

Практическое занятие №5
Тема: Составление уравнений окислительно-восстановительных реакций методом электронного баланса.
Цель занятия: научиться определять степень окисления элементов, определять окислитель и восстановитель, расставлять коэффициенты в уравнениях окислительно-восстановительных реакций.
Оборудование: Периодическая система Д.И. Менделеева.
Ход работы.
Окислительно-восставновительные реакции это реакции протекающие с изменением степеней окисления элементов, образующих веществ и участвующих в реакции.
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит из ионов. Степень окисления может иметь отрицательное, положительное и нулевое значение. При составлении окислительно – восстановительных реакций нужно иметь в виду:
1. Атомы элементов до отдачи или присоединения электронов заряда не имеют ( Н20; Cl20; Fe0; Al0 );
2. При отдаче атомом электронов количество протонов в ядре будет больше количества электронов – атом превращается в положительно заряженный ион. Атом, отдающий электроны, называется восстановителем;
Na0 – ē = Na+ (Na0 – восстановитель)
3. Атом, получивший лишние электроны, будет заряжен отрицательно, т. к. при этом общая сумма электронов, вращающаяся вокруг ядра, будет больше заряда ядра. Атом, присоединяющий электроны, называется окислителем.
Cl0 + ē = Cl- (Cl0 – окислитель)
4. Процесс отдачи атомом, молекулой или ионов электронов, называется окислением, процесс присоединения электронов – восстановлением.
Аl0 – 3ē = Аl3+ - окисление
S0 + 2ē = S2- - восстановление
Оба процесса протекают одновременно – окислитель восстанавливается, а восстановитель окисляется. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Происходит лишь перераспределение электронов.
5. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
Степень окисления атомов в сложных соединениях легко вычислить. Например, степень окисления азота в азотной кислоте (HNO3) равна +5; т. к. степень окисления водорода +1, кислорода –2, то азота Х, тогда +1+Х+(-2*3) = 0; Х = +5
H+1NO3-2 H+1N+5O3-2
При составлении уравнения окислительно – восстановительной реакции методом электронного баланса необходимо соблюдать следующую последовательность действий:
1. Установить состав и формулы взятых и полученных веществ;
2. Определить степень окисления участвующих в реакции элементов в исходных и полученных веществах;
3. Установить, что является окислителем и восстановителем в данной реакции, а также определить количество перемещенных электронов;
4. Подобрать коэффициенты в левой части уравнения на основе правила электронного баланса и в правой части – согласно закону сохранения массы ( баланса атомов ).
Задача №1. Составить уравнение окислительно – восстановительной реакции между хлоридом железа и хлором.
Решение. 1. Записываем схему реакции:
FeCl2 + Cl2 → FeCl3
2. Определяем степень окисления участвующих в реакции элементов:
Fe 2+Cl2 + Cl20 → Fe3+Cl3-
3. Составляем электронные уравнения и определяем окислитель и восстановитель в данной реакции:
![]()
![]() Fe2+
- ē = Fe3+ 2 окисление
Fe2+
- ē = Fe3+ 2 окисление
Cl20 + 2 ē = 2Cl- 1 восстановление
Следовательно, катион Fe2+ - восстановитель; молекула Cl20 – окислитель.
4. Находим коэффициенты при окислителе и восстановителе.
Уравнение принимает вид: 2FeCl2 + Cl2 = 2FeCl3.
Задача № 2. Составить уравнение реакции окисления сульфата железа (II ) перманганатом калия в кислой среде.
Решение. Реакция идет по схеме:
Fe+2SO4 + KMn+7O4 + H2SO4 → Fe+3(SO4)3 + Mn+2SO4 + K2SO4 + H2O.
2. Составляем электронные уравнения:
![]()
![]() Fe+2 - ē → Fe+3 5 окисление
Fe+2 - ē → Fe+3 5 окисление
Mn+7 + 5ē → Mn+2 1 восстановление
Следовательно, катион Fe+2 – восстановитель; катион Mn+7 – окислитель.
3. Находим коэффициенты, и уравнение принимает вид:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Самостоятельное выполнение упражнений.
Методом электронного баланса расставьте коэффициенты в уравнениях реакций, укажите окислитель и восстановитель:
а) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
б) PbO2 + HCl → PbCl2 + Cl2 + H2O.
в) HCl + MnO2 → Cl2 + MnCl2 + H2O.
г) H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
Контрольные вопросы.
1. Какие реакции называются окислительно – восстановительными?
2. Почему металлы в соединениях проявляют только положительные степени окисления, а неметаллы – как положительные, так и отрицательные?
3. Какие вещества называются окислителями и какие восстановителями?
4. Для каких сложных веществ характерны только окислительные свойства?
5. В каких случаях сложные вещества могут выступать в роли окислителей и восстановителей?
6. Как называется: а)процесс отдачи электронов; б) процесс присоединения электронов?
7. Какое правило лежит в основе метода электронного баланса?
Литература.
Практическое занятие №6
Тема: Генетическая связь между классами неорганических соединений.
Цель занятия: обобщение и систематизация знаний об основных классах
неорганических веществ и генетической связи между ними; совершенствование
умения составлять уравнения химических реакций, расставлять коэффициенты в уравнении
реакций.
С веществ одного класса можно получить вещества другого класса. Такая связь между классами неорганических соединений называют генетической, которая отражается в так называемых генетических рядах. Генетическим называют ряд веществ – представителей разных классов, являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающих общность происхождения этих веществ.
Различают две разновидности рядов:
1. генетический ряд металла;
2. генетический ряд неметалла.
I. Выполнение упражнений по закреплению знаний химических свойств классов неорганических соединений, реакций ионного обмена, окислительно-восстановительных реакций.
Вариант 1.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
Са → СаО → Са(ОН)2 → CaCO3 → СаО → Са
Вариант 2.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
Zn → ZnO→ ZnCl2 → Zn(ОН)2 → ZnO → Zn
Вариант 3.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
Сu → СuО → СuSO4 → Сu(ОН)2 → СuО → Сu
Вариант 4.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
С → CO2 → H2CO3 → CaCO3→ CO2 → C
Вариант 5.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
Р2 → Р2О5 → Н3РО4 → Ba3(PO4) 2
Вариант 6.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, назовите продукты реакций, тип реакции. Реакции ионного обмена запишите в молекулярной и ионной форме. Для окислительно-восстановительных реакций составьте уравнение электронного баланса.
Si → SiO2→ Na2SiO3→ H2SiO3→ SiO2
II. Составьте схему генетического ряда для элементов бария и азота
Контрольные вопросы.
1. Что такое металлы?
2. Что такое неметаллы?
3. Что такое оксиды?
4. Что такое кислоты?
5. Что такое основания?
6. Что такое соли?
Литература.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основные источники:
1. Глинка, Н. Л. Задачи и упражнения по общей химии : учеб.-практ. пособие для СПО / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 14-е изд. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 236 с. Режим доступа:
https://biblio-online.ru/book/65691366-A658-420B-A907-94EA957B4018
2.Химия : учебник для СПО / Ю. А. Лебедев, Г. Н. Фадеев, А. М. Голубев, В. Н. Шаповал ; под общ. ред. Г. Н. Фадеева. — 2-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 427 с. Режим доступа: https://biblio-online.ru/book/AB861C8C-4E44-4DA4-A2B6-47170C3740DB
Дополнительные источники:
1. Грандберг, И. И. Органическая химия : учебник для СПО / И. И. Грандберг, Н. Л. Нам. — 8-е изд. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2017. — 608 с. Режим доступа: https://.biblio-online.ru/book/03696AA1-6944-4C84-BBCB-D9D9FA0210CE
2.Князев, Д. А. Неорганическая химия в 2 ч. Часть 1. Теоретические основы : учебник для СПО / Д. А. Князев, С. Н. Смарыгин. — 5-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 253 с. Режим доступа: https://biblio-online.ru/book/32560646-179C-4EC0-9AFA-5CF57BE69810
3. Князев, Д. А. Неорганическая химия в 2 ч. Часть 2. Химия элементов : учебник для СПО / Д. А. Князев, С. Н. Смарыгин. — 5-е изд., перераб. и доп. —[Электронный ресурс] — Электрон. дан. — М. : Издательство Юрайт, 2016. — 357 с. Режим доступа: https://biblio-online.ru/book/98BC03D9-C0FF-4F7E-9AF4-02D4F93DE7AA
Интернет-ресурсы:
1.ООО «ЭБС ЛАНЬ» (https://e.lanbook.com/) (договор на оказание услугот 10.03.2020 № ЭБСУ 437/20/25(Сетевая электронная библиотека)
2. ООО «ЭБС ЛАНЬ» (https://e.lanbook.com/) (договор на оказание услуг по предоставлению доступа к электронным экземплярам произведений научного, учебного характера, составляющим базу данных «ЭБС ЛАНЬ»от 15.03.2021 № б/н)
3. ООО «Издательство Лань» (https://e.lanbook.com/) (договор на оказание услуг по предоставлению доступа к электронным изданиям ООО «Издательство Лань» от 01.04.2021 № б/н)
4. База данных электронных информационных ресурсов ФГБНУ ЦНСХБ (договор по обеспечению доступа к электронным информационным ресурсам ФГБНУ ЦНСХБ через терминал удаленного доступа (ТУД ФГБНУ ЦНСХБ) от 11.03.2021 № 05-УТ/2021)
5.Электронно-библиотечная система «AgriLib» ФГБОУ ВО РГАЗУ (http://ebs.rgazu.ru/) (дополнительное соглашение на предоставление доступа от 12.03.2021 № 21/22 к Лицензионному договору от 04.07.2013 № 27)
6. Электронные базы данных«Национальный цифровой ресурс «Руконт»: Коллекции «Базовый массив» и «Колос-с. Сельское хозяйство» (https://rucont.ru/) (договор на оказание услуг по предоставлению доступа от 17.03.2021 № 123 21/22)
7. ООО «Электронное издательство ЮРАЙТ» (https://urait.ru/)(договор на оказание услуг по предоставлению доступа к образовательной платформе ООО «Электронное издательство ЮРАЙТ»от 24.03.2021№ 4004/21/22)
8.Электронно-библиотечная система «Вернадский» (https://vernadsky-lib.ru) (договор на безвозмездное использование произведений от 26.03.2020 № 14/20/25)
9.База данных НЭБ «Национальная электронная библиотека» (https://rusneb.ru/) (договоро подключении к НЭБ и предоставлении доступа к объектам НЭБот 01.08.2018 № 101/НЭБ/4712)
10.Библиотечно-информационные и социокультурные услуги пользователям университета из числа инвалидов по зрению, слабовидящих, инвалидов других категорий с ограниченным доступом к информации лиц, имеющих трудности с чтением плоскопечатного текста ТОГБУК «Тамбовская областная универсальная научная библиотека им. А.С. Пушкина» (https://www.tambovlib.ru) (соглашение о сотрудничестве от 15.09.2017 № б/н)
11. Программы АСТ-тестирования для рубежного контроля и промежуточной аттестации обучающихся (договор от 25.09.2019№ Л-103/19)
12.Программная система для обнаружения текстовых заимствований в учебных и научных работах «Антиплагиат ВУЗ» (https://docs.antiplagiaus.ru) (лицензионный договор от 04.03.2021№ 3497)
13. Программные комплексы НИИ мониторинга качества образования: «Федеральный интернет-экзамен в сфере профессионального образования (ФЭПО)» (лицензионный договор от 13.04.2021№ ФЭПО -2021/1/108)
14. Справочная правовая система КонсультантПлюс (договор поставки и сопровождения экземпляров от 28.01.2021 № 10618 /13900/ЭС)
15. Электронный периодический справочник «Система ГАРАНТ» (договор на услуги по сопровождению от 11.02.2021 № 194-01/2021)
16. База данных нормативно-правовых актов информационно-образовательной программы «Росметод» (договор от 20.07.2020 № 1312)
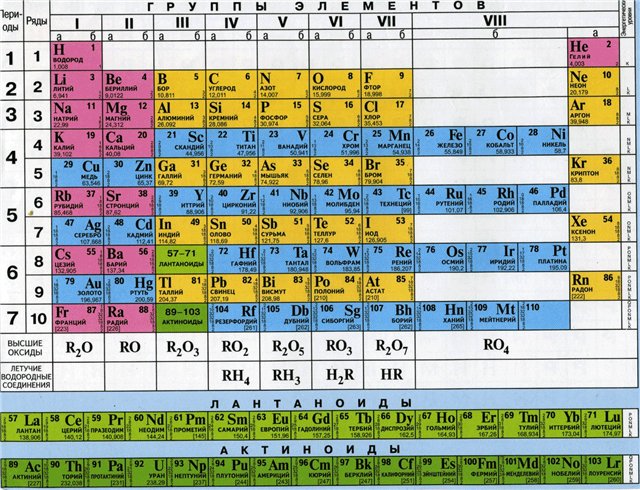
Приложение 1
Периодическая система Д.И. Менделеева
Приложение 2
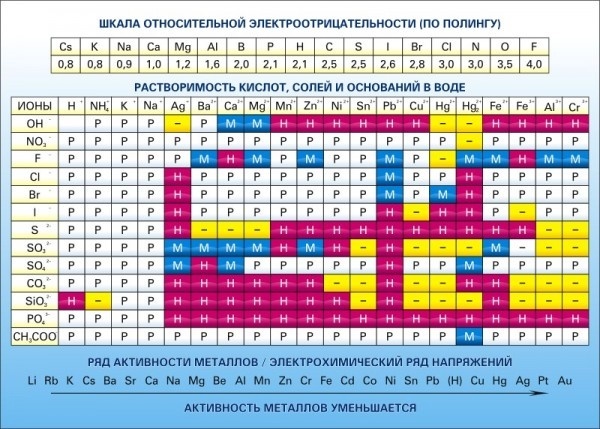
Таблица растворимости кислот, оснований и солей
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.