
Конспект урока на тему: «Химические свойства алканов»
Класс: 10
Тип урока: урок усвоения нового материала
Форма урока: комбинированный
Цель: изучить химические свойства алканов.
Задачи:
Образовательные:
1. Обеспечить усвоение особенностей химических свойств у алканов;
2. Отработать навыки составления уравнений химических реакций, характеризующих свойства алканов;
3. Добиться усвоения механизма галогенирования алканов и прогнозирования протекания реакций замещения у различных атомов углерода.
Развивающие:
1. Развитие аналитического и синтезирующего мышления;
2. Развитие познавательных умений.
Воспитательные:
1. Воспитание мотивов учения и дисциплинированности;
2. Содействовать становлению нравственных и экологических устоев личности.
Методы: словесно-наглядные (рассказ, беседа, работа у доски).
Базовый учебник:
Оборудование: доска; учебник по химии.
План урока:
1. Организационный момент (1-2 мин);
2. Актуализация знаний (7 мин);
3. Изучение нового материала (20 мин);
4. Этап проверки и закрепления знаний (7 мин);
5. Подведение итогов урока (2 мин);
6. Рефлексия (1 мин);
7. Домашнее задание (1 мин).
Ход урока
1. Организационный момент
Учитель. На сегодняшнем уроке мы продолжим изучение органических веществ. Перед нами стоит задача – изучить физические и химические свойства предельных углеводородов. Вспомнить понятия «Углеводороды», «Алканы», «Гомологи».
2. Актуализация знаний
Учитель. Давайте с вами вспомним.
(Проведение фронтального устного опроса учителем0.
1.Какие вещества называются углеводородами?
Ответ. Органические вещества, состоящие из атомов углерода и водорода.
2. Какие углеводороды называются алканами?
Ответ. Органические вещества, состоящие из атомов углерода и водорода, имеющие в своем строении между атомами углерода только одинарные связи, с общей формулой CnH2n+2.
3. Как называется первый представитель алканов и какую он имеет формулу?
4. Какие вещества называют гомологами?
Ответ. Соединения, сходные по строению, а значит, и по химическим свойствам и отличающиеся друг от друга на одну или несколько групп CH2, называются гомологами.
5. Какие вещества называются изомерами?
Задание. Дать названия следующим структурам изомеров алканов
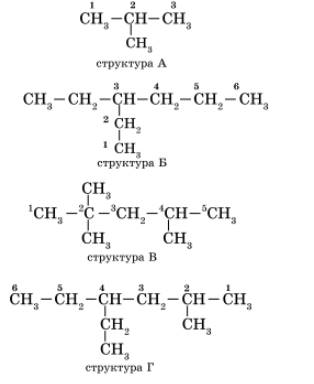
3. Изучение нового материала
Учитель. Мы вспомнили состав, строение алканов. Сейчас нам предстоит изучить химические свойства данного класса веществ.
Тема нашего урока «Химические свойства алканов».
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
метан хлорметан
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия)
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия)
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия)
тетрахлорметан
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Рассмотрим механизм свободнорадикального замещения. Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора. Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
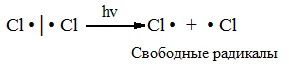
Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
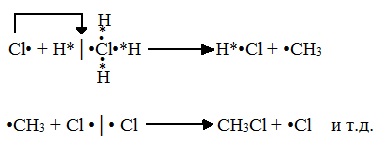
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
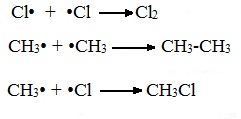
2. Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 1400С и при повышенном или нормальном давлении - реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
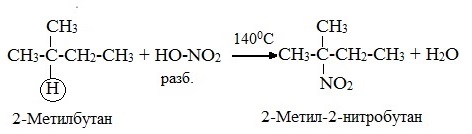
3. Реакция дегидрирования (отщепления водорода)
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
![]()
Реакции окисления
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
![]()
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Горение метана при недостатке кислорода происходит по уравнениям:
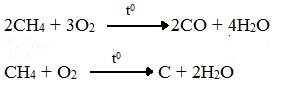
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном
окислении бутана происходит разрыв связи (С2–С3) и
получается две молекулы уксусной кислоты:![]()
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
Реакции, сопровождающиеся разрушением углеродной цепи
1. Горение предельных
углеводородов - это свободнорадикальная экзотермическая реакция,
которая имеет очень большое значение при использовании алканов в качестве
топлива:
![]()
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
2. Пиролиз. При нагревании метана до
температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
![]()
При нагревании до
температуры 1500 °С возможно образование ацетилена:
![]()
3. Изомеризация. При нагревании линейных
углеводородов с катализатором изомеризации (хлоридом алюминия) происходит
образование веществ с разветвленным углеродным скелетом:
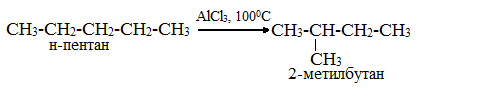
4. Ароматизация. Алканы с шестью или
более углеродными атомами в цепи в присутствии катализатора циклизуются с
образованием бензола и его производных:
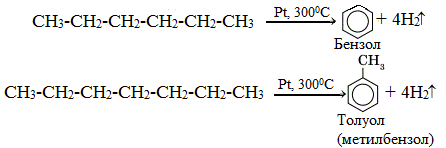
4. Этап проверки и закрепления знаний
Ответьте на вопрос. Назовите реакции, в которые вступают алканы.
Решите тестовые задания:
1. Какие характеристики применимы для описания реакции хлорирования этана?
а) цепная
б) свободнорадикальная
в) протекает в темноте без нагревания
г) сопровождается гомолитическим разрывом связей
2. Для алканов невозможны реакции:
а) замещения
б) полимеризации
в) присоединения
г) изомеризации
5. Подведение итогов
Учитель. Какие выводы по изученной теме мы можем сделать?
(Ответы обучающихся).
Учитель. Вывод: В обычных условиях алканы химически инертнты. При создании необходимых условий для них характерны реакции замещения, отщепления, изомеризации, окисления (горение).
Учитель объявляет итоги урока, оценивает обучающихся по итогам работы на уроке.
6. Рефлексия
В заключение – рефлексивный тест. Выберите 2-3 утверждения из ниже предложенных.
Сегодня на уроке я (мне)…..
1. Узнал(а) много нового;
2. Мне это пригодится в жизни;
3. Было над чем подумать;
4. На возникшие вопросы я получил(а) ответ;
5. Поработал(а) добросовестно, цель достигнута.
7. Домашнее задание
Домашнее задание. Прочитать параграф 11. Повторить гомологичный ряд метана, алгоритм построения изомеров.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.