Алгоритм составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и
восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и
коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
Алгоритм составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и
восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и
коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
Алгоритм составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и
восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и
коэффициенты для электронных уравнений.
5. Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
Алгоритм составления уравнений ОВР
и электронного баланса к ним
1. Записать схему реакции.
2. Определить, атомы каких элементов изменяют степень окисления.
3. Составить электронные уравнения процессов окисления и
восстановления.
4. Подобрать общее делимое для отданных и принятых электронов и
коэффициенты для электронных уравнений.5. Перенести эти коэффициенты в уравнение ОВР и подобрать
коэффициенты перед формулами других веществ.
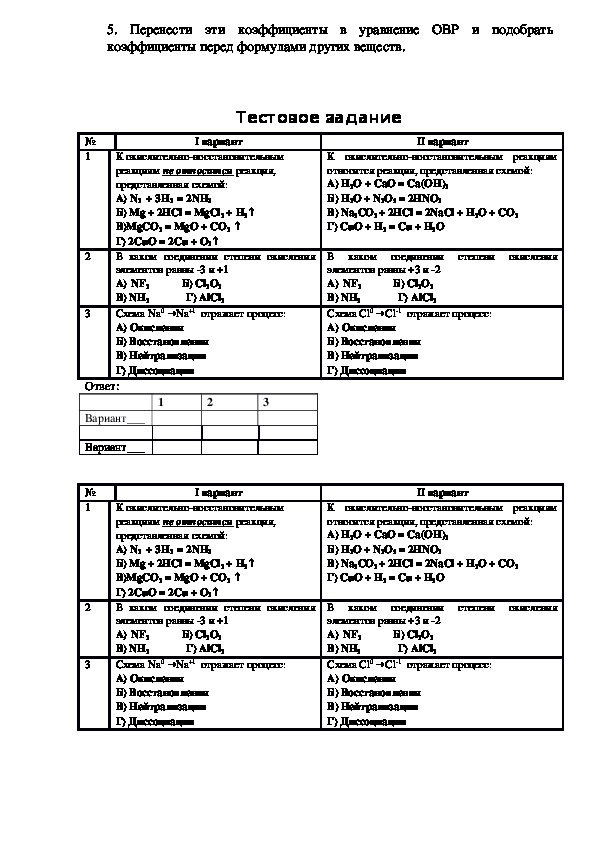
Тестовое задание
№
1
2
3
I вариант
К окислительновосстановительным
реакциям не относится реакция,
представленная схемой:
А) N2 + 3Н2 = 2NН3
Б) Mg + 2HCl = MgCl2 + H2↑
В)MgCO3 = MgO + CO2 ↑
Г) 2CuO = 2Cu + O2↑
В каком соединении степени окисления
элементов равны 3 и +1
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
Схема Na0 →Na+1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
II вариант
К окислительновосстановительным реакциям
относится реакция, представленная схемой:
А) H2O + CaO = Ca(OH)2
Б) H2O + N2O5 = 2HNO3
В) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Г) CuO + H2 = Cu + H2O
В каком соединении степени окисления
элементов равны +3 и 2
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
Схема Сl0 → Сl1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
1
1
2
2
3
3
Ответ:
Вариант___
Вариант___
№
1
I вариант
К окислительновосстановительным
реакциям не относится реакция,
представленная схемой:
А) N2 + 3Н2 = 2NН3
Б) Mg + 2HCl = MgCl2 + H2↑
В)MgCO3 = MgO + CO2 ↑
Г) 2CuO = 2Cu + O2↑
В каком соединении степени окисления
элементов равны 3 и +1
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
Схема Na0 →Na+1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
II вариант
К окислительновосстановительным реакциям
относится реакция, представленная схемой:
А) H2O + CaO = Ca(OH)2
Б) H2O + N2O5 = 2HNO3
В) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Г) CuO + H2 = Cu + H2O
В каком соединении степени окисления
элементов равны +3 и 2
А) NF3 Б) Cl2O3
В) NH3 Г) AlCl3
Схема Сl0 → Сl1 отражает процесс:
А) Окисления
Б) Восстановления
В) Нейтрализации
Г) Диссоциации
2
3