
Контрольная работа по химии
7.
а) Напишите электронную формулу атома никеля Ni.
б) Распределите по квантовым ячейкам электроны двух последних уровней атома
никеля, соблюдая принцип Паули и правило Гунда.
в) Зная, что никель в соединениях может проявлять высшую валентность, равную II,
определите, на каких подуровнях находятся валентные электроны атома никеля и укажите эти электроны. Напишите значения четырёх квантовых чисел для всех валентных электронов атома никеля.
1s 22s 22p 63s 23p64s 23d8 - электронная формула никеля. Электронно-графическая формула атома никеля:
3d ↑↓ ↑↓ ↑↓ ↓ ↓
4s ↑↓
3p ↑↓ ↑↓ ↑↓
3s ↑↓
2p ↑↓ ↑↓ ↑↓
2s ↑↓ 1s ↑↓
Валентными у d-элементов являются s- и d-электроны, здесь: 4s23d8.
Сначала рассмотрим электроны на 5s-подуровне. Главное квантовое число равно 5 и химический элемент находится в 5 периоде периодической системы химических элементов. Поскольку в молибдене валентный электрон расположен на s-подуровне то его орбитальное квантовое число имеет значение равное 0. Поскольку электрон будет только один, то его спин будет иметь значение ms = +1/2. Поскольку ml = 0 то у элемента не будет других подуровней кроме s-подуровня.
Набор квантовых чисел будут иметь вид:
n = 5; l = 0; ml = 0; ms = +1/2.
Рассмотрим электроны на 4d-подуровне. Их количество равно 5. главное квантовое число п равно 4. Орбитальное квантовое число равно и орбитальное квантовое число может принимать значения равные 0, 1, 2, 3. магнитное квантовое число может принимать значения в пределах от +l до -l. Поскольку то ml = -2, -1, 0, +1, +2. Согласно правила Хунда суммарный спин должен быть максимальным, поэтому мы можем считать, что спин электронов будет равен +1/2.
Наборы квантовых чисел для электронов.
n = 5; l = 2; ml = -2 ;ms = +1/2. n = 5; l = 2; ml = -1 ;ms = +1/2. n = 5; l = 2; ml = 0 ;ms = +1/2. n = 5; l = 2; ml = +1 ;ms = +1/2. n = 5; l = 2; ml = +2 ;ms = +1/2.
37.
а)
Определите число связей в молекуле KMnO4.
К-O-Mn(=O)3
3 пи связи,5 сигма связи б)
Какая геометрическая форма молекулы NF3?
Молекула фторида азота будет иметь форму тригональной пирамиды, т.к. атом азота находится в состоянии sp3-гибридизации, но имеет 1 неподеленную электронную пару.
в)
В какой из перечисленных молекул B2O3, Al2O3, HgO, CaO связь элемент -кислород обладает наибольшей ковалентностью? Почему?
B2O3
О=B-О-В=O
г)
Определите, в каких из перечисленных молекул
H2S, NO, O2, H2O содержатся только σ-связи В молекулахH2S, H2Oсодержатся только σ-связи
62.
а)
Сколько эквивалентов кислоты останутся нейтрализованными при смешивании 100 мл 0,5 М раствора H2SO4 и 500 мл 0,5 М раствора NaOH?
2NaOH+H2SO4=Na2SO4+2H2O Дореакции nэ (H2SO4)=Cн (H2SO4)*V(H2SO4)=2*0,5*0,1=0,1 моль-экв. n(NaOH)=Cн (NaOH)*V(NaOH)=0,5*0,5=0,25 моль-экв
После реакции
n(H2SO4)=0 - вся кислота прореагировала n(NaOH)=0,25-0,1=0,15 - в избытке
в)
Определите эквивалент металла, если при сгорании 10 г этого металла образуется 18,88 г этого оксида?
Определим m(O) = m (MexOy) - m (Me), m(O) = 18,88 г - 10,00 г = 8,88 г
Зная, что Эm(O)= 8 г/моль составим уравнение для закона эквивалентов: m (О) / Эm (О) = m (Me)/ Эm (Me)
Выразим Эm(Ме) = Эm(O)* m (Me)/ m (О) и найдем значение:
Эm (Me) = 8*10,00/8,88 = 9 (г/моль)
Методом подбора будем определять возможные значения:
M(Me) = Эm (Me) * валентность (Me)
9*1=9 - Ве (II) 9*2=18 - -- 9*3=27 - Аl (III) +
9*4=36 - -- 9*5=45 - Sc (III)
Таким образом, искомый металл алюминий.
Уравнение реакции 4Al + 3O2 = 2Al2O3 87.
Написать уравнение следующих окислительно-восстановительных реакций. Определить, какое вещество является окислителем и восстановителем, какое вещество создает среду. Указать степень окисления элемента окислителя и восстановителя, определить, сколько электронов отдает восстановитель и принимает окислитель. Уравнять коэффициенты в уравнениях реакций.
а)
P (красный) + HNO3 (конц.) → H3PO4 + NO2 + H2O
HNO3 - окислитель
P - восстановитель
Восстановление:
NO3− + 2H+ + 1e− = NO2 + H2O
Окисление:
P + 4H2O − 5e− = PO43− + 8H+
5NO3− + 2H+ + P = 5NO2 + H2O + PO43−
P (красный) + 5HNO3 (конц.) = H3PO4 + 5NO2 + H2O
б)
KClO3 + K2S + H2SO4 → KCl + S + K2SO4 + H2O
KClO3- окислитель
K2S- восстановитель
Восстановление:
ClO3- + 6H++ 6e = Cl- + 3H2O
Окисление:
S2- - 2e = S0 |3
KClO3 + 3K2S + 3H2SO4 = KCl + 3S + 3K2SO4 + 3H2O в)
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
Na2SO3- восстановитель KMnO4 - окислитель
Окисление:
S4+ - 2e → S6+ | 2 | 1
Восстановление:
Mn7+ + 1e → Mn6+ | 1 | 2
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4 + Na2SO4 + H2O
112. а)
Рассчитайте, сколько граммов Na2SO4·10H2Oнеобходимо взять для приготовления 400 мл 0,3 н. раствора Na2SO4 m(Na2SO4∙10H2O)=v*М(Na2SO4)+10v*M(H2O) v (Na2SO4) = 0.4*0.3 = 0.12 моль
m(Na2SO4∙10H2O)= 0.12*142 + 10*0.12*18 = 17.04+21,6 = 38,64 г б)
Рассчитайте, сколько миллилитров воды надо добавить к 100 мл 48%-ного раствора (ρ = 1,303 г/см3), чтобы раствор стал 20%.
m в одном литре раствора = 1303 г.
В 100 мл =130,3 г
В этом 48% растворе mв-ва =130,3*48/100=62,544 г. m(Н2О)=130,3-62,544=67,756 г.
m в-ва в 20% растворе = 130,3*20/100 =26,06 г. m(Н2О)=130,3-26,06=104,24 г.
m(Н2О)=104,24-67,756=36,484 г. – необходимо добавить воды к 48% раствору.
в)
Давление пара эфира при 30 °С равно 648 мм рт.ст. Сколько молей вещества надо растворить в 40 молях эфира, чтобы понизить давление пара при данной температуре на 10 мм рт.ст.?
(p0 - p1) / p0 = n2 / (n1+ n2)
13303/86392= n2 / (n1+ n2) 0.153== n2 / (40+ n2) n2 = 0,153(40+ n2) n2 = 6,12 + 0,152n2
n=0,627 моль
137. а)
В 100 мл щелочи содержится 0,004 г NaOH. Определите рН раствора.
М(NaOH)=40г\моль п(NaOH)=0,0001 моль NaOH - сильное основание (щелочь). В водных растворах сильные основания диссоциируют полностью:
NaOH = Na⁺ + OH⁻
Из одного моль NaOH образуется один моль ионов OH⁻.
Равновесная молярная концентрация гидроксид-ионов равна молярной концентрации растворенной щелочи: [OH⁻] = Cм(NaOH).
Рассчитаем молярную концентрацию NaOH.
Для этого сначала найдем n - количество NaOH, исходя из m - массы NaOH и M - молярной массы NaOH:
n(NaOH) = m(NaOH)/M(NaOH) = 0.004/40=0.0001 моль
[OH⁻] = Cм(NaOH) = 0,001 моль/л От [OH⁻] переходим к [H⁺]:
[H⁺]*[OH⁻] = 10⁻¹⁴ [H⁺] = 10⁻¹⁴/[OH⁻] = 10⁻¹⁴/0,001 = 10⁻¹3 pH = - lg 10⁻¹3 = 13
б)
Вычислите рН 0,2 М раствора хлоруксусной кислоты СН2ClСООН, К= 1,4*10-3.
Запишем уравнение диссоциации хлоруксусной кислоты (СН2ClСООН):
СН2ClСООН→СН2ClСОО- + Н+
Учитывая, что хлоруксусная кислота– это очень слабая одноосновная кислота, которая существует лишь в растворах, найдем равновесную концентрацию ионов водорода по формуле:
![]() [Н+]= КС
[Н+]= КС
Где:
K – константа диссоциации кислоты; C – молярная концентрация кислоты. Получаем:
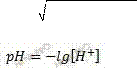 [Н+]= 1,4*103 *0,2 =0,0167моль/л
[Н+]= 1,4*103 *0,2 =0,0167моль/л
Рассчитать pH раствора по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе. Рассчитать pH
pH = – lg [0,0167]
164.
Вычислить H°, G°, S° приведенных ниже реакций. Сделать вывод о возможности протекания приведенных реакций в указанном направлении при 25°С, если реакция при комнатных условиях не идет, выяснить, пойдет ли реакция при других температурах. 4NH3г + 5O2г = 4NOг + 6H2Oг
∆Hх.р. = 4*90,37 - 6*241,83 + 4*46,19 = -904,74 кДж
∆Sх.р. = 4*210,2 + 6*188,72 - 4*192,5 - 5*205,03 = 177,97 Дж/моль*К ∆Gх.р. = -904,74 - 298*(177,97/1000) = -957,78 кДж
Эта реакция при стандартных условиях возможна, т.к. ∆G < 0. 187. а)
CO(г) + H2O(г) ↔CO2(г) + H2(г).
б)
Найдите равновесные концентрации СО2, Н2, если константа равновесия равна 1, а исходные концентрации СО, Н2О, СО2, Н2 равны соответственно 1 моль/л, 1 моль/л, 0 моль/л, 0 моль/л.
Уравнение реакции имеет вид:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
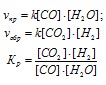
Обозначаем за х моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 1 – х моль/л; [Н2О]исх = 1 - х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 1- х; [Н2O]P = 1 – х.
Подставляем эти значения в выражение константы равновесия:
x*x
1= ![]()
(1x)*(1x) Решая уравнение, находим х = 0,5. Отсюда равновесие концентрации (моль/л):
[СО2]Р = [Н2]Р = х = 0,5 моль/л; [Н2O]P = 1 – х = 0,5 моль/л;
[СO]P= 1 – х = 0,5 моль/л.
217. Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей.
Если гидролиз идёт по стадиям. Напишите уравнения гидролиза по стадиям. Укажите условия, при которых происходит данная стадия гидролиза. Укажите, как изменяется pHсреды.
a) Cu(NO3)2
Cu(NO3)2 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону.
Первая стадия гидролиза
Молекулярное уравнение:
Cu(NO3)2 + HOH ![]() CuOHNO3
+ HNO3
CuOHNO3
+ HNO3
Полное ионное уравнение:
Cu2+ + 2NO3- + HOH ![]() CuOH+
+ NO3- + H+ + NO3-
CuOH+
+ NO3- + H+ + NO3-
Краткое ионное уравнение: Cu2+ + HOH ![]() CuOH+
+ H+
CuOH+
+ H+
Вторая стадия гидролиза
Молекулярное уравнение: CuOHNO3 + H2O
![]() Cu(OH)2
+ HNO3
Cu(OH)2
+ HNO3
Полное ионное уравнение:
CuOH+ + NO3- + H2O
![]() Cu(OH)2
+ H+ + NO3-
Cu(OH)2
+ H+ + NO3-
Краткое ионное уравнение:
CuOH+ + H2O ![]() Cu(OH)2 + H+
Cu(OH)2 + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет иметь кислую среду (pH< 7).
b) K3BO3
Борат калия - соль образована сильным основанием и слабой кислотой.
К3ВО4+H2O - трехступенчатый гидролиз
1 ступень
К3BO3+H2O=К2HBO3+КОН BO33-+H2O=HBO32-+OH-
2 ступень
К2HBO3+ H2O=КH2BO3+КOH
HBO32-+H2O=H2BO3-+OН-
3 ступень
КH2BO3+H2O=H3BO3+КОН
H2BO3-+H2O=H3BO3+OН- Т.к. в результате гидролиза образовались ионы (OН-), то раствор будет иметь щелочную среду (pH> 7).
в) (NH4)3PO4
(NH4)3PO4 – соль слабого основания и кислоты средней силы, поэтому гидролиз протекает по катиону.
(NH4)3PO4 + HOH![]() (NH4)2HPO4
+ NH4OH
(NH4)2HPO4
+ NH4OH
3NH4+
+ PO43- + HOH![]() 2NH4+ + H+
+ PO43- + NH4OH NH4+ +
HOH
2NH4+ + H+
+ PO43- + NH4OH NH4+ +
HOH ![]() H+ + NH4OH Далее
гидролиз практически не идет.
H+ + NH4OH Далее
гидролиз практически не идет.
Раствор(NH4)3PO4 будет иметь кислую среду (pH< 7). 242.
Рассчитать ЭДС следующих гальванических элементов
[Cd 2+] = 10–4 моль/л, [H+] = 1 моль/л;
Pt,H2/2H+ или Pt,H2/H2SO4 – водородный электрод; Cd/Cd2+ или Cd/CdSO4 – металлический электрод.
Расчет электродных потенциалов
Стандартные значения: φ°2H+/H2 = 0, φ°Cd 2+/Cd = – 0,40 B. φ Св 2+.Св = φ°Св 2+.Св + (0б059 . 2)дпхСв 2+ъ = –0б40 + (0б059 . 2)дп10–4 = –
0б518 Ию φ Cd2+/Cd< 0, следовательно кадмиевый электрод является анодом.
Расчет ЭДС
ЭДС = φK – φА = φ°2Н+/Н2 – φZn2+/Zn = 0– (– 0,518) = 0,518 В. Схема гальванического элемента: е-
A(–) Cd/ CdSO4 ║ H2SO4 /Pt,H2 (+) K
← SO4 2–
Электродные процессы:
Анод (–): Cd0 – 2ē → Cd2+ – окисление; Катод (+):2H+ + 2ē → H2 – восстановление.
Cd + 2H+ → Cd2++ H2 ↑
Cd + H2SO4 → CdSO4 + H2↑
272.
На медную пластину нанесено пористое покрытие из серебра. Будет ли данная пластина подвергаться коррозии? Если будет, то в каких средах (кислой, щелочной или нейтральной). Напишите уравнения реакций тех процессов, которые будут протекать на анодных и катодных участках при коррозии.
Сuэлектрохимически более активный, чем Ag. В этом случае при нарушении сплошности покрытия корродировать будет металл с более низким потенциалом, т.е. металл покрытия - Сu. Поэтому при коррозии Сu выступает анодом, а Ag – катодом, т.е. покрытие анодное.
При нарушении покрытия на аноде будет происходить окисление металла, а на катоде - восстановление окислителя агрессивной среды.
Во влажной насыщенной кислородом среде:
На катоде: 2H2O + O2 – 4e = 4OH-Ек=+0,40 В
На аноде: Сu – 2e = Сu2+Еа=+0,34 В
Е= Ек-Еа=0,40-0,34 >0 - есть реакция.
При нарушении в солянокислой среде: На катоде: 2Н+ + 2е = Н2Ек=0,00 В
На аноде: Сu – 2e = Сu2+Еа=+0,34 В
Е= Ек-Еа=0,00-0,34 <0 - нет реакции, коррозии в этих условиях нет (это и ясно, металл неактивный и не восстанавливает водород).
292.
Рассчитайте время, которое необходимо для выделения всего хрома из 500 мл 0,6 н.
раствора Cr2(SO4)3 силой тока 2,68 А. Предположить, что всё электричество расходуется на выделение хрома.
K: Cr3+ + 3e → Cr0
A: 2H2O - 4e → O2 + 4H+
2Cr2(SO4)3 + 6H2O → 4Cr + 6H2SO4 + 3O2 Эм Cr2(SO4)3=392/2*3=65,33экв/моль m(Cr2(SO4)3)=нVМэ/1000=19,599г m(Cr)=5,2г m(Cr) = Mэ(Cr)*I*t*Bт/F
t = m(Cr)*F / (Mэ(Cr)*I*Bт) = 5,2*96500/(17,33*2,68*1) = 10805,34сек или ≈3ч
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.