
Мастер – класс
Решение задач
по теме:
«Массовая доля вещества в растворе»
Подготовила:
Власова Л.Д.
учитель химии высшей категории,
учитель-методист
МОУ «Школа № 2
им. Героя Советского Союза
Ю.М. Двужильного г. Донецка»
Донецк 2020
Тема: Вычисление массовой доли и массы растворенного вещества в
растворе.
Цели:
1) Расширить знания учащихся о массовой доли растворенного вещества;
2) Обобщать практические навыки вычисления массовой доли и массы растворенного вещества в растворе;
3) Решение задач на вычисление массовой доли и массы растворенного вещества в растворе;
4) Оценить уровень усвоения умений и навыков использования понятия о массовой доле растворенного вещества для приготовления растворов с определенной заданной концентрацией вещества.
Оборудование:
Периодическая система химических элементов Д.И. Менделеева;
Ход урока
І. Организационный момент – 1 мин.
ІІ. Актуализация опорных знаний.
Ученик записывает на доске формулу для определения массовой доли растворенного вещества.
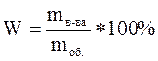
Что такое массовая доля растворенного вещества.
ІІІ. Решение задач.
Задача №1.
В 135,6г. воды растворено 64,4г. глауберовой соли Na2SO4*10H2O. Какова массовая доля безводной соли в растворе?
1) Находим массу раствора: m (р-ра) = 135,6+64,4 = 200 (г). 2) Находим молярную массу глауберовой соли М (Na2SO4*10H2O) = 23*2+32+16*4+10*18 = =
142+180 = 322 г/моль
![]() Дано:
Дано:
m (H2O) = 135,6г.
m (Na2SO4*10H2O) = 64,4г.
![]() W (Na2SO4) - ?
W (Na2SO4) - ?
В 1 моль Na2SO4*10H2O содержится 1 моль Na2SO4
m (Na2SO4*10H2O) = M*V = 322 г/моль *1 моль = 322 (г)
m (Na2SO4) = 142 г/моль*1 моль = 142 (г)
3) Составляем пропорцию:
Находим массу безводного сульфата натрия Na2SO4
В 322 г. Na2SO4*10H2O содержит 142г. Na2SO4
В 64,4г. Хг. Na2SO4
m (Na2SO4) = X = ![]() = 28,4 (г).
= 28,4 (г).
4) Определим массовую долю безводной соли в растворе.
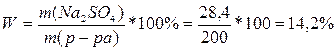
Ответ: W (Na2SO4) = 14,2%
1) m об.
= 120+10,5 = 130,5 (г). 2) М (FeSO4*7H2O) = 56+32+64+7*18 = =
152+126 = 278 г/моль![]()
![]() Задача №2. (для самостоятельного решения). стр. 79 задача №108 (по
учебнику)
Задача №2. (для самостоятельного решения). стр. 79 задача №108 (по
учебнику)
Дано:
m (H2O) = 120г.
m (FeSO4*7H2O) = 10,5г.
W (FeSO4) - ?
3) В 278 г. FeSO4*7H2O – 142г. Na2SO4
В 10,5г. – Хг. FeSO4
m (FeSO4) = X =
![]() = 5,74 (г).
= 5,74 (г).
4) ![]()
Ответ: W (FeSO4) = 4,4%
Задача №3.
1) Вычислим массу исходного раствора. m р-ра = p*V = 50*1,836 = 91,8 (г). 2) Вычислим массу кислоты H2SO4. m к-ты = 3) Вычислим m раствора
после разбавления: m об = 250+91,8 = 341,8 (г).
![]() (г).
(г).![]() Какова массовая доля H2SO4 в растворе после разбавления, если
50мл. 96% - ного раствора H2SO4 (p=1,836
г/мл) разбавили 250мл. воды.
Какова массовая доля H2SO4 в растворе после разбавления, если
50мл. 96% - ного раствора H2SO4 (p=1,836
г/мл) разбавили 250мл. воды.
Дано:
V (р-ра) = 50мл.
W1 = 96%
p1 = 1,836 г/мл
![]() V (H2O) = 250мл.
V (H2O) = 250мл.
W2 - ?
4) Вычислим W (H2SO4) в растворе:
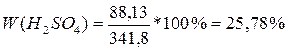
Ответ: W (H2SO4) = 25,78%
Задача №4.
1) Определим массу NH3 М (NH3) = 17 г/моль; Vm=22,4 л/моль Составляем пропорцию: 1моль – 17г – 22,4л Х – 100л![]()
![]() В 300г. воды растворено 100л. NH3 (при н.у). Какова массовая доля аммиака в растворе?
В 300г. воды растворено 100л. NH3 (при н.у). Какова массовая доля аммиака в растворе?
Дано:
m (H2O) = 300г.
V (NH3) = 100л.
W - ?
m (NH3) = X = ![]() = 75,9 (г).
= 75,9 (г).
2) Находим массу раствора:
m (р-ра) = m (H2O) + m (NH3) = 300+75,9 = 375,9 (г).
3) Определяем массовую долю аммиака в растворе:
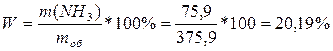
![]()
М (NH3) = 17 г/моль; Vm=22,4 л/моль 1) m (NH3) = M*V (NH3);
V (NH3) = m (NH3) = М*
![]()
![]() =
=
![]()
![]()
![]() Задача №5. (самостоятельно). №109 стр. 79
(учебник)
Задача №5. (самостоятельно). №109 стр. 79
(учебник)
Дано:
m (H2O) = 600г.
V (NH3) = 448л.
W (NH3) - ?
2) m об = 600+340 = 940 (г).
3) W (NH3) = 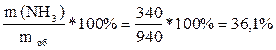
IV. Подведение итогов работы.
Проверка решения задачи №5
V. Домашнее задание.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.