
«ХИМИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ КАРБОНОВЫХ КИСЛОТ»







Разработала: преподаватель химии Ракчеева Наталия Александровна,
ГБПОУ «Ставропольский региональный многопрофильный колледж»
г. Ставрополь, 2016
Тема занятия: " Химические свойства предельных карбоновых кислот "
Тип занятия: изучение новых знаний и способов действий.
Вид занятия: лабораторная работа
Время: 80 минут
Цель учебного занятия: формирование общих компетенций с использованием интерактивных методов обучения: по окончанию занятия обучающийся:
а) знает:
- строение молекулы предельных карбоновых кислот;
- общие химические свойства органических и неорганических кислот;
- специфические свойствами карбоновых кислот.
б) умеет:
работать с информацией
в) владеет рефлексией.
Задачи:
Развивающая: развивать навыки экспериментальной работы, умения сравнивать, обобщать, делать самостоятельные выводы.
Образовательная: исследовать свойства предельных карбоновых кислот, выявить общие свойства с неорганическими кислотами; познакомить со специфическими свойствами карбоновых кислот, научить самостоятельно составлять уравнения реакций.
Воспитательная: продолжить формирование у учащихся научно-материалистического мировоззрения, подтвердить единство природы, выражающегося в общих свойствах органических и неорганических веществ; развивать коммуникативные способности, воспитывать взаимовыручку, критически относится к оценке своих знаний.
Методическая цель: Продемонстрировать возможности использования на занятии информационно - коммуникационных технологий; педагогики сотрудничества, продуктивных методов и приемов обучения (работа в группах, лабораторная работа, адресный опрос, проблемные ситуации).
Форма организации работы: фронтальная, индивидуальная, групповая.
Методы обучения – словесные, наглядные, исследовательские, метод проблемного изложения, диалогический метод, устный и письменный контроль, самоконтроль.
Учебно-методическое обеспечение занятия:
Технические средства обучения: проектор, экран, компьютер, презентация к уроку, реактивы: р-ры уксусной, муравьиной, соляной кислот, гидроксида натрия, сульфата меди; карбонат натрия, оксид меди, металлический магний, аммиачный раствор оксида серебра, универсальная индикаторная бумага, р-р фенолфталеина, спиртовка, химическая посуда, штатив с пробирками, пробиркодержатель, спички, муляжи фруктов.
Дидактические материалы: рабочий лист (приложение №1); оценочный лист (приложение №2).
Ум заключается не только в знаниях,
но и в умении применять знания в деле…
Аристотель.
Ход учебного занятия:
I. Организационный момент (приветствие обучающихся, проверка их явки и готовности к занятию).
Вступительное слово преподавателя:
Мы продолжаем изучать представителей одного из классов органических соединений, которые находят широкое применение в различных отраслях народного хозяйства -в технике, кожевенном производстве, в медицине, в пищевой промышленности и т.д.
Я хочу показать вам картину художника Якоба Йорданса «Пир Клеопатры» (слайд 2), сюжет которой имеет определенное отношение к теме сегодняшнего занятия.
На картине изображена египетская царица Клеопатра (I век до н.э.), славившаяся красотой и умом и отличавшаяся экстравагантностью своего поведения. Существует легенда, что однажды царица Клеопатра поспорила со своим возлюбленным Марком Антонием, что сумеет приготовить самое драгоценное яство из когда-либо подававшихся.
Преподаватель зачитывает отрывок из произведения Г.Р.Хаггарда “Клеопатра”:
“… Она вынула из уха одну их тех жемчужин … и … опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев наблюдали, как несравненная жемчужина медленно растворяется в крепком уксусе. Вот от ней осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли…”
Жемчуг якобы растворился в уксусе, и Клеопатра выпила чашу до дна, тем самым победив в этой затее.
-Как называется химическое соединение, полученное царицей Клеопатрой мы узнаем в конце нашего занятия.
 II.
Актуализация ранее изученного материала.
II.
Актуализация ранее изученного материала.
Преподаватель. Вам уже известны общие физические свойства карбоновых кислот, знаете вы и строение функциональной группы, номенклатуру этих кислородосодержащих органических соединений. А хорошо ли вам знакомы отдельные представители этого класса соединений?
 Мозговой
штурм. Задание «черный ящик».
Мозговой
штурм. Задание «черный ящик».
1-ое вещество. Бесцветная, ядовитая, едкая жидкость с резким запахом. Используется в качестве пищевой добавки под обозначением E236. В природе встречается в хвое, крапиве, фруктах, едких выделениях пчел и муравьев. Впервые было выделено в 1671 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв (слайд 3).
 Ответ:
муравьиная кислота- ящике находится муравьиный спирт (спиртовой раствор
муравьиной кислоты).
Ответ:
муравьиная кислота- ящике находится муравьиный спирт (спиртовой раствор
муравьиной кислоты).
2-ое вещество. У меня в черном ящике находится удивительное, но хорошо вам знакомое вещество. Оно широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также консервировании. Его применяют для получения лекарственных и душистых веществ, как растворитель. Используется в книгопечатании и крашении (слайд 4).
Ответ: уксусная кислота – в ящике находится бутылка с уксусом.
 3-ое вещество. В
черном ящике находится вещество, которое в наибольшей концентрации содержится
в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много её в
китайском лимоннике и недозрелых лимонах, из которых и было впервые выделено в
1784 г. К. Шееле (слайд 5).
3-ое вещество. В
черном ящике находится вещество, которое в наибольшей концентрации содержится
в ягодах, плодах цитрусовых, хвое, стеблях махорки, особенно много её в
китайском лимоннике и недозрелых лимонах, из которых и было впервые выделено в
1784 г. К. Шееле (слайд 5).
Ответ: лимонная кислота (в черном ящике- апельсины, лимоны или пакетики с лимонной кислотой).
 4-е
вещество. Бесцветные кристаллы, растворимые в воде и спирте. В пищевой
промышленности используется в качестве пищевой добавки E363. Стимулирует рост и
повышает урожай растений. Содержится в небольших количествах во многих
растениях, янтаре (слайд 6).
4-е
вещество. Бесцветные кристаллы, растворимые в воде и спирте. В пищевой
промышленности используется в качестве пищевой добавки E363. Стимулирует рост и
повышает урожай растений. Содержится в небольших количествах во многих
растениях, янтаре (слайд 6).
Ответ: янтарная кислота ( в черном ящике- таблетки янтарной кислоты)
После ответов учащихся преподаватель рассказывает о значении янтарной кислоты.
Янтарная кислота является эффективным, природным средством продления активной жизни до старости. Янтарная кислота стимулирует клеточное дыхание, а также оказывает воздействие на усвоение клетками кислорода. Кроме того, она обезвреживает свободные радикалы, обладает мощным антитоксичным свойством. Янтарная кислота укрепляет иммунитет, восстанавливает работу нервной системы, оказывает укрепляющее действие на работу почек и кишечника. Также янтарная кислота способствует выработке инсулина, тем самым, продлевая долголетие (слайд 7).
Беседа по итогам «Мозгового штурма»:
а) к какому классу кислородосодержащих органических соединений относятся эти вещества;
б) как называется функциональная группа, содержащаяся в этих соединениях;
в) какая связь существует между свойствами карбоновых кислот и их строением?
г) сходны ли по свойствам органические кислоты и минеральные и если сходны, в чем причина этого? (слайд 8).
Преподаватель: Как вы думаете, какие вопросы очень важные для химика нам еще предстоит изучить? (химические свойства карбоновых кислот). А так ли важно знать их химические свойства, для чего нам нужны эти знания? Чтобы ответить на этот вопрос давайте послушаем сообщения наших учащихся о карбоновых кислотах и их значении в нашей жизни.
2.2 Защита мини-проектов по теме “Карбоновые кислоты» (слайды 9-22).
Преподаватель: Можно ли прожить без знаний о КК? Может быть и можно, но, что бы себя считать образованными людьми, я думаю, мы обязаны знать, что мы едим и пьем, с чем имеем дело в быту. Знать, чем опасны эти вещества, с чем они могут прореагировать, поэтому нам и необходимы знания об этих соединениях. Итак, тема сегодняшнего занятия (формулируются вместе с обучающимися): Химические свойства карбоновых кислот (запись в тетрадь) слайд 23.
Цель занятия (формулируются вместе с обучающимися, слайд 24):
1.Выяснить особенности строения карбоксильной группы и спрогнозировать химические свойства карбоновых кислот;
2.С помощью лабораторного исследования изучить химические свойства карбоновых кислот (общие и специфические);
3. На примере муравьиной и уксусной кислот уметь составлять уравнения реакций, характеризующих свойства ПКК.
III. Изучение нового материала.
3.1 Особенность строения молекул карбоновых кислот.
Преподаватель: вы знаете, что свойства веществ зависят от строения. Каковы особенности строения карбоновых кислот? Отличаются ли они от строения неорганических кислот? (слайд 25)
Проблема: Какие свойства, исходя из такого строения, можно предположить у этих веществ?
основные (ОН-)
Гипотеза:
кислотные (Н+)
Электронная плотность в карбонильной группе (особенно σ-связи) смещена в сторону кислорода, как более электроотрицательного элемента (слайд 26).

Вследствие этого карбонильный атом углерода приобретает частичный положительный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома кислорода гидроксильной группы. Электронная плотность на атоме кислорода понижается и он смещает в свою сторону электронную плотность связи О – Н. Полярность связи в гидроксогруппе возрастает, водород становится подвижнее и легче отщепляется в виде протона, что обуславливает общие свойства карбоновых кислот.
Поскольку, класс веществ называется кислоты, то можно предположить, что КК будут иметь общие свойства с неорганическими кислотами. Но, поскольку это вещества органические, то для них будут характерны и специфические свойства.
3.2 Свойства, характерны для неорганических кислот.
Преподаватель: скажите, какие свойства характерны для неорганических кислот (вначале выслушать ответы учащихся, затем обобщить, слайд 27):
- действие на индикаторы,
+ Ме,
+ щелочь,
+ нерастворимое основание,
+ амфотерный гидроксид,
+ основный оксид,
+ амфотерный оксид,
+ соль.
Чтобы подтвердить общность свойств кислот, выполним лабораторную работу (обучающихся предварительно делим на 4 группы).
Краткий инструктаж по технике безопасности (слайд 28-29).
3.3 Лабораторная работа. Свойства уксусной кислоты в сравнении со свойствами соляной кислоты (слайд 30).
Цель работы: Изучить общие и специфические свойства предельных карбоновых кислот.
Группа 1. Исследование общих химических свойств карбоновых и неорганических кислот. (Взаимодействие с металлами и действие на индикатор).
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства минеральных и органических кислот.
Опыт 1. В пробирку налейте 1 – 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами) и опустите универсальную индикаторную бумагу (отметьте цвет индикатора), затем добавьте немного порошка магния (слайд 31).
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнение проведенной реакции.
Опыт 2.
В пробирку налейте 1 – 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с органическими веществами) и опустите универсальную индикаторную бумагу (отметьте цвет индикатора), затем добавьте немного порошка магния (слайд 32).
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнение проведенной реакции. Наблюдения оформите в виде таблицы: (слайд 33).
|
№ п/п |
Исходные вещества |
Результат |
Уравнения реакций |
|
1 |
|
|
|
|
2 |
|
|
|
Вывод: уксусная и соляная кислоты одинаково взаимодействуют с активным металлом магнием. Магний вытесняет водород из растворов кислот.
Группа 2. Исследование общих химических свойств карбоновых и неорганических кислот. (Взаимодействие с оксидами и гидроксидами металлов).
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства неорганических и органических кислот.
Опыт 1. В две пробирки налейте 1 – 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с минеральными кислотами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли индикатора фенолфталеина (отметьте цвет раствора), затем нейтрализуйте кислоту раствором гидроксида натрия. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенных реакций.
Опыт 2. В две пробирки налейте 1 – 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с кислотами). В первую добавьте немного порошка оксида магния. Во вторую пробирку внесите 1-2 капли индикатора фенолфталеина (отметьте цвет раствора), затем нейтрализуйте кислоту раствором щелочи (слайд 34).
Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Вывод: уксусная и соляная кислоты одинаково реагируют с оксидами металлов и щелочами, образуя соответствующие соли и воду.
Группа 3. Исследование общих химических свойств карбоновых и неорганических кислот. (Взаимодействие с солями слабых кислот, действие на индикатор).
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства неорганических и органических кислот.
Опыт 1. В пробирку налейте 1 – 2 мл раствора соляной кислоты (помните о правилах техники безопасности при работе с кислотами) и опустите универсальную индикаторную бумагу (отметьте цвет индикатора), затем добавьте раствор карбоната натрия. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнение проведенной реакции.
Опыт 2. В пробирку налейте 1 – 2 мл раствора уксусной кислоты (помните о правилах техники безопасности при работе с кислотами) и опустите универсальную индикаторную бумагу (отметьте цвет индикатора), затем добавьте раствор карбоната натрия. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнение проведенной реакции. Наблюдения оформите в виде таблицы.
Вывод: уксусная и соляная кислоты проявляют общие химические свойства, реагируют с солями.
Группа 4. Исследование общих химических свойств карбоновых и неорганических кислот. (Взаимодействие с нерастворимыми основаниями).
Цель. Изучить кислотные свойства уксусной кислоты. Сравнить химические свойства неорганических и органических кислот.
Опыт 1. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 – 2 мл раствора гидроксида натрия (отметьте, что наблюдаете), затем налейте немного соляной кислоты. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенных реакций (слайд 35).
Опыт 2. Налейте в пробирку 2- 3 мл раствора сульфата меди (II) и прибавьте 1 – 2 мл раствора гидроксида натрия (отметьте, что наблюдаете), затем налейте раствор уксусной кислоты. Отметьте, какие изменения произошли. Сделайте соответствующий вывод. Составьте уравнения проведенных реакций. Наблюдения оформите в виде таблицы.
Вывод: уксусная и соляная кислоты проявляют общие химические свойства, реагируя с нерастворимыми основаниями.
После завершения исследования группы представляют результаты своей работы, которые оцениваются по следующим критериям:
-умение обучающихся кратко обобщить и записать итог выполненной работы в виде химических формул, уравнений, словесных выводов;
-умение учащихся конкретно, полно, развернуто и научно объяснить полученные результаты исследования;
-участие (активность) каждого учащегося в работе группы;
-умение анализировать, сравнивать, логически мыслить и делать выводы.
Преподаватель: Для карбоновых кислот характерны также и реакции горения (реакцию горения паров ледяной уксусной кислоты демонстрируется преподавателем посредством видео эксперимента, слайд 36):
CH3СОOH +2O2 →2CO2 +2H2O
Преподаватель: Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров - уже известная вам реакция этерификации: Реакция этерификации наблюдается у некоторых неорганических кислот -HNO3, H2SO4. (Демонстрируется преподавателем посредством видео эксперимента, слайд 37):
RCOOH + R’OH → RCOOR' + Н2О
Преподаватель: Муравьиная кислота по химическим свойствам отличается от других карбоновых кислот тем, что карбоксильная группа в ней связана не с углеводородным радикалом, а с атомом водорода. Поэтому муравьиную кислоту можно рассматривать и как кислоту, и как альдегид (слайд 38):
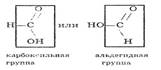
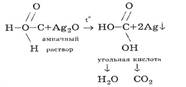
Преподаватель: Подобно альдегидам, муравьиная кислота дает реакцию «серебряного зеркала», проявляя специфические свойства (слайд 39):
Проблемный эксперимент: преподаватель проводит демонстрационно реакцию «серебряного зеркала» с муравьиной и уксусной кислотой:
Общий вывод (слайд 40):
1. ПКК обладают общими свойствами с неорганическими кислотами. Эти свойства обусловлены ионом водорода карбоксильной группы (-COOH).
2. Карбоновые кислоты обладают и специфическими свойствами, характерными только для органических кислот.
IV. Закрепление изученного материала.
1.Устный опрос (слайд 41)
1.1 Какие свойства являются общими для неорганических и органических кислот?
1.2 Какая реакция называется реакцией этерификации?
1.3 Наличие какой группы в молекуле карбоновых кислот обуславливает рассмотренные химические свойства?
1.4 Как называются соли муравьиной и уксусной кислот?
2.Контролирующий тест в виде презентации (слайд 42).
3.Письменная работа
3.1 Какую реакцию осуществила Клеопатра. Какое соединение она принимала? Написать уравнение соответствующей реакции (слайд 43).
3.2 Написать уравнения реакций взаимодействия муравьиной кислоты с магнием, оксидом кальция, гидроксидом натрия, силикатом натрия. Дать названия продуктам реакций (слайд 44).
V. Рефлексия
Продолжите фразу (слайд 45):
Сегодня на занятии я узнал …
Теперь я могу …
Было интересно …
Полученные знания я смогу применить…
VI. Подведение итогов
1.Заполнение оценочных листов (слайд 46). Оценка складывается из баллов по 5 пунктам.
Обучающиеся выставляют баллы в оценочные листы (приложение №2) и сдают их преподавателю.
Усвоение учебного материала (слайд 47)
Если считать, что полное усвоение учебного материала урока соответствует дистанции,
А_____________________________________________В
то покажите точкой ваше место нахождения.
2.Сообщение о реализации цели учебного занятия (слайд 48), выставление оценок, информация о домашнем задании (слайд 49).
 Домашнее
задание:
Домашнее
задание:
Задание для I группы «Что скрывает буква Е- на этикетках?...» (Е-260, Е-200, Е-210 и т.д.). Составить краткое сообщение.
Задание для II группы. Выполнить творческое задание в программе «MS Power Point» (подготовить презентацию - не более 10 слайдов) по теме: «Химические свойства карбоновых кислот».
Задание для III группы. Составить кроссворд по теме «Химические свойства карбоновых кислот»
Задание для IV группы. Решить задачи:
1.Ацетат кальция, полученный при взаимодействии уксусной кислоты с гашеной известью, один ученик решил высушить в пламени спиртовки. Правильно ли он поступил? Обоснуйте свой ответ, подтвердите его уравнением реакции.
2.Юный химик поместил в пробирку гранулу цинка и прилил разбавленную серную кислоту. Затем добавил ацетат натрия. Выделение пузырьков газа резко уменьшилось. Как можно объяснить это явление?
5. http://www.xumuk.ru/encyklopedia/1894.html
7. Хисматулина Е. В. Тест-презентация по теме: "Химические свойства карбоновых кислот, http://www.uchportal.ru/load/70-1-0-9508, 2010г.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.