
24.11.2020. химия 8 класс
Параграф 16
вспомним
- Что изучает химия? (Вещества, свойства и превращение веществ.)
- Рассмотрим реакцию взаимодействия водорода и кислорода:
2Н2 + О2 = 2Н2О
Как нужно отмерить водород и кислород, чтобы они полностью прореагировали и образовали воду?
(Нужно взять на одну молекулу кислорода две молекулы водорода.)
- Но технически это выполнить невозможно из-за малого размера молекул. Как быть?
А если взять столько граммов водорода, сколько весят 2 его молекулы, т.е. массой 4 г. Соответственно кислорода взять 32 г, т.е. какова его молекулярная масса. Тогда поставленное вначале условие будет соблюдено - все молекулы водорода и все молекулы кислорода прореагируют друг с другом и образуют воду.
Потому вещество решили измерить единицей, в которой как бы соединились две величины - число молекул и масса вещества.
Такая единица называется моль (n).
Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная молекулярная масса вещества:
1 моль Н2 весит 2 г (Мr (Н2) = 2)
1 моль О2 весит 32 г (Мr (О2) = 32)
1 моль Н2О весит 18 г (Мr (Н2О) = 18)
А сколько реальных частиц - молекул содержится в 1 моле любого вещества?
Очевидно, что одинаковое число. Оно называется постоянной Авогадро.
1 моль вещества равен количеству вещества, содержащему столько структурных частиц данного вещества, сколько атомов содержится в 12 г. изотопа углерода 12С, а именно 6,02 x 1023. Величину 6,02 x 1023 называют постоянной Авогадро и обозначают NA, по имени ученого, который впервые использовал эту величину.
Количество вещества обозначается буквой n («эн»)
МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Примеры:
1 моль (1 М) воды = 6,02.1023 молекул Н2О,
1 моль (1 М) железа = 6,02.1023 атомов Fe,
1 моль (1 М) хлора = 6,02.1023 молекул Cl2,
1 моль (1 М) электронов е- = 6,02.1023 электронов е-.
Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием.
Разумеется, если мы увеличим или уменьшим взятое нами количество водорода и кислорода в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз.
Как мы видим, масса одного моля какого-нибудь вещества (в граммах) числено совпадает с молекулярной или атомной массой этого вещества (в а.е.м. или в безразмерном выражении - как в случае относительной атомной или молекулярной массы). Это очень удобно для химических расчетов.
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она обозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
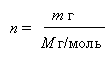
Например, число молей в m г воды составляет: n = m/18. Для m г металлического натрия: n = m/23, и так далее.
Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой - если вещество состоит не из молекул, а из атомов). х веществ.
Как мы видим, термины "молекулярная масса" и "молярная масса" применимы не только к веществам молекулярного строения, но и к атомарным и ионным веществам. Молярная масса М – постоянная величина для каждого конкретного вещества. Без неё не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Термины “моль” и “молекула” отдаленно связаны между собой. Моль происходит от латинского moles, что означает количество, счетное множество, а также масса. Термин “молекула” является уменьшительной формой этого слова и означает “маленькая масса”. Таким образом моль – это такое количество вещества, которое можно считать “большой массой”, состоящей из 6,02* 1023 “маленьких масс”.
Историческая справка
Амедео Авогадро (1776—1856) — итальянский физик и химик, член Туринской АН (1819). Родился 9 августа 1776, в Турине. Скончался 9 июля 1856, там же.
Получил юридическое образование в Туринском университете (1792). В 1800 начал самостоятельно изучать физику и математику. С 1806 Амедео Авогадро работал демонстратором в колледже при Туринской академии. С 1809 — профессор в колледже Верчелли, в 1820-1822 и 1834-1850 заведовал кафедрой математической физики в Туринском университете. Основные работы Амедео Авогадро посвящены молекулярной физике.
В 1811 он выдвинул молекулярную гипотезу строения вещества, установил один из газовых законов, названный его именем. Согласно этому закону в одинаковых объемах газов при одинаковых значениях температуры и давления содержится одинаковое количество молекул. Исходя из этого, ученый разработал метод определения молекулярного и атомного весов.
Именем Авогадро названа универсальная постоянная — число молекул в одном моле идеального газа (число Авогадро). Амедео установил количественный атомный состав молекул некоторых веществ, для которых он ранее был определен неправильно (вода, водород, кислород, азот, оксиды азота, хлора и др. ). Первым обратил внимание на аналогию в свойствах азота, фосфора; мышьяка и сурьмы.
Рассмотреть решение задач по новой теме на стр. 95 (задача 1, задача 2)
Закрепление (решитьзадачи).
Задача 1. Какова масса 0,5 моль оксида углерода (IV) СО2?
Задача 2. Какое количество серной кислоты содержится в 294 г её?
Работа в парах
Цель: закрепить понятие "моль", "количество вещества", "число Авогадро".
1. На весах взвесили кусочек цинка - его масса оказалась 26 г. Вычислите:
а) количество вещества цинка в кусочке;
б) число атомов цинка.
2. С помощью мензурки отмерили 50 мл воды. Сколько здесь молекул воды? Атомов водорода? Атомов кислорода?).
3. Имеется 7 моль cерной кислоты. Сколько молекул серной кислоты в этой порции?
4. Какое количество вещества составляют 3 x 1023 атомов серы;
5. В какой порции углекислого газа и во сколько раз больше молекул?
а) 1 моль и 0,5 моль;
Домашняя работа: §16 задачи, 2, 3.( на выбор, но не менее одной из номера)
Задачи ( по желанию) .
1. Рассчитайте с точностью до целых чисел молекулярный вес (а.е.м) и молярную массу (г) для следующих веществ: КI, N2, NaOH, SO3. Сколько молекул содержится в 1 моли каждого из этих веществ?
2. Сколько молей водорода содержится в 362г водорода?
3. В стакан налили 180 г воды. Сколько молекул воды в стакане? Сколько это молей H2O?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.