
Кубанский медицинский институт
Кафедра функциональных дисциплин
А.П. парахонский
ТИПОВЫЕ НАРУШЕНИЯ
ОБМЕНА ВЕЩЕСТВ
МАТЕРИАЛЫ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО патологическОЙ ФИЗИОЛОГИИ
учебно-МетодИческое пособие
ДЛЯ СТУДЕНТОВ ЛЕЧЕБНОГО, ПЕДИАТРИЧЕСКОГО И СТОМАТОЛОГИЧЕСКОГО ФАКУЛЬТЕТОВ медицинских вузов
Краснодар
2020
типовые нарушения обмена веществ
Обмен веществ – это сложная система химических реакций, связанных между собой через пластические компоненты, энергетическое обеспечение и регуляторы. Целью этих реакций являются извлечение энергии, получение структурных блоков и синтез полимеров, строение которых соответствует индивидуальной генетической программе организма, создание и инактивация сигнальных молекул и разрушение полимерных соединений, не отвечающих индивидуальной генетической программе.
Для регуляции обмена веществ в процессе эволюции сформировались различные механизмы, среди которых есть генетически обусловленные механизмы внутриклеточной саморегуляции, основанные на принципе обратной отрицательной связи и более сложные нервно-гормональные механизмы. Обмен веществ или метаболизм в организме определяется наследственными факторами.
Нарушения обмена могут быть наследственно обусловленными или возникать в результате нарушения регуляции. Нарушения обмена могут возникать на всех уровнях биологической организации ‑ от молекулярного до организменного. На клеточном уровне они связаны с нарушениями механизмов саморегуляции. В норме, если увеличение концентрации какого-нибудь продукта обмена становится выше допустимой нормы, то включаются ферментные системы, блокирующие предыдущий этап метаболизма и обмен веществ восстанавливается. Ведущая роль в осуществлении внутриклеточной саморегуляции принадлежит генетической информации. Большинство наследственных дефектов обмена веществ – это энзимопатии. Их развитие обусловлено мутацией генов, обеспечивающих синтез ферментов, контролирующих обмен веществ.
Суть энзимопатий состоит в том, что ферментный блок, обеспечивающий синтез того или иного вещества не синтезируется или синтезируется с измененной структурой. Это изменяет его активность. При снижении активности фермента накапливаются промежуточные вещества обмена, а при усилении активности накапливается избыточное количество конечного продукта обмена.
Наряду с внутриклеточными механизмами саморегуляции обмена организм располагает и более сложными механизмами регуляции – это нервно-гормональные механизмы регуляции. Между внутриклеточными механизмами саморегуляции и нервно-гормональной регуляцией имеется тесная связь и нарушение любого из этих механизмов сопровождается развитием патологии.
Нарушения энергетического обмена
Нарушения обмена энергии лежат в основе большинства функциональных и органических нарушений органов и тканей. Нормальное течение обменных процессов на молекулярном уровне обусловлено взаимодействием процессов анаболизма и катаболизма.
Анаболизм – это ферментативный синтез клеточных компонентов, совершающийся с потреблением энергии.
Катаболизм – это ферментативное расщепление пищевых и собственных молекул с освобождением заключенной в них энергии. Катаболизм может осуществляться внеклеточно с помощью пищеварительных ферментов и внутриклеточно при участии лизосомальных гидролаз. Катаболизм – трехэтапный процесс, каждый из которых приводит к освобождению энергии.
Первый этап – гидролитический – осуществляется в ЖКТ и в лизосомах без участия кислорода и приводит к освобождению энергии, которая не запасается, а рассеивается в виде первичной теплоты.
Второй этап – бескислородное цитоплазматическое расщепление субстратов – приводит к освобождению энергии, часть из которой (40%) запасается в фосфатных связях макроэргов, а часть первично рассеивается. В анаэробных условиях единственным источником энергии являются углеводы.
Третий этап – аэробный этап метаболизма – в зависимости от регулируемой степени сопряжения окисления и фосфорилирования приводит к освобождению энергии, значительная часть которой (66%) запасается в виде макроэргических соединений, но и на этом этапе часть энергии рассеивается.
Затраты энергии необходимы организму для поддержания жизнедеятельности и выполнения всех видов полезной работы (Э. Шредингер, 1972 г.):
- Механической – для сокращения мышц и цитоскелета;
- Осмотической – для создания и поддержания градиентов ионов;
- Электрической – для создания потенциалов действия.
При любом виде работы часть освобождаемой в организме энергии рассеивается и превращается во вторично рассеянную теплоту. Кроме работы, энергия требуется для обеспечения анаболических процессов и биосинтеза. Итак, энерготраты организма определяются суммой первично рассеянной энергии (30% всей свободной энергии пищи), вторично рассеянного тепла и затрат энергии на анаболизм.
Внутриклеточному распаду подвергаются собственные макромолекулы, имеющие структурные изменения, возникшие в результате нарушения их синтеза или появившиеся в результате других повреждений. Продукты их распада используются клеткой для синтеза других компонентов. Генетическая недостаточность лизосомальных ферментов приводит к возникновению болезней накопления тезаурисмозов (мукополисахаридозы, гликогенозы и др.).
Примером внеклеточного распада макромолекул является протеолиз, процесс, который обеспечивает повышение функциональной активности ферментов, гормонов, нуклеиновых кислот, первоначально синтезирующихся в виде предшественников. Например, проинсулин превращается в инсулин или фибриноген превращается в фибрин. Ферментативный процесс такого типа называется ограниченным протеолизом. Характерным примером его является функционирование каскадных систем: системы комплемента, свертывания крови, фибринолиза, кининовой системы.
Наиболее эффективным в энергетическом отношении является окисление продуктов обмена в цикле Кребса, ферменты которого локализованы в митохондриях, менее эффективным является гликолиз.
Около 55% энергии окисления глюкозы накапливается в макроэргических связях аденозинтрифосфаторной кислоты (АТФ) и используется для обеспечения функций клетки или пластических процессов в ней. Остальная часть энергии является источником теплообразования.
При нарушении катаболизма прежде всего страдает процесс восстановления АТФ и поступления компонентов, необходимых для осуществления процессов анаболизма. Повреждение анаболических процессов приводит к нарушению образования ферментов и гормонов, необходимых для осуществления катаболизма. Наиболее выраженные нарушения катаболизма наблюдаются при повреждении системы биологического окисления или механизмов сопряжения дыхания и фосфорилирования. Ослабление гликолитических процессов при сахарном диабете нарушает использование углеводов, это ведет к гипергликемии (накопление сахара в крови), переключению обмена веществ на жиры и белки. При этом нарушается процесс адаптации к гипоксии.
Степень сопряжения дыхания и фосфорилирования в клетках является регулируемым процессом, связанным с состоянием митохондрий, в составе которых есть контрактильные белки, которые обеспечивают возможность активного «сокращения» или «набухания» митохондрий. В период набухания ферментные системы, переносящие электроны в дыхательной цепи, отделяются от ферментных систем фосфорилирования. В результате увеличивается доля окисления и продукция тепла увеличивается. При этом повышается проницаемость митохондрий и увеличивается выход ферментов, ускоряющих гликолиз. При действии холода организм нуждается в срочном теплообразовании. Это происходит путем разобщения окисления и фосфорилирования. К разобщающим факторам относятся тироксин, гормон роста, вазопрессин, дифтерийный токсин, живые и убитые культуры золотистого стафилококка.
Окислительное фосфорилирование нарушается при авитаминозах, особенно группы В, так как витамины этой группы необходимы для синтеза дыхательных ферментов. При болезни бери-бери, вызванной отсутствием или недостаточностью тиамина (витамина В), нарушается биологическое окисление в мозге, что клинически проявляется судорогами и развитием психоза.
Биоэнергетические процессы нарушаются при многих вирусных заболеваниях, например, вирусном гепатите, так как вирус для своего роста использует ряд жизненно важных веществ (АТФ, рибонуклеиновая кислота и др.). Глубокие нарушения энергетического обмена наблюдаются при диабете, так как значительно уменьшается выработка макроэргических соединений.
Нарушения основного обмена
Основной обмен – это количество энергии, которая необходима для поддержания жизни организма в состоянии полного покоя натощак (через 12-18 часов после последнего приема пищи) и при температуре окружающей среды 16-18оС.
Почему важно соблюдать оговоренные условия определения основного обмена? Температурный комфорт важен потому, что и охлаждение, и перегревание организма сопровождаются расходом энергии, необходимой для поддержания постоянства температуры тела. Натощаковый принцип определения основного обмена важен потому, что еще А. Лавуазье отметил, что прием пищи вызывает повышение термогенеза, которое начинается через 15-30 мин, достигает максимума через 3-6 ч и продолжается 12 ч. Этот феномен называется специфическим динамическим действием пищи (СДД). В настоящее время распространено другое определение – теплопродукция, индуцированная диетой (ТИД).
В этом феномене участвуют два компонента. Один из них обязательный несвязанный с особенностями характера употребляемых пищевых продуктов. Этот компонент одинаковый для всех пищевых субстратов. Он обусловлен активацией функций ЖКТ при приеме пищи. Другой – необязательный, связанный с характером употребляемого пищевого продукта и обусловлен сигнальным действием этого продукта и его особенностями. Наивысшее СДД характерно для белков. При их употреблении энерготраты возрастают на 30-40%. Употребление углеводов увеличивает энерготраты на 5-6%, а употребление жиров повышает энерготраты всего на 2-2,5%.
Тот факт, что СДД сохраняется при мнимом кормлении, когда пища не попадает в ЖКТ, а выходит через фистулу пищевода, говорит о рефлекторном механизме этого феномена (И.П. Павлов, И.В. Рязанцев, 1892), который обусловлен действием секретина и холецистокинина на теплорегуляторные центры гипоталамуса (А.М. Уголев, 1991).
У взрослого человека среднего роста и массы основной обмен составляет 1600-1785 ккал/сут. Велика ли эта цифра? Оказывается, это немало. Если одной калории достаточно, чтобы нагреть при нормальных условиях 1 г воды от 15 до 16°С, значит даже ничего не делая, мы выделяем за сутки энергию, способную вскипятить более 20 литров воды. Таким образом, даже в состоянии полного покоя, каждый из нас остается мощным потребителем энергии. С точки зрения биоэнергетики, жить – уже значит работать.
У детей основной обмен выше, чем у взрослых (особенно в возрасте 5-6 лет), у женщин на 5-7 % ниже, чем у мужчин. У коренных жителей Севера выше, а у жителей районов с жарким климатом – ниже средней величины. Повышение обмена отмечено зимой, а понижение летом. Основной обмен повышен у людей, питающихся преимущественно мясной пищей. У лиц физического труда он выше, чем у людей умственного труда.
Вклад в основной обмен вносят сердечная деятельность, перистальтика кишечника, работа систем дыхания, поддержание электрических процессов в клетках, терморегуляция, энергорассеяние, сопровождающее анаболизм. Но основной вклад в основной обмен вносит электрохимическая работа.
Каждая клетка имеет плазматическую мембрану и пока она жива, даже при глубоком покое, на мембране поддерживается калий-натриевый градиент, потенциал покоя, а при функционировании клеток – генерируется потенциал действия. Работа только одного фермента – натрий-калиевой АТФазы, находящейся на всех клетках, отвечает за 30% энергозатрат организма при полном покое. Поэтому регуляторы, которые влияют на активность этого фермента, будут изменять основной обмен.
Особую роль в регуляции основного обмена играет гормон щитовидной железы – тироксин, который является основным регулятором интенсивности энергетического обмена. Это связано с тем, что тиреоидные гормоны – самые сильные из всех известных активаторов работы калий-натриевой АТФазы во всех тканях, особенно – в печени, почках, скелетных мышцах, жировой ткани.
Повышение основного обмена является важным диагностическим признаком тиреотоксикоза (повышения функции щитовидной железы), а снижение свидетельствует о гипофункции этой железы.
Соматотропный гормон гипофиза стимулирует окисление и тем самым повышает теплообразование, этим объясняется усиление энергетических процессов при опухолях гипофиза. При гипофункции гипофиза уменьшается продукция тиреотропина и кортикотропина, что приводит к снижению теплопродукции и основного обмена.
Выраженным стимулирующим действием на основной обмен обладает адреналин, инсулин, наоборот, снижает основной обмен. У людей, страдающих аддисоновой болезнью (туберкулезное поражение надпочечниковых желез) энергетические процессы угнетаются. Половые гормоны способствуют освобождению энергии. При гипофункции половых органов (кастрация, климакс, недоразвитие) интенсивность энергетических процессов снижается, основной обмен падает, при этом нередко развивается ожирение.
Повышение основного обмена наблюдается при:
- тиреотоксикозе – гиперфункции щитовидной железы;
- базофильной аденоме гипофиза;
- болезни Кушинга (нарушение функции коры надпочечников);
- лихорадке;
- злокачественных новообразованиях;
- болезни Вакеза (эритремия – увеличение количества эритроцитов);
- болезни Аддисона-Бирмера (В12 дефицитная анемия);
- усилении сердечной деятельности и дыхания.
Понижение основного обмена наблюдается при:
- гипофункции щитовидной железы;
- туберкулезном поражении коркового вещества надпочечников (бронзовая болезнь Аддисона);
- гипофункции половых желез;
- расстройстве функций центральной нервной системы (депрессивные состояния, шизофрения);
- анорексии
- (отсутствие аппетита любого происхождения);
- авитаминозах;
- алиментарной дистрофии (неполное голодание).
Методы определения основного обмена
Определение основного обмена называется калориметрией. Существуют 2 метода калориметрии – прямая и непрямая.
Метод прямой калориметрии основан на прямом определении количества калорий выделяемых человеком в специальной камере (калориметре). Количество калорий вычисляется путем определения нагревания воды, находящейся в стенках калориметра. Первый калориметр был создан в XIX веке В.В. Пашутиным. Достоинством прямой калориметрии является ее точность. Однако макрокалориметр – громоздкое и неудобное сооружение.
Во второй половине XX века метод прямой калориметрии был модифицирован и был создан метод реакционной калориметрии. В этой разновидности прямой калориметрии используются не целостный организм, а его отдельные клетки – кровь, эритроциты, лейкоциты, биоптаты тканей. Микрокалориметрическая ячейка термостатирована и окружена высокотеплопроводными термопарами – сплавами разных металлов. Тепловой поток, создаваемый жизнедеятельностью помещенных в нее клеток, идет через термопары наружу и их нагревает, что приводит к разности потенциалов, пропорциональной разности температур. Эта электродвижущая сила регистрируется вольтметром и записывается в виде пика магнитным самописцем.
Метод непрямой калориметрии основан на определении количества поглощаемого кислорода и выделяемой углекислоты в единицу времени. Количество поглощаемого кислорода переводится в килокалории с помощью специальных номограмм. Калорическая ценность одного литра поглощенного кислорода зависит от величины дыхательного коэффициента. Последний изменяется в зависимости от состава употребляемой пищи. Наибольшая калорическая ценность 1 литра кислорода наблюдается при преимущественном питании углеводами. Дыхательный коэффициент при таком питании приближается к единице. Белковая и жировая пища характеризуется снижением калорической ценности поглощенного кислорода и снижением дыхательного коэффициента.
Нарушения обмена белков
Белок – важнейший пластический компонент диеты, незаменимый источник биогенного азота, необходимый для роста и регенерации. Белок – носитель чужеродной антигенной инфекции и поэтому должен расщепляться при переваривании, чтобы утратить антигенность. Неполное расщепление приводит к чрезкишечной сенсибилизации и развитию пищевой аллергии. Белки выполняют каталитические и распознающие функции и реализуют в виде обмена веществ индивидуальные генетические программы. Белки не депонируются в организме. При пищевом их дефиците мобилизуются белки мышц, кожи, костей, а при тяжелых состояниях – паренхиматозных органов (мозга – в последнюю очередь). При избытке пищевого белка дополнительные аминокислоты подвергаются энергетической утилизации.
По данным комитета экспертов ФАО-ВОЗ для взрослых минимальный балансовый уровень приема азота с пищей, с учетом различной усвояемости растительных и животных белков, составляет не менее 77 мг/кг массы тела в сутки – при смешанной, и 93 мг/кг массы тела в сутки – при вегетарианской диете.
Наиболее частой причиной нарушения белкового обмена является количественная или качественная белковая недостаточность первичного экзогенного происхождения. Возникающие дефекты обусловлены ограничением поступления белков с пищей при полном или частичном голодании, низкой биологической ценностью пищевых белков; дефицитом незаменимых аминокислот (аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин).
Вторичная эндогенная недостаточность белкового обмена наблюдается при:
- нарушении переваривания и всасывания белковых продуктов (гастроэнтериты, язвенный колит);
- повышенном распаде белков в тканях (стресс, инфекционные болезни);
- усиленной потере белков (травмы, кровопотери, заболевания почек);
- нарушении синтеза белков (гепатит).
В норме у взрослого человека поступление и выведение азотистых продуктов уравновешено. Это называется азотистым равновесием.
Если продукция азотистых соединений превышает их выведение, то это называется положительным азотистым балансом. Положительный азотистый баланс наблюдается не только в норме (в растущем организме, при беременности, лактации, интенсивной регенерации), но и при патологии (избыточная выработка гормонов анаболизма: соматотропин – гормон гипофиза, половые гормоны, инсулин; полицитемии, массивные доброкачественные опухоли).
Если распад и выведение азотистых соединений превышает их синтез и поступление с пищей, то это называется отрицательным азотистым балансом. Отрицательный азотистый баланс наблюдается при голодании; потере белков через почки (протеинурия), кожу (ожоги), кишки (понос), при тиреотоксикозе, при инфекционной лихорадке, инсулинозависимом сахарном диабете, стресс-реакциях, гиперкортицизме. Нарушения белкового обмена возможны на всех этапах, начиная с всасывания и кончая выведением из организма конечных продуктов обмена.
Нарушения расщепления и всасывания белков
В пищеварительном тракте белки расщепляются протеолитическими ферментами и всасываются в тонком кишечнике. Различают первичные (хронический гастрит, язвенная болезнь, рак) и вторичные (расстройства секреторной и всасывательной функции эпителия желудка и кишечника) нарушения переваривания белков и всасывания аминокислот в желудочно-кишечном тракте.
Основные причины недостаточности расщепления белков:
- снижение секреции соляной кислоты;
- снижение активности протеолитических ферментов (пепсин, трипсин,
- химотрипсин) и связанное с этим недостаточное образование аминокислот;
- ускорение перистальтики кишок.
В этих условиях часть белка переходит из желудка в двенадцатиперстную кишку в неизмененном виде, что затрудняет действие протеолитических ферментов.
Недостаточное образование аминокислот из пищевых продуктов наблюдается при ограниченном поступлении в кишечник секрета поджелудочной железы, что наблюдается при ее воспалении (панкреатит) или сдавлении и закупорке протоков. Недостаточность функции поджелудочной железы вызывает дефицит трипсина и химотрипсина, что снижает интенсивность всасывания пищевых продуктов.
Недостаточное действие пищеварительных ферментов на белки наблюдается при:
- усилении перистальтики кишечника;
- воспалении тонкого кишечника;
- уменьшении площади всасывания при оперативном удалении
- значительных участков тонкого кишечника.
Причинами нарушения всасывания аминокислот являются: повреждение стенки тонкого кишечника (отек слизистых или воспаление); неравномерное по времени всасывание отдельных аминокислот. Это ведет к нарушению соотношения аминокислот в крови и нарушению синтеза белка, так как незаменимые аминокислоты должны поступать в организм в определенных количествах и соотношениях.
Если не поступает валин, то наблюдаются нарушения в центральной и периферической нервной системе. При недостатке метионина развивается жировое перерождение печени. Недостаток лизина (особенно в растущем организме) задерживает рост и общее развитие, понижает содержание в крови гемоглобина и эритроцитов. При недостатке триптофана развивается железодефицитная (гипохромная) анемия. Дефицит аргинина приводит к нарушению сперматогенеза, а гистидина – к развитию экземы, отставанию в росте, угнетению синтеза гемоглобина.
Недостаточное переваривание белка в верхних отделах желудочно-кишечного тракта сопровождается переходом продуктов его неполного расщепления в толстый кишечник и усилением процессов бактериального расщепления аминокислот. Это ведет к увеличению образования ядовитых ароматических соединений (индол, скатол, фенол) и развитию интоксикации организма этими соединениями.
Всосавшиеся из кишечника аминокислоты поступают в кровь и частично в лимфатическую систему, представляя собой тот «метаболический фонд» разнообразных азотистых соединений, которые участвуют во всех видах обмена. В норме циркулирующие в крови аминокислоты быстро поглощаются печенью, частично почками, сердцем, мышцами. Увеличение продолжительности циркуляции аминокислот в крови указывает на нарушение способности тканей и органов и в первую очередь печени поглощать аминокислоты.
Нарушение синтеза белков наблюдается при всех видах алиментарной недостаточности (полное, неполное голодание, отсутствие в пище незаменимых аминокислот). Нарушение скорости синтеза белка может быть обусловлено повреждением генетического аппарата, которое может быть, как наследственным, так и приобретенным, возникающим под влиянием мутагенных факторов (ионизирующее излучение и др.). Нарушение синтеза белка могут вызвать антибиотики (стрептомицин, неомицин, тетрациклин). Одной из причин, вызывающих нарушение синтеза белка может быть нарушение регуляции этого процесса со стороны нервной и эндокринной систем.
Количественные изменения синтеза белков приводят к изменению их соотношения в крови – диспротеинемии. Различают две формы диспротеинемии: гиперпротеинемию и гипопротеиниемию.
Гипопротеинемия (уменьшение белка в крови) бывает при:
- белковом голодании;
- потерях белка при заболеваниях почек;
- кровопотерях;
- массивных отеках (70% альбумина может скапливаться в отечной жидкости);
- ускоренном распаде белка (злокачественные опухоли, некрозы в связи с нарушением кровообращения);
- тяжелых заболеваниях печени;
- комбинированных нарушениях.
При ожогах наблюдается усиленный распад белка, его выведение с мочой и угнетение синтеза из-за нарушения функций центральной нервной системы.
При гипопротеинемии снижается содержание белка в крови до 3-5 % (норма 6,5-8 %).
При гипопротеинемии наблюдаются:
- нарушения свертывания крови;
- нарушение синтеза гемоглобина;
- падение коллоидно-осмотического давления крови;
- нарушение иммунологических процессов.
Для всех видов гипопротеинемии характерно падение содержания в крови альбуминов и компенсаторное увеличение количества глобулинов. В норме соотношение концентрации альбумина к глобулинам (альбумино-глобулиновый коэффициент) равно 2,0.
Гиперпротеиниемия (увеличение белка в крови) наблюдается при:
- синтезе качественно измененных белков (при ревматизме,
- инфекционном миокардите синтезируется С - реактивный белок);
- синтезе патологических белков. Например, при болезни Вальдемстрема или миеломной болезни Рустицкого-Кейлера появляются криоглобулины, которые выпадают в осадок при температуре +4оС, а
- при температуре +37оС вновь растворяются. При этом в моче появляется белок Бенсджонса, который при температуре +35-40о свертывается в моче, а при кипячении вновь растворяется;
- искусственной иммунизации.
Конечными продуктами белкового обмена являются аммиак и мочевина. Связывание и обезвреживание аммиака осуществляется двумя механизмами: в печени – путём образования мочевины, в других тканях – путём присоединения аммиака к глутаминовой кислоте с образованием глутамина.
Нарушение образования мочевины наступает в результате снижения активности ферментов, участвующих в этом процессе, например, при гепатите и циррозе печени. При нарушении образования мочевины в крови и тканях накапливается аммиак, развивается интоксикация аммиаком. В основе нарушения образования мочевины могут лежать наследственные дефекты ферментов.
Другим конечным продуктом белкового обмена, образующимся при окислении креатина (азотистое вещество мышц), является креатинин. Нормальное суточное содержание креатинина в моче составляет 1-2 грамма.
Креатинурия – увеличение креатинина в моче наблюдается: у беременных и у детей в период интенсивного роста.
При голодании, авитаминозе Е, инфекционных заболеваниях, тиреотоксикозе и других заболеваниях, сопровождающихся изменением обмена в мышцах, креатинурия свидетельствует о нарушениях обмена креатинина. При нарушении выделительной функции почек происходит задержка мочевины, креатинина, мочевой кислоты и других азотистых соединений в крови развивается азотемия.
В норме общее количество небелкового азота в плазме, так называемого остаточного азота, составляет 30-40 мг % или 7,1 – 12,4 ммоль/л. Половина его приходится на долю мочевины.
Мочевая кислота – это конечный продукт обмена пуриновых оснований, входящих в структуру нуклеиновых кислот. Нарушение образования мочевой кислоты наблюдается при заболеваниях почек, лейкозах, подагре. К подагре существует предрасположение в виде наследуемого повышения уровня мочевой кислоты в крови и, изменения содержания факторов, поддерживающих ее в растворенном состоянии.
Факторами риска развития подагры являются:
- избыточное поступление пуринов в организм (употребление с пищей большого количества мяса, особенно с пивом и вином);
- поступление большого количества молибдена;
- пол (у мужчин чаще развивается подагра, чем у женщин);
- пожилой возраст, для которого характерно повышение содержания мочевой кислоты в моче (гиперурикемия).
Гиперурикемия может сопровождаться отложением солей мочевой кислоты в суставах и хрящах, где в силу слабого кровоснабжения есть наклонность к закислению среды, что способствует выпадению солей в осадок. Отложение солей вызывает острое подагрическое воспаление, сопровождающееся болью, лихорадкой, аллергическими проявлениями и заканчивающееся образованием подагрических узлов и деформацией суставов.
Нарушения липидного обмена
Липиды – большая группа органических соединений, в состав которых входят сложные эфиры высших жирных кислот. Липиды не растворяются в воде, но растворяются в органических растворителях (эфир, бензол, ацетон и др.).
Липиды разделяются на две группы:
- простые липиды ‑ жирные кислоты, глицериды (триглицериды, т.е. нейтральные жиры), липоспирты (холестерин, ретинол, кальциферол), эфиры холестерина, воски (ланолин, спермацет);
- сложные липиды (фосфолипиды, гликолипиды).
Суточная потребность в жирах 80-100 г. при сгорании 1 г жира образуется 9,3 ккал.
Функции липидов
Структурная (мембранообразующая) функция, связанная с метаболизмом глицерофосфолипидов.
Резервно-энергетическая функция, обеспечиваемая триглицеридами.
Рецепторно-посредниковая функция обеспечивается гликосфинголипидами.
Регуляторно-сигнальная функция обеспечивается липидными спиртами (стероидами).
мембранообразующая функция важна для всех видов обмена веществ, т.к. фосфолипиды вместе с холестерином и мембранными белками выполняют барьерную функцию и регулируют активный трансмембранный перенос веществ. При любом повреждении клеточных мембран сами они служат источником биологически активных веществ – эйкозаноидов, контролирующих местные типовые патологические процессы, развивающиеся в ответ на повреждение.
Резервно-энергетическая функция выполняется триглицеридами. Жир является основным энергетическим ресурсом организма. Чтобы запасти 10 ккал энергии достаточно запасти 1,3 г жира. Из общего количества жира в 10-12 кг около 2 кг распределено в виде включений в тканях организма. Остальной жир находится в адипоцитах, половина в подкожно-жировой ткани, а другая половина в сальнике. Это количество жира дает от 75000 до 90000 ккал и может покрыть минимальные энергетические нужды организма в течение 40 дней, например, при голодании. Скопления нейтрального жира играют и дополнительную защитную роль: теплосберегающую, водоотталкивающую, механическую (например, фиксируют почки, депонируемый спермацет на голове кашалота позволяет ему наносить механические таранящие удары и избегать при этом сотрясения мозга), электроизоляционную.
Рецепторно-посредниковая функция. Гликолипиды участвуют в распознавании химических сигналов и их доведении до внутриклеточных эффекторов. В осуществлении этой функции участвуют сложные липиды. Их роль определяется тем, что они входят в состав клеточных рецепторов. Благодаря сложным липидам рецептор фиксируется в мембране. Гликолипиды участвуют в определении иммунологических свойств клеточных мембран.
Роль передатчиков сигналов в клетке выполняют липидные посредники, например, простагландины. Липидные посредники играют большую роль в осуществлении ответа на гормональную стимуляцию. Они опосредуют действие многих факторов роста. Именно поэтому они могут действовать в качестве коканцерогенов, хотя и не являются мутагенами.
Регуляторная функция. Липиды регулируют проницаемость мембран, их коллоидное состояние и текучесть, активность липидозависимых ферментов (Na+, K+-АТФаз, Ca2+-АТФазы, цитохромоксидазы), активность мембранных рецепторов (для катехоламинов, ацетилхолина, инсулина, цитокинов).
Такие липидные посредники как простагландины, лейкотриены, стероидные гормоны регулируют функции клеток, органов и тканей.
Регуляторно-сигнальную роль выполняют стероиды. Все стероидные гормоны являются производными холестерина, кроме того, холестерин является предшественником желчных кислот. Это говорит о том, что холестерин не яд, а нужный, в меру безвредный метаболит. Суточное потребление холестерина 0,2-0,5 г. одновременно 0,5 г холестерина окисляется в желчные кислоты, столько же теряется с фекалиями и около 0,1 г выделяется сальными железами. В тоже время в организме синтезируются в день более 1 г холестерина. Все клетки организма в составе своих мембран содержат холестерин и могут его синтезировать. Поэтому общее содержание холестерина в организме больше 300 г. холестерин понижает проницаемость биомембран, участвует в их барьерной функции, препятствует дезинтеграции мембран. Однако, избыток холестерина нарушает работу кальциевых насосов, поэтому в цитоплазме клеток увеличивается концентрация свободного кальция, а это опасно для клетки.
Липиды являются растворителями витаминов А, D, Е, К, участвуют в передаче нервных импульсов и создании межклеточных контактов. Ферментные комплексы, входящие в состав липидов, играют важную роль в свертывании крови, пищеварении, иммунных процессах. Недостаток липидов приводит к нарушению этих функций.
Организм обладает способностью синтезировать все основные липиды кроме жирорастворимых витаминов и незаменимых полиненасыщенных жирных кислот.
Патологические изменения в обмене жиров могут возникать при нарушении: процессов переваривания и всасывания жиров; транспорта липидов и перехода их в ткань; окисления липидов в тканях; промежуточного обмена; обмена липидов в жировой ткани (избыточное или недостаточное их образование и отложение); избыточном накоплении жиров в органах, не относящихся к жировой ткани (жировая инфильтрация и жировая дистрофия).
Типовые формы нарушений липидного обмена приведены в рис. 1.
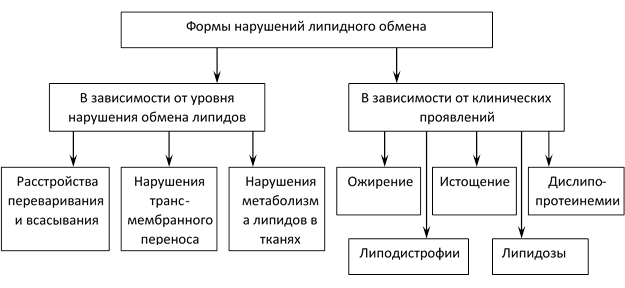
Рис. 1. Типовые формы нарушений липидного обмена (П.Ф. Литвицкий, 2016).
Нарушения переваривания и всасывания липидов
Основным местом переваривания и всасывания липидов является тонкий кишечник (С.П. Боткин, 1860). У новорожденных и грудных детей имеется активная желудочная липаза, способная переваривать эмульгированные жиры грудного молока. Этому способствуют низкая кислотность желудочного сока (pН-5) и усиление синтеза желудочной липазы при естественном вскармливании. У младенцев при сосании клетки слизистой оболочки корня языка и глотки секретируют липазу, которая продолжает свое действие в желудке. В остальных случаях эффективное переваривание пищевых липидов возможно только после превращения пищевых липидов в эмульсию.
Поступая в тонкий кишечник жир, прежде чем всосаться в кровь в виде хиломикронов, должен подвергнуться эмульгированию и расщеплению желчными кислотами, ферментами поджелудочной железы.
Нарушение расщепления и всасывания наблюдается при:
- недостатке панкреатической липазы (панкреатит, склероз, острый некроз поджелудочной железы);
- первичной мальабсорбции (целиакия, тропическая спру, другие энтериты, гиповитаминоз фолиевой кислоты);
- приёме больших количеств тугоплавких липидов (бараний жир);
- дефиците жёлчных кислот (обтурационная желтуха) или их отсутствие в кишечнике (ахолия);
- дефиците гормонов желудочно-кишечного тракта, регулирующих функцию жёлчного пузыря, процессы эмульгирования, расщепления жиров и их транспорта через кишечную стенку (холецистокинин, гастрин);
- усиленной перистальтике тонкого кишечника;
- избытке в пище ионов кальция и магния, что приводит к образованию нерастворимых в воде солей желчных кислот;
- авитаминозе А и В;
- недостатке холина.
В результате нарушения процессов расщепления и всасывания в каловых массах накапливаются триглицериды и высшие жирные кислоты. Кал приобретает серовато-бурый цвет (стеаторея). Стул становится частым и липким. Стеаторея может наблюдаться при недостатке холина и употреблении антибиотиков (хлортетрациклин), подавляющих липолиз; при недостаточности коркового вещества надпочечников.
Потеря организмом липидов может быть связана не только с развитием стеатореи, но и с выведением их с мочой (липидурия), а также с выходом их из депо (травма больших участков жировой ткани, костного мозга).
Нарушения транспорта жира (гиперлипемия)
В кровяное русло липиды поступают из кишечника в виде хиломикронов. Из подкожной жировой клетчатки, легких, костного мозга мобилизуются неэстерофицированные жирные кислоты, из печени липопротеиды различной плотности. В норме содержание нейтральных жиров в крови 1-2 г/л. Одним из показателей нарушения жирового обмена является гиперлипемия. Она может быть алиментарной, транспортной и ретенционной.
Алиментарная гиперлипемия – временное увеличение содержания хиломикронов в крови (состав хиломикронов: 85% триглицеридов, 8,5% - фосфолипидов 3% - холестерина, 2% белка) наблюдается при повышенном поступлении жира с пищей. Проявляется через 2-3 часа после приема жира, достигает максимума через 4-6 часов, через 9 часов уровень жира в крови нормализуется (2 ммоль/л). Это физиологическое явление.
Транспортная гиперлипемия возникает при усиленной мобилизации жира из депо, например, при обеднении печени гликогеном (голодание, стресс, сахарный диабет). Мобилизации жира из жировых депо, легких, костного мозга способствуют соматотропный и кортикотропный гормоны гипофиза, глюкагон, тироксин, адреналин. Из печени в кровь поступают липопротеиды низкой плотности, богатые холестерином, липопротеиды очень низкой плотности, главным их компонентом являются триглицериды (обе форме являются атерогенными) и липопротеиды высокой плотности в их составе много белка и фосфолипидов. Они выполняют транспортную функцию, переводя избыток холестерина из клеток, с поверхности сосудистой мембраны в печень.
Ретенционная гиперлипемия возникает при задержке перехода нейтральных жиров из крови в ткань, то есть при задержке жира в крови, например, при изменении соотношения белковых фракций крови при постгеморрагической анемии, липоидном нефрозе, атеросклерозе.
Нарушения метаболизма липидов в тканях
Поступающие в ткани жиры подвергаются окислению или депонируются. Если накопление жира происходит вне жировой ткани, то говорят о жировой инфильтрации. Сочетание инфильтрации с нарушением структуры протоплазмы жировых клеток называется жировой дистрофией.
Причины жировой инфильтрации.
Снижение активности гидролитических или окислительных ферментов, например, при отравлении мышьяком, фосфором, авитаминозах, при вирусной инфекции. Чаще всего жировая инфильтрация наблюдается в печени.
Недостаток в пище холина, метионина, других липотропных веществ приводит к развитию алипотропной жировой инфильтрации печени. К этому же приводит дефицит эндогенного липотропного фактора – липокаина, который образуется в поджелудочной железе.
Первым этапом в липидном обмене является липолиз, освободившиеся при этом жирные кислоты подвергаются b-окислению, образуя ацетил ‑ КоА. При конденсации двух его молекул образуется ацетоацетил – КоА, способный превращаться в ацетоуксусную кислоту.
Нарушение промежуточного липидного обмена приводит к повышению уровня кетоновых тел (ацетоуксусная кислота, b-гидроксимасляная кислота, ацетон) в крови (кетонемия). Кетоновые тела являются промежуточными продуктами жирового, углеводного и белкового обменов.
Причины кетоза.
Дефицит углеводов в организме. Сахарный диабет, голодание, лихорадка, тяжелая мышечная работа ведут к сокращению запасов гликогена в печени, что способствует синтезу кетоновых тел.
Стресс, при котором из-за активации симпатической нервной системы истощаются углеводные резервы организма и развивается кетоз.
Инфекционные поражения печени. Это нарушает ее способность синтезировать и откладывать гликоген.
Дефицит витамина Е замедляет окисление жирных кислот.
Окисление кетоновых тел подавляется при гистотоксической гипоксии, при диабете, при печеночной и уремической коме.
Нарушения обмена липидов в жировой ткани
Для того, чтобы адекватно распоряжаться жировыми запасами и поддерживать постоянство массы тела, жировая ткань и гипоталамус обмениваются гормональными сигналами, от которых зависят аппетит, усвоение пищи, расход энергии и вес. Жировая ткань, составляющая в норме 15-20% от массы тела у мужчин и 20-25% у женщин, не является инертным депо жира – в ней происходят интенсивные процессы обмена.
Хроническое превышение калорического содержания потребляемой пищи над энергозатратами организма приводит к накоплению триглицеридов в жировой ткани, т.е. к ожирению. Ожирение – это наклонность организма к увеличению массы тела. Масса тела увеличивается из-за избыточного накопления жира в депо.
Различают первичное и вторичное ожирение. Условием развития первичного ожирения является превышение потребления энергии над тратами. Ключевой механизм первичного ожирения состоит в нарушениях гормональной связи между жировой тканью и гипоталамусом. Из-за этих нарушений меняется пищевое поведение больного, его психология и тенденция к выбору определенного образа жизни. Первичное ожирение – это самостоятельная нейроэндокринная болезнь.
Вторичное ожирение – синдром, возникающий при наличии в организме расстройств, усиливающих запасание и ослабляющих темпы расходования триглицеридов на фоне нормальных сигнальных взаимоотношений адипоцитов и гипоталамуса. Раньше вторичное ожирение делилось на церебральные и гормональные формы. В настоящее время вторичное ожирение делят на гипоталамо-гипофизарные (центральные) формы и связанные с дисфункциями других эндокринных желез (периферические) формы.
К центральным формам относится вторичное ожирение при:
- адипозогенитальной дистрофии;
- базофильной аденоме гипофиза;
- синдроме Пархона;
- гипофизарном нанизме;
- травмах, опухолях, инсультах с повреждением гипоталамуса.
К периферическим формам относится вторичное ожирение при:
- синдроме Иценко-Кушинга;
- инсулиннезависимом диабете II типа;
- гиперинсулинизме;
- дуоденальной недостаточности в поздней фазе.
Избыточное кормление ребенка в первый год жизни способствует развитию гиперпластического ожирения (ненормальное увеличение числа жировых клеток). Это ожирение имеет плохой прогноз в отношении восстановления массы тела. Ожирение, развивающееся у детей в старшем детском возрасте – гипертрофическое (увеличение объема жировых клеток) является результатом переедания.
Переедание может быть результатом повышенного аппетита (булимия) из-за перевозбуждения пищевого центра или торможения «центра сытости». Рефлекторное возбуждение пищевого центра возможно при раздражении вкусовых окончаний полости рта (например, пряностями) и частом пробовании пищи (у поваров и кондитеров). У лиц, занимающихся тяжелым физическим трудом, повышается возбудимость пищевого центра. При переходе этих людей к образу жизни не требующего большой физической нагрузки возбудимость центра и аппетит сохраняются прежними, что ведет к перееданию.
При нормальной функции пищевого центра причиной ожирения может быть недостаточное использование жира из жировых депо.
Такое ожирение развивается при снижении тонуса симпатической или повышении тонуса парасимпатической нервной системы.
Последствия ожирения:
- понижение чувствительности к инсулину;
- гиперинсулинизм;
- гиперлипемия, гиперхолестеринемия.
Ожирение неблагоприятно отражается на жизнедеятельности организма. В молодом возрасте отрицательное действие ожирения менее выражено, чем в пожилом. Смертность среди страдающих ожирением в возрасте 20-24 года на 3%, в 40-55 лет на 50% выше, чем у лиц с нормальной массой тела. Отложение жира в миокарде снижает сократительную функцию сердца. Ожирение сопровождается развитием атеросклероза, повышением артериального давления, повышением свертываемости крови, развитием тромбоза. Развивается циркуляторная и дыхательная гипоксия.
Ожирение предрасполагает к развитию сердечно-сосудистых заболеваний, атеросклероза, образованию желчных камней, жировой инфильтрации печени, сахарному диабету.
Наследственные нарушения жирового обмена
Эссенциальная гиперлипимия характеризуется увеличением уровня триглицеридов в крови в связи с удалением липидов из крови. Генетический дефект – низкая активность липопротеидлипазы.
Семейная гиперхолестеринемия проявляется в виде атероматоза, развитием ишемической болезни сердца в молодом возрасте. Генетический дефект – отсутствие на клеточных мембранах рецепторов для липопротеидов низкой плотности.
Болезнь Вольмана проявляется в первые недели жизни рвотой, диареей со стеатореей, гепатоспленомегалией (увеличение печени и селезенки) и двусторонним кальцинозом надпочечников. Дети погибают в возрасте до 6 месяцев. Генетический дефект – отсутствие кислой липазы лизосом.
Болезнь Шюллера-Христиана характеризуется отложением жира в клетках грануляционной ткани, разрастающейся в костях и в большинстве внутренних органов. Характерны деструктивные изменения в костях.
Болезнь Гоше (цереброзидный липидоз) – отложение глюкоцереброзидов в макрофагальных клетках селезенки, печени, костного мозга.
Ведущими симптомами являются увеличение селезенки, печени, остеопороз (разряжение костной ткани).
Болезнь Нимана-Пика (сфингомиелиновый липидоз) – отложение сфингомиелина в органах. Болезнь проявляется увеличением печени, селезенки, замедлением психического развития, появлением слепоты и глухоты. Дети погибают до 2-х лет.
Амавротическая семейная идиотия – результат отложения ганглиозидов в клетках нервной системы, что сопровождается атрофией зрительных нервов и слабоумием.
Истощение и кахексия
Истощение и кахексия – патологическое снижение массы жировой ткани ниже нормы.
Этиология, виды истощения и кахексии Различают эндогенные и экзогенные причины истощения.
Экзогенные причины
Вынужденное или осознанное полное или частичное голодание.
Полное голодание – состояние, при котором в организм не поступают продукты питания (отказ от еды, невозможность приема пищи, отсутствие продуктов питания).
Неполное голодание – состояние, характеризующееся дефицитом плас
тических веществ и калорий в пище (однородная пища, неполноценное в количественном и качественном отношении питание).
Низкая калорийность пищи, не восполняющая энергозатраты организма.
Эндогенные причины подразделяют на первичные и вторичные.
Первичные причины гипоталамического и диэнцефального истощения:
- травмы мозга;
- ишемия гипоталамуса;
- затяжной психогенный стресс.
Причины вторичного (симптоматического) истощения:
- мальабсорбция;
- мальдигистия;
- дефицит глюкокортикоидов;
- гипоинсулинизм;
- гиперпродукция соматостатина;
- повышенный синтез глюкагона;
- гиперпродукция клетками опухоли ФНОa.
При недостаточном по отношению к энергетическим потребностям поступлении калорий с пищей происходит дополнительная утилизация жировых запасов и истощение.
Липодистрофии и липидозы
Липодистрофии – состояния, характеризующиеся генерализованной или локальной утратой жировой ткани или избыточным ее накоплением в подкожной жировой клетчатке. Причины разнообразны – от мутаций разных генов до постинъекционных осложнений. Различают наследственные и врожденные липодистрофии.
Врожденная генерализованная липодистрофия характеризуется полным исчезновением жира в подкожной клетчатке, ускорением темпов роста и развития скелета в первые 3-4 года жизни, катарактой, гиперпигментацией кожных покровов, гипертрофией мышц, почек, сердца, гепатоспленомегалией с портальной гипертензией, олигоменореей. Лабораторно: гиперлипидемия, гипергликемия, гиперинсулинемия, гиперглюкагонемия.
Инсулиновая липодистрофия – постинъекционная липодистрофия, развивающаяся в местах введения инсулина у больных сахарным диабетом.
Липидозы – типовая форма нарушения липидного обмена, характеризующаяся нарушением метаболизма разных липидов в клетках (паренхиматозные липидозы), жировой клетчатке (ожирение, истощение) или стенках артериальных сосудов (атеросклероз, артериосклероз).
Липидоз церебральный, липидоз сфингомиелиновый.
Дислипопротеинемии
Дислипопротеинемии – состояния, характеризующиеся отклонением от нормы содержания, структуры и соотношения различных липопротеинов. Нарушения метаболизма липопротеинов – главное звено патогенеза атеросклероза, ишемической болезни сердца, панкреатита и других заболеваний.
Виды дислипопротеинемий.
По происхождению:
- первичные (наследственные и врожденные);
- вторичные (приобретенные).
По изменению содержания липопротеинов в крови:
- гиперлипопротеинемии;
- гиполипопротеинемии;
- комбинированные (дислипопротеинемии);
- алипопротеинемии.
Гиперлипопротеинемиями называются нарушения образования, транспорта и утилизации липопротеинов, сопровождаемые повышением уровня холестерина и/или триглицеридов в плазме крови.
Гиперлипопротеинемии бывают наследственными (первичными) и приобретенными (вторичными).
В 1967 г. Фридериксон и соавторы разработали классификацию гиперлипопротеинемий, в основу которой были положены данные о содержании общего холестерина и триглицеридов в плазме крови и особенности распределения фракций липопротеидов. Было выделено пять типов гиперлипопротеинемий.
Гиполипопротеинемии и алипопротеинемии – состояния, характеризующиеся расстройством образования, транспорта и обмена липопротеинов, проявляющиеся стойким снижением их уровня в плазме крови или полным их отсутствием. Например, болезнь Танжье[1] – наследуемая недостаточность липопротеинов высокой плотности с низким содержанием аполипопротеина А, накоплением пенистых клеток, содержащих холестериновые эфиры, увеличением миндалин, гепатоспленомегалией, гиперхолестеринемией.
Атеросклероз
Когда доктор Ф. Маршан в 1904 году, обнаружив и изучив бляшку в стенке сосуда, дал атеросклерозу (от греческого «athere» ‑ кашица и «skleros» ‑ твердый) столь невинное имя, он вряд ли мог предположить, что его коллеги в конце XX века назовут эту болезнь «убийцей №1». И сделают это вполне обоснованно: атеросклероз – основа и провокатор практически всех самых распространенных сердечно-сосудистых заболеваний и в первую очередь – ишемической болезни сердца (ИБС), инфаркта миокарда, мозгового инсульта, ишемического заболевания конечностей, включающего перемежающуюся хромоту и гангрену нижних конечностей, ишемическую болезнь кишечника, обусловливающую атонию кишечника, атеросклероза почечных артерий, приводящего к развитию первично сморщенной почки и хронической почечной недостаточности.
Атеросклероз, как правило, поражает ключевые артерии, снабжающие кровью головной мозг, сердце, почки, органы брюшной полости, ноги… Чаще всего атеросклеротические бляшки образуются там, где плавное и непрерывное течение крови меняет свое направление: кровеносный сосуд либо разбивается на два потока, либо изгибается, либо от него отходят более мелкие ветви. В таких проблемных местах возникают микрозавихрения крови, стенка сосуда испытывает большее напряжение и часто повреждается. Значительную роль в повреждении сосудистой стенки играет недостаток витамина С. Дело в том, что витамин С используется в синтезе коллагена – белка, который формирует «основной каркас» сосудистой стенки. Чем меньше витамина С, тем хуже качество коллагена, тем легче повредить сосуд.
Атеросклероз – это хроническое прогрессирующее заболевание крупных и средних эластических и мышечно-эластических артерий, в основе которого лежит нарушение липидного обмена и, прежде всего, холестерина.
Заболевание проявляется пропитыванием сосудистой стенки белками и липидами с последующим разрастанием соединительной ткани и кальцинозом.
Пытаясь «отремонтировать» повреждение, иммунная система организма включает целый комплекс аварийных работ. При этом активизируется синтез холестерина, который, как известно, является важнейшим компонентом наружных оболочек (мембран) всех без исключения клеток. Без холестерина не воссоздашь ни одной полноценной клетки! Но когда это жироподобное вещество в избытке накапливается в сосудистой стенке, создаются предпосылки для развития атеросклероза, потому что именно холестерин становится «фундаментом» будущей атеросклеротической бляшки. На него постепенно наслаиваются жиры, жироподобные вещества, белки, соединительнотканные волокна. Так формируется атеросклеротическая бляшка, которая, выступая в просвет сосуда, суживает его.
Развитие атеросклероза тесно связано с нарушением процесса транспорта холестерина в стенку артерий в составе липопротеидов низкой и очень низкой плотности и нарушением процесса удаления холестерина из стенки с помощью липопротеидов высокой плотности.
У здоровых людей 70% холестерина плазмы находится в составе атерогенных липопротеидов низкой и очень низкой плотности, 25-30% - в составе антиатерогенных липопротеидов высокой плотности. Это соотношение обеспечивает равновесие прямого и обратного потоков холестерина в клетки и резистентность организма к атеросклерозу.
Первичным в развитии атеросклероза являются очаговые изменения структуры и функции эндотелия сосудистой стенки. На ранних стадиях развития атеросклероза возникают расстройства обмена холестерина и липопротеидов – дислипопротеидемия. В большинстве случаев в крови увеличивается содержание атерогенных частиц – холестерина и белка апопротеина В, но в 30% случаев снижается содержание антиатерогенных липопротеидов (липопротеидов высокой плотности).
Антиатерогенными свойствами обладают фосфолипиды и полиненасыщенные жирные кислоты, которые:
- ограничивают всасывание пищевого холестерина в тонком кишечнике;
- стимулируют синтез в печени желчных кислот;
- тормозят синтез и секрецию липопротеидов низкой плотности;
- тормозят синтез тромбоксана А2 и агрегацию тромбоцитов;
- стимулируют синтез простациклина эндотелиальными клетками.
Атерогенными свойствами обладают холестерин, триглицерин и насыщенные жирные кислоты. Повышение концентрации этих веществ в крови может быть вызвано:
- снижением скорости их выведения из крови в печень;
- повышением скорости их синтеза;
- нарушением их метаболизма в плазме.
В норме липопротеиды низкой и очень низкой плотности переносят холестерин из плазмы крови в клетки через рецепторы цитоплазматических мембран эндотелиальных и гладкомышечных клеток.
Большое количество рецепторов липопротеидов низкой плотности содержат клетки печени, половых желез и надпочечников. Это связано с тем, что холестерин необходим для образования желчных кислот, половых гормонов и кортикостероидов.
Нарушение обмена холестерина происходит при:
- отсутствии на поверхности клеток рецепторов липопротеидов низкой плотности;
- увеличении сродства липопротеидов к мембране клеток;
- прямом повреждающем действии холестерина на эндотелий сосудов и гладкомышечные клетки стенки;
- стрессовых ситуациях;
- избытке липопротеидов низкой плотности;
- низком содержании липопротеидов высокой плотности;
- генетических дефектах ферментов липопротеинового и холестеринового обмена.
Факторами риска развития атеросклероза являются:
- дислипопротеинемии;
- повышение артериального давления (гипертоническая болезнь);
- гиподинамия;
- стрессовые профессии (врачи, медицинские сестры, учителя, летчики и др.), требующие длительного и сильного нервного напряжения;
- интоксикация (алкоголь, никотин, свинец, бензол, соединения ртути, бактериальные токсины и др.);
- избыточное питание, приводящее к ожирению;
- пол и возраст;
- генетические нарушения свертывающей и противосвертывающей систем крови (фибриноген и фибрин – постоянные компоненты атеросклеротических бляшек);
- сахарный диабет;
- гипервитаминоз Д;
- прием пероральных контрацептивов;
- курение.
Как показали многочисленные исследования, если присутствует хоть один фактор риска, вероятность заболеть атеросклерозом и ИБС увеличивается в 2 раза, если два фактора – в 6-8 раз, далее – в геометрической прогрессии. Устраните факторы риска, и ваши сосуды никогда не подадут сигнал SOS!
Нормы содержания холестерина
|
5,2 ммоль/л, или 200мг/% |
идеальное содержание холестерина в крови. |
|
5,3-6,5 ммоль/л, (200-250 мг/%) |
незначительная холестеринемия, зона риска развития атеросклероза. |
|
6,5-8 ммоль/л, (250-300 мг/%) |
умеренная гиперхолестеринемия. |
|
Выше 8 ммоль/л, (выше 300 мг/%) |
выраженная гиперхолестеринемия. |
У атеросклероза есть «любимые» мишени. Это сосуды головного мозга, сонная артерия, аорта и ее ветви, снабжающие кровью все органы брюшной полости, малого таза, почки, ноги. На рисунке 2 места локализации атеросклеротических бляшек отмечены черными кружками.
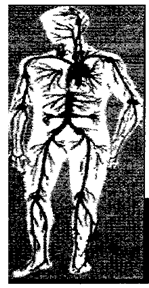
Рис. 2. места локализации атеросклеротических бляшек.
В возрасте 40-60 лет атеросклерозом и инфарктом миокарда атеросклеротической природы чаще болеют мужчины. После 60 лет заболеваемость атеросклерозом мужчин и женщин одинакова. Эти различия связаны с антисклеротическим действием женских половых гормонов. Снижение функции половых желез обусловливает увеличение в сыворотке крови холестерина, что способствует прогрессированию атеросклероза. Такое атерогенное действие эстрогенов проявляется преимущественно в отношении сосудов сердца.
Для развития атеросклероза имеет значение не только увеличение холестерина, но и изменение соотношения между уровнем холестерина и фосфолипидами (в норме 0,9). При атеросклерозе это соотношение увеличивается. Фосфолипиды снижают содержание холестерина в сыворотке крови, удерживают его в эмульгированном состоянии, препятствуют отложению в стенке сосудов. Поэтому их относительный дефицит является одним из важных факторов, способствующих развитию атеросклероза.
Этому способствует и снижение липолитической активности интимы сосудов, что в условиях высокой проницаемости стенки сосудов облегчает ее пропитывание липидами. Большое значение в патогенезе атеросклероза имеют процессы биосинтеза холестерина, который в организме образуется в печени из белков, жиров и углеводов. У человека в сутки синтезируется около 800 мг холестерина и около 400 мг всасывается из пищи. У здоровых лиц натощак количество холестерина величина достаточно постоянная.
Склерозированные сосуды отличаются повышенной плотностью, хрупкостью, снижением эластических свойств, поэтому они не могут изменять свой просвет в зависимости от потребностей органов или тканей в кровоснабжении. Первоначально функциональная неполноценность сосудов обнаруживается только при предъявлении к ним повышенных требований, т.е. при увеличении нагрузки. Прогрессирование атеросклеротического процесса приводит к снижению работоспособности органов и тканей и в состоянии покоя.
Стадии атеросклероза
Первые признаки начинающегося атерогенеза обнаруживаются уже у детей 9-10 лет. В 10-15 лет они выявляются в виде липидных полосок в коронарных артериях. К 25 годам липидные полоски обнаруживаются на 30-50% поверхности аорты, а у большинства 30-40-летних людей липидные полоски выявляются в сосудах мозга.
Различают несколько стадий функционального морфогенеза атеросклероза.
Долипидная стадия характеризуется гиперхолестеринемией, изменениями липидного спектра крови, повышением проницаемости эндотелия и проникновением в субэндотелиальное пространство моноцитов.
Стадия липоидоза характеризуется снижением липолитической активности сосудистой стенки, отложением в интиме липидов с последующем разрастанием соединительной ткани.
Стадия липосклероза характеризуется образованием атеросклеротической бляшки, в которой находится большое количество макрофагов, нагруженных холестерином. На этой стадии в бляшке одновременно происходит два процесса: усиление склероза и распад белковых и липидных масс с образованием детрита. В эту стадию интима над бляшкой не только склерозируется, но и гиалинизируется, образуя покрышку бляшки. Бляшка суживает просвет сосуда. Вокруг бляшки разрастается соединительная ткань. Эта стадия называется атероматозом. В эту стадию бляшка представляет собой плотную соединительнотканную капсулу, внутри которой расположены массы детрита и кристаллы холестерина.
Стадия атерокальциноза. На этой стадии бляшка абсорбирует соли кальция. Интима над ней истончается и разрывается, бляшка изъязвляется и превращается в атероматозную язву.
Клинико-морфологические формы атеросклероза
Для клинической практики наибольшее значение имеют атеросклеротические поражения аорты, венечных артерий, артерий мозга и артерий нижних конечностей. Многослойные бляшки способны суживать просвет на 50-80%, буквально перекрывая органам кислород. Если атеросклерозом поражены ветви аорты, коронарные артерии, то начинает задыхаться сердце, развивается ишемическая болезнь. В настоящее время атеросклероз венечных артерий выделен в самостоятельную болезнь.
Атеросклероз аорты может закончиться образованием аневризмы, т.е. мешковидного выпячивания стенки сосуда, заполненного кровью и тромботическими массами. Разрыв аневризмы приводит к быстрой массивной кровопотере и скоропостижной смерти.
Атеросклероз артерий мозга характерен для пожилых и старых людей. При атеросклерозе артерий мозга головной мозг постоянно испытывает кислородное голодание и постепенно атрофируется, что приводит к атеросклеротическому слабоумию. Может произойти разрыв сосудов, что приводит к кровоизлиянию – геморрагическому инсульту, при котором гибнет соответствующий участок мозга.
Течение гемморрагического инсульта зависит от локализации и массивности. Если кровоизлияние произошло в область дна IV желудочка, то наступает быстрая смерть. При ишемических инфарктах и геморрагических инсультах погибшая ткань мозга постепенно рассасывается и на ее месте образуется полость – киста мозга. Ишемический инфаркт и геморрагический инсульт сопровождаются неврологическими нарушениями. У выживших развиваются параличи, страдает речь. При соответствующем лечении со временем возможно частичное восстановление утраченных функций ЦНС.
Атеросклероз артерий нижних конечностей. При значительном развитии бляшек и сужении просвета сосудов в тканях конечностей развивается ишемия. При повышенной нагрузке на мышцы при ходьбе развивается боль и больной вынужден останавливаться. Этот симптом называется «перемежающейся хромотой».
Клинически отмечается похолодание и атрофия тканей конечностей. Если просвет сосудов полностью закрыт, развивается атеросклеротическая гангрена.
Когда бляшки локализуются в почечных артериях, почки перестают справляться со своими сложнейшими обязанностями и возвращают в организм плохо отфильтрованную, недоочищенную кровь. Постепенно развивается почечная недостаточность.
Самое страшное, что все эти патологические изменения сосудов протекают скрыто. Как говорят кардиологи, высокий холестерин не болит до тех пор, пока громом не грянут ИБС, инфаркт миокарда, инсульт… Чтобы несчастье не застало вас врасплох, следите за уровнем своего холестерина! После 40 лет анализ на общий холестерин рекомендуется делать хотя бы раз в год.
Итак, атеросклероз – это прогрессирующее поражение крупных артерий эластического и мышечно-эластического типа, которое возникает в результате воздействия многих факторов и характеризуется накоплением в определенных участках стенки артерии липидов, пролиферацией гладкомышечных клеток, появлением макрофагов, образованием большого количества соединительной ткани. Атеросклеротические изменения проявляются образованием жировых полосок, утолщением интимы, формированием атеросклеротических (фиброзных) бляшек.
Регресс атеросклероза
Важные доказательства значения дислипопротеинемий в патогенезе атеросклероза были получены в исследованиях с длительным применением препаратов, снижающих уровень липидов. К таким препаратам относятся статины. Многолетнее непрерывное применение статинов в сочетании с диетой достоверно снижает летальность за счет снижения развития инфарктов и случаев внезапной смерти. Эти результаты связаны со стабилизацией состояния атеросклеротических бляшек. Иногда даже наблюдается уменьшение размеров бляшек, особенно мягких бляшек, богатых липидами, которые не всегда выявляются при коронарографии. Именно такие бляшки склонны к надрывам и разрывам интимы сосудов с последующим образованием тромбов. Тромбоз способствует развитию инфарктов и внезапной смерти.
Принципы профилактики и терапии.
Этиотропный принцип имеет целью исключение или уменьшение степени атерогенного действия факторов риска (применение гиполипидемических лекарственных средств, соблюдение диеты, отказ от курения).
Патогенетический принцип направлен на разрыв «цепочки атерогенеза» (использование антиагрегантов, антикоагулянтов и фибринолитических средств). Применение лекарств, тормозящих внутриклеточное образование холестерина и его производных (статинов: ловастатина, симвастатина и др.).
Симптоматический принцип имеет целью устранение и/или уменьшение выраженности симптомов атеросклероза (эпизодов головной боли, стенокардии, болей в различных органах, конечностях и др.).
Нарушения углеводного обмена
Углеводы – обязательный и наиболее значимый компонент пищи. В сутки человек потребляет 400-600 г разных углеводов. Углеводы ‑ необходимый участник метаболизма всех видов обмена. Они входят в состав структурных белков и являются одним из главных источников энергии.
Углеводы – основные поставщики энергии в питании человека. На их долю приходится 50% калорийности и около ¾ веса суточного рациона. Углеводы, потребляемые с пищей, представлены главным образом крахмалом. Гликоген животных продуктов в питании человека имеет небольшое значение, в печени на него приходится 20% сырого веса. В рационе человека представлена сахароза – дисахарид, состоящий из глюкозы и фруктозы. Важным компонентом молочных продуктов является лактоза. В меде и фруктах содержатся небольшие количества глюкозы и фруктозы. В винограде и хурме фруктозой и глюкозой представлены все сахаристые вещества. Мальтоза представлена в солоде и пиве.
В составе гликогена клетки организма запасают энергию. Гликоген – это быстромобилизуемый резерв глюкозы, если бы не было резервной формы, накопление глюкозы приводило бы к гиперосмолярности цитоплазмы клеток.
Углеводы выполняют и структурную функцию. Основу межклеточного вещества соединительной ткани составляют глюкозаминогликаны. Многие белки человека, в том числе энзимы, транспортные белки, гормоны – являются гликопротеидами. Углеводы необходимы для производства липидов и компонентов нуклеиновых кислот. Углеводы являются частью антигенной среды организма, так как ими представлены полисахаридные антигены.
Полисахаридные медиаторы воспаления обладают противовоспалительными и антимикробными свойствами, а глюкорониды являются важной формой детоксикации эндогенных ядов и ксенобиотиков. Углеводы участвуют во всех многообразных аспектах метаболизма, поэтому только при доступности пищевых углеводов метаболизм протекает нормально. При исключении углеводов из диеты возникает тенденция к алиментарной гипогликемии, которая компенсируется усилением глюконеогенеза. Это может приводить к кетозу и ускоренному расходованию белка, ослаблению образования печенью парных соединений с участием глюкуроновой кислоты, что снижает антитоксическую устойчивость организма. Введение углеводов повышает антитоксическую функцию печени.
Сбалансированная диета взрослого человека должна содержать 124 г углеводов на 1000 ккал суточного рациона. Легкоусвояемые дисахариды должны составлять не более 25% этого количества, так как их переедание является риском развития атеросклероза и ожирения.
Полисахариды пищи перевариваются амилазой слюны, которая продолжает действовать внутри пищевого комка и в желудке. Основная углевод-переваривающая активность желудочно-кишечного тракта представлена панкреатической a-амилазой. При панкреатической недостаточности нарушается переваривание углеводов, и в фекалиях обнаруживаются гранулы крахмала.
Изменения углеводного обмена развиваются при нарушении:
- расщепления и всасывания углеводов в пищеварительном тракте;
- синтеза и распада гликогена в печени;
- потребления углеводов клетками органов.
Углеводы поступают в организм в виде поли-, ди- и моносахаридов. Их расщепление происходит в двенадцатиперстной кишке и тонком кишечнике, пищеварительные соки которых содержат активные амилолитические ферменты (амилазу, сахаразу, лактазу и др.). Углеводы расщепляются до моносахаридов.
Расщепление и всасывание нарушается при тяжелых повреждениях кишечника и дефиците амилолитических ферментов. При уменьшении всасывания углеводов возникает гипогликемия, уменьшается масса тела, так как на синтез глюкозы путем гликонеогенеза расходуются жиры и белки.
Синтез гликогена может изменяться как в сторону снижения, так и усиления.
Усиление распада гликогена происходит при: стрессе, эмоциональных напряжениях, тяжелой мышечной работе, голодании, повышении активности гормонов, стимулирующих гликогенолиз (глюкагон, адреналин).
Снижение синтеза гликогена наблюдается при: тяжелых поражениях печени (например, при гепатитах, когда снижается гликогенообразовательная функция), гипоксии, так как при этом уменьшается образование АТФ, которая необходима для синтеза гликогена.
При уменьшении гликогена наблюдается гипогликемия (уменьшение сахара в крови), а энергетический обмен обеспечивается за счет жирового и белкового обмена. В результате накапливаются кетоновые тела, развивается кетоацидоз.
Значительное усиление синтеза гликогена ведет к избыточному его накоплению в органах и тканях и их повреждению. Это происходит при гликогенозах (гликогенной болезни), в основе которых лежит врожденный дефицит ферментов, обеспечивающих распад или синтез гликогена. Болезнь проявляется вскоре после рождения. Наблюдается несколько типов гликогенозов.
Гликогеноз I типа (болезнь Гирке) – врожденный дефицит в печени и почках фермента глюкозо-6-фосфатазы. Развивается гипогликемия, в крови накапливается молочная кислота, развивается метаболический ацидоз. Больные дети рано умирают от присоединившихся интеркурентных заболеваний или ацидотической комы.
Гликогеноз II типа (болезнь Помпе) – врожденный дефицит кислой 1, 4-глюкозидазы. В лизосомах клеток накапливается гликоген, который постепенно ее разрушает. Симптомы проявляются через несколько суток после рождения. Ведущим симптомом является увеличение сердца (кардиомегалия). Дети рано умирают от сердечной недостаточности.
Гликогеноз III типа (болезнь Кори) – возникает при полной или частичной недостаточности фермента амило-1,6-глюкозидазы. Болезнь проявляется гипогликемией, мышечной слабостью, развитием кетоза. Прогноз благоприятный.
Гликогеноз IV типа (болезнь Андерсена) – диффузный гликогеноз с циррозом печени. Болезнь проявляется вскоре после рождения. Больные погибают на первом году жизни.
Гормональная регуляция углеводного обмен
Содержание глюкозы в крови величина постоянная (3,3-6,5 ммоль/л), которая в физиологических условиях никогда не падает ниже критических величин. В норме колебания глюкозы ± 30%. Уровень глюкозы в крови определяется скоростью продукции эндогенной глюкозы и скоростью ее утилизации в тканях. Регуляция этих процессов осуществляется нейрогормональным путем.
Шесть гормональных систем участвует в регуляции углеводного обмена: инсулин, глюкагон, гормоны гипофиза, гормоны щитовидной железы, гормоны надпочечников и адреналин. Из всех этих систем, только инсулин, «работает» на снижение уровня глюкозы в крови, остальные «работают» на ее повышение.
Поджелудочная железа – непарный орган, расположенный ретроперитонеально и секретирующий пищеварительные ферменты (экзокринная часть) и различные гормоны (эндокринная часть). Эндокринная часть поджелудочной железы представлена островками, которые были описаны в 1869 г. П. Лангергансом. Они расположены в экзокринной паренхиме железы, составляют 1-1,5% от общего объема. В поджелудочной железе взрослого человека насчитывается от 360 тыс. до 2 млн. островков. Островки Лангерганса представлены несколькими типами клеток: a-клетки являются местом образования глюкагона, b-клетки служат местом синтеза и депонирования инсулина, d-клетки являются местом образования соматостатина. Инсулин был открыт в 1921г. канадскими учеными F. Banting и C. Best и румыном N. Paulescu. Химическая формула инсулина расшифрована в 1953 г. F. Sangur и соавт. Практически во всех тканях организма инсулин влияет на обмен углеводов, жиров, белков, электролитов, увеличивая транспорт глюкозы, белка и других веществ через мембрану клетки. Свое биологическое действие на уровне клетки инсулин осуществляет через соответствующий рецептор.
Рецептор выполняет три основных функции:
- распознает в молекуле места связывания инсулина и осуществляет комплексирование с последним;
- опосредует передачу соответствующего сигнала, направленного на активацию внутриклеточных обменных процессов;
- осуществляет эндоцитоз (погружение внутрь клетки) гормонорецепторного комплекса, что приводит к лизосомальному протеолизу инсулина.
Основное действие инсулина заключается в усилении транспорта глюкозы через мембрану клетки.
Инсулин контролирует утилизацию глюкозы тканями и поступление глюкозы в кровоток.
Глюкагон, секретируемый a-клетками островков Лангерганса, вначале попадает в межклеточное пространство и интерстициальную жидкость, а затем с током крови через портальную вену в печень, здесь он увеличивает гликогенолиз, снижает утилизацию глюкозы и синтез гликогена, повышает глюконеогенез и образование кетоновых тел. Общим эффектом этих воздействий является увеличение образования и выход глюкозы из печени. В тканях глюкагон повышает липолиз, снижает липогенез и синтез белков.
Основная роль глюкагона заключается в регулировании образования и выхода глюкозы из печени в целях поддержания гомеостаза глюкозы в крови для эффективного и адекватного снабжения тканей, ЦНС, которые используют ее в качестве энергетического материала. a-клетки и b-клетки чувствительны к минимальным изменениям уровня глюкозы в крови и во внеклеточном пространстве, в зависимости от чего соответственно изменяется скорость секреции инсулина или глюкагона. Эти взаимоотношения представлены на рисунке 3.
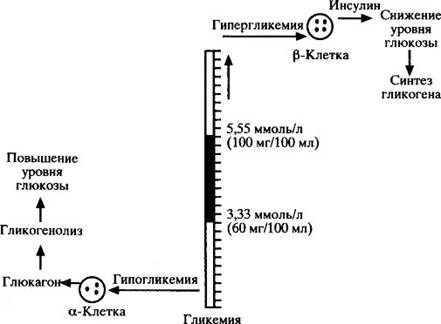
Рис. 3. Участие инсулина и глюкагона в гомеостазе глюкозы.
Таким образом, уровень глюкозы в крови в основном поддерживается секрецией инсулина и глюкагона.
Соматостатин помимо гипоталамуса вырабатывается и в d-клетках островков Лангерганса. Эти клетки выполняют паракринную функцию: осуществляют местное действие путем транспорта гормонов непосредственно от клетки к клетке. Соматостатин угнетает секрецию инсулина и глюкагона. Высвобождение соматостатина стимулируют лейцин, аргинин, глюкоза, гастрин, секретин, угнетают высвобождение соматостатина норадреналин и диазоксид.
Соматостатин при действии на желудочно-кишечный тракт угнетает высвобождение гастрина и гастринстимулированную секрецию соляной кислоты, высвобождение холецистокинина, сокращение желчного пузыря, кишечную абсорбцию и скорость кровотока в сосудах желудочно-кишечного тракта. Стимуляция соматостатином желудочно-кишечного гормона и, наоборот, угнетение соматостатином их высвобождения по типу «обратной» связи позволяет осуществлять регуляцию скорости всасывания питательных веществ с учетом их качественного состава.
Поступление пищи в желудочно-кишечный тракт вызывает секрецию соматостатина, который влияет на деятельность a и b-клеток островкового аппарата поджелудочной железы, функциональная активность которых направлена на поддержание уровня глюкозы в крови в пределах нормы.
В норме увеличение глюкозы в крови вызывает секрецию инсулина b-клетками островков Лангеранса поджелудочной железы. При этом влияние контринсулярных гормонов на обмен углеводов уменьшается. Концентрация глюкозы снижается до нормы. Стимуляторами скорости высвобождения инсулина является гастрин, секретин, холецистокинин.
Гипогликемия – снижение концентрации глюкозы в плазме крови развивается в результате: недостаточного поступления глюкозы в кровь или ускоренного ее выведения и при комбинации этих факторов. Различают физиологическую и патологическую гипогликемии.
Физиологическая гипогликемия встречается у здоровых людей при усиленной мышечной работе, приводящей к значительному потреблению глюкозы как источника энергии.
Неонатальная гипогликемия – гипогликемия новорожденных особенно если масса тела ниже 2500 г. Гипогликемия развивается через несколько часов или суток после рождения. Ее развитию способствует охлаждение и несовершенство механизмов регуляции углеводного обмена. У ребенка в период голодания после рождения резко возрастает гликогенолиз (превращение гликогена в глюкозу) в результате запас гликогена в печени уменьшается. Значительная гипогликемия сопровождается тремором (дрожанием), цианозом, возбуждением, иногда судорогами. Неонатальная гипогликемия может привести к тяжелым отдаленным последствиям: отставанию в интеллектуальном развитии, атрофии зрительного нерва, снижению остроты зрения.
Чаще гипогликемия является следствием патологических расстройств:
- передозировки инсулина при лечении сахарного диабета;
- повышенной продукции инсулина при гиперфункция инсулярного аппарата поджелудочной железы (гиперплазия, инсулинома);
- недостаточности продукции гормонов, способствующих катаболизму углеводов (соматотропного гормона, тироксина, адреналина,
- глюкокортикоидов);
- недостаточного расщепления гликогена при гликогенозах;
- мобилизации большого количества гликогена из печени при физической нагрузке, не пополняющегося пищей;
- поражения клеток печени (острые и хронические гепатиты);
- нарушения всасывания углеводов в кишечнике.
Последствия гипогликемии.
При уровне сахара ниже 3-4 ммоль/л развивается тахикардия, тремор рук, чувство голода, появляются симптомы поражения нервной системы: слабость, раздражительность, повышенная возбудимость, чувство страха. При нарастании гипогликемии появляются галлюцинации, страдает потребление мозгом кислорода, часто повторяющиеся периоды гипогликемии приводят к необратимым изменениям в клетках нервной системы.
Гипергликемия – повышение концентрации глюкозы в крови выше 6,0 ммоль/л. Различают следующие формы гипергликемии.
Физиологическая гипергликемия имеет приспособительное значение, так как обеспечивает доставку тканям легко утилизируемого энергетического материала.
Алиментарная гипергликемия появляется при приеме большого количества легко усвояемых углеводов (сахар, конфеты, мучные изделия) при этом из кишечника быстро всасывается большое количество глюкозы, превышающее возможности печени и других тканей ее усваивать. Если это количество превышает 8,88 ммоль/л (почечный порог), то сахар появляется в моче (глюкозурия).
Эмоциональная гипергликемия развивается при волнении, эмоциональном возбуждении, сильной боли.
При стойком нарушении того или иного звена регуляции возникает патологическая гипергликемия.
Гормональная гипергликемия обусловлена нарушением функции эндокринных желез, гормоны которых участвуют в регуляции углеводного обмена.
Сахарный диабет
Сахарный диабет – заболевание, в основе которого лежит недостаточность инсулина в организме, вызывающая нарушение обмена веществ.
Выделяют следующие формы диабета:
- инсулинзависимый диабет, или сахарный диабет I-го типа;
- инсулиннезависимый или сахарный диабет II-го типа;
- симптоматический или вторичный диабет, сопровождающий эндокринные заболевания – акромегалию, болезнь Иценко-Кушинга и заболевания поджелудочной железы (панкреатиты и др.);
- диабет беременных (выявленный впервые при беременности).
Факторы риска развития диабета:
- избыточная масса тела;
- стойкая и значительная гиперлипидемия;
- артериальная гипертензия, приводящая к нарушению микроциркуляции в поджелудочной железе;
- наследственная или врожденная предрасположенность, которую определяют гены HLA;
- женский пол;
- повторные стресс-реакции, сопровождающиеся стойким повышением в крови уровней контринсуляторных гормонов.
Сочетание нескольких факторов риска увеличивает вероятность развития диабета в 20-30 раз.
Диабет I типа в зависимости от механизма развития подразделяется на два подтипа: аутоиммунный и вирусиндуцированный. Механизмы патогенеза инсулинзависимого сахарного диабета представлены на рисунке 12-4.
Аутоиммунный диабет характеризуется признаками клеточноопосредованного нарушения поджелудочной железы. Антитела опре
деляются до развития клинических проявлений диабета и поддерживаются на высоком уровне в течение нескольких лет после начала диабета. Этот вид диабета часто сочетается с другими эндокринопатиями. Аутоиммунный диабет сочетается с антигенами системы HLA.
Вирусиндуцированный диабет характеризуется кратковременным образованием антител к антигенам островкового аппарата поджелудочной железы. Этот вид диабета не сочетается с аутоиммунными поражениями других эндокринных органов, развивается в молодом возрасте. При этом виде диабета выявляются антигены системы HLA. Характерной особенностью этого типа диабета является повышенная склонность к образованию антител к экзогенному инсулину.
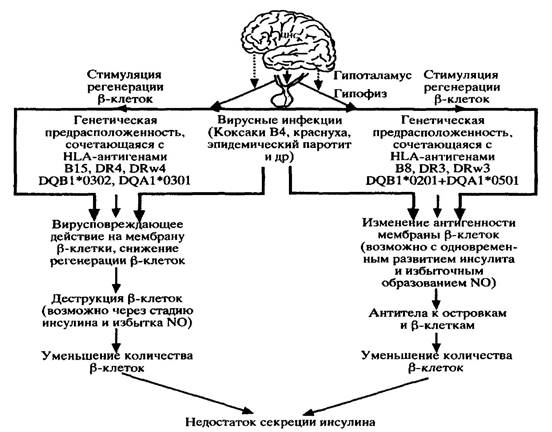
Рис. 4. Возможные механизмы инсулинзависимого сахарного диабета I типа (М.И. Балаболкин).
Существует и третья форма инсулинзависимого диабета, в генезе которой играют роль, как аутоиммунные нарушения, так и вирусная инфекция. Заболевание развивается в детском возрасте и характеризуется тотальным поражением b-клеток.
Есть еще одна форма сахарного диабета I типа – медленно прогрессирующая, которая характеризуется медленным развитием инсулиновой недостаточности. Больные этой формой диабета в течение 1-3 лет могут компенсировать нарушение углеводного обмена соблюдением диеты и приемом пероральных сахароснижающих препаратов, но к ним развивается резистентность и больных переводят на инсулинотерапию.
В механизмах деструкции b-клеток значительную роль играет оксид азота (NO), который является относительно стабильным свободным радикалом. Помимо NO значительное место в механизмах деструкции b-клеток принадлежит простагландинам островков поджелудочной железы.
Причины диабета II типа гетерогенны. Одной из причин является глюкозотоксичность, т.е. состояние длительной гипергликемии, которое приводит к снижению секреторного ответа b-клеток на стимуляцию повышенным уровнем глюкозы в крови. Такая «слепота» b-клеток к глюкозе приводит к нарушению секреции инсулина. Причиной этого типа диабета может быть мутация гена инсулинового рецептора.
В развитии инсулинорезистентности выделены два компонента: генетический или наследственный и приобретенный. Генетическая предрасположенность при этом типе диабета более значима, чем при диабете I типа. Разрешающими факторами могут быть ожирение и беременность. Основные механизмы развития диабета II типа приведены на рисунке 5.
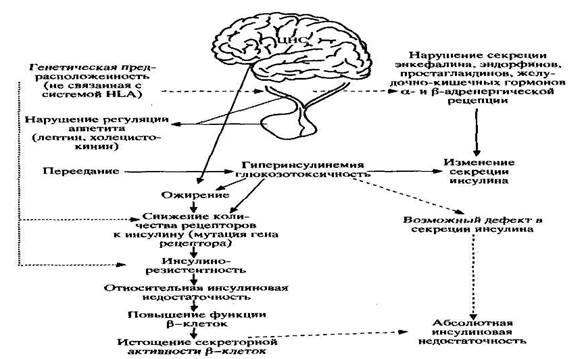
Рис. 5. Основные механизмы развития диабета II типа (М.И. Балаболкин).
Осложнения сахарного диабета.
Осложнения сахарного диабета подразделяются на острые и хронические
(рис. 6).
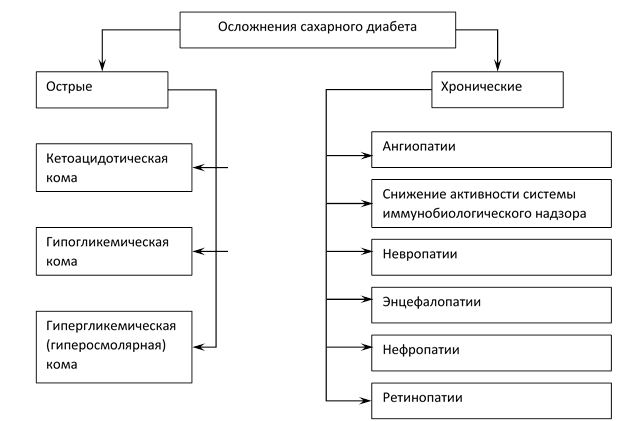
Рис. 6. Осложнения сахарного диабета (П.Ф. Литвицкий, 2016).
Диабетическая кома – особенно тяжелое осложнение диабета. Причиной развития комы может быть неправильное лечение диабета или присоединение сопутствующих заболеваний (травмы, операции, стрессы).
Патогенез кетоацидотической комы обусловлен недостаточностью инсулина и гиперсекрецией контринсулярных гормонов, особенно глюкагона и катехоламинов. Гипергликемия, кетонурия, азотемия приводят к полиурии, потере калия, натрия, хлора, бикарбонатов. Уменьшается объем крови, развивается клеточная дегидратация.
Гипергликемическая (гиперосмолярная) кома характерна для пожилых людей с инсулиннезависимым сахарным диабетом. Факторами риска развития этого типа комы являются: интеркурентные заболевания, сопровождающиеся дегидротацией, длительный прием диуретиков и глюкокортикоидов. Патогенез обусловлен дефицитом инсулина, что обусловливает развитие гипергликемии с последующей глюкозурией, осмотическим диурезом и полиурией, усиливающей дегидратацию. Развивается гиповолемия с повышением секреции альдостерона, способствующим задержке натрия, гипокалиемии и повышению осмолярности крови. Гиперосмолярность крови приводит к нарушению гемодинамики (артериальная гипотензия), олигурии и анурии. Повышается склонность к тромбообразованию и развитию ДВС-синдрома. Осложнением является отек мозга.
Гипогликемическая кома. Причинами развития являются:
- передозировка инсулина;
- задержка очередного приема пищи или голодание;
- избыточная физическая нагрузка;
- дефицит контринсулярных гормонов.
В механизмах развития этого вида комы главную роль играет гипогликемия.
Она обусловливает:
- снижение потребления кислорода нейронами мозга;
- острое нарушение ресинтеза АТФ в нейронах ЦНС;
- активацию симпатико-адреналовой системы. Катехоламины тормозят развитие тяжелой гипогликемии, стимулируя гликогенолиз, вызывая тахикардию, аритмию, мышечную дрожь, мышечную слабость, потливость, заставляющие пациента принять глюкозу;
- недостаточность энергоснабжения нейронов головного мозга вызывает нарушения высшей нервной деятельности;
- нарушение функций сердца (аритмии, недостаточность сердца), расстройства дыхания;
- недостаточность кровообращения;
- острая гипотензия (коллапс).
В основе хронических осложнений лежат метаболические расстройства в тканях.
Принципы терапии сахарного диабета
Этиотропный принцип направлен на устранение причин сахарного диабета.
Патогенетический принцип направлен на разрыв патогенетических звеньев:
- контроль и коррекция уровня глюкозы плазмы крови;
- коррекция водного и ионного баланса, сдвигов кислотно-основного равновесия;
- предотвращение острых осложнений диабета (кетоацидоза, коматозных состояний);
- предотвращение или уменьшение хронических осложнений.
Симптоматический принцип направлен на устранение и предотвращение состояний и симптомов, усугубляющих течение сахарного диабета и самочувствие пациента.
Показателями расстройств при изменении углеводного обмена являются:
- повышение уровня глюкозы в крови (N 3,3-5,5 ммоль/л);
- появление сахара в моче (глюкозурия) (почечный порог 8,88 ммоль);
- нарушение реабсорбции (обратного всасывания) воды, развитие полиурии (много выделяется мочи с высоким удельным весом (1030 и выше) дегидратация клеток (обезвоживание);
- полидипсия (выраженная жажда);
- усиление глюконеогенеза (образование глюкозы из белков) как следствие исхудание из-за затрат белка;
- нарушение жирового обмена (появление кетоновых тел: ацетон, b-оксимасляная кислота, ацетоуксусная кислота) в результате развитие некомпенсированного негазового ацидоза;
- истощение щелочных резервов, снижение pН крови, как результат развитие диабетической комы. В ее основе лежит нарушение кислотно-основного баланса. Продукты обмена угнетают нервную систему, развивается глубокое торможение, потеря сознания, исчезновение рефлексов, падение артериального давления, появление патологического дыхания Куссмауля, резкое снижение тургора кожных покровов, запах ацетона изо рта.
Моделирование сахарного диабета
Абсолютная и относительная недостаточность инсулина приводит к развитию сахарного диабета, характеризующегося хронической гипергликемией и глюкозурией, нарушением обмена веществ, поражением сосудов (ангиопатией), нейропатией и патологическими изменениями в различных органах и тканях.
По данным ВОЗ в мире насчитывается более 150 млн больных диабетом. Проведенные эпидемиологические исследования показали, что в России количество больных диабетом достигает 6-8 млн человек. Это требует разработки методов ранней диагностики заболевания и широкого проведения профилактических мероприятий. Принята федеральная целевая программа «Сахарный диабет», предусматривающая проведение организационных, диагностических, лечебных и профилактических мероприятий, направленных на снижение распространенности заболевания, уменьшение инвалидизации и летальности от сахарного диабета. Именно поэтому возрастает роль и значение экспериментального моделирования заболевания.
Экспериментальное воспроизведение сахарного диабета лучше всего удается двумя путями: удалением всей или большей части 9/10 поджелудочной железы модель Дж. Меринга и О. Миньковского и внутривенным или подкожным введением аллоксана (аллоксановый или островковый диабет). Введение аллоксана вызывает некроз b-клеток островков Лангерганса поджелудочной железы. Через 48 часов после введения аллоксана развивается стойкая гипергликемия, глюкозурия и полиурия из-за инсулиновой недостаточности. Аллоксановый диабет наиболее близок к сахарному диабету человека, так как при этом, в отличие от диабета, после полного удаления поджелудочной железы, не нарушается внешняя секреция железы и инкреция гормона липокаина, играющего важную роль в регуляции жирового обмена в печени. Не исключена возможность образования аллоксана в организме человека при нарушении пуринового обмена. Об этом свидетельствует частое сочетание мочекислого диатеза (подагры) и диабета.
В эксперименте установлено, что собаки с удаленной поджелудочной железой, несмотря на введение инсулина, погибают через 2-3 месяца при явлениях резко выраженной жировой дистрофии печени. После удаления поджелудочной железы животные могут долго жить только при условии, что им одновременно с инсулином вводят с пищей сырую поджелудочную железу или ее экстракт, что предупреждает развитие жировой дистрофии печени.
Понижение функции островкового аппарата поджелудочной железы можно вызвать введением дитизона. Стойкую гипергликемию и глюкозурию можно вызвать введением гормона роста собакам («метагипофизарный» диабет). Введение больших доз гормона коры надпочечников (кортизона, гидрокортизона) также вызовет гипергликемию («стероидный» диабет), так как эти гормоны являются контринсулярными гормонами.
При экспериментальном диабете из-за недостатка инсулина нарушается переход углеводов в жир. У нормальных животных около 30% вводимой глюкозы превращается в жир, у диабетических животных только 3%. При инсулиновой недостаточности замедляется синтез белков из аминокислот и значительно усиливается образование из них углеводов (глюконеогенез) в печени и частично в почках. Одним из доказательств перехода белков в углеводы при диабете является тот факт, что при питании животных пищей, лишенной углеводов, глюкоза продолжает выделяться с мочой, а ее отношение к азоту мочи составляет постоянную величину. Удаление у диабетических животных печени, которая является постоянным местом глюконеогенеза, или ее тяжелое поражение четыреххлористым углеродом уменьшает гипергликемию и глюкозурию. Удаление у диабетических животных гипофиза или надпочечников также значительно уменьшает гипергликемию и глюкозурию, так как это вмешательство влечет за собой подавление глюконеогенеза.
Основными причинами гипергликемии при диабете является недостаточное превращение углеводов в жир и усиление глюконеогенеза из белка. Эти же факторы лежат в основе исхудания, развивающегося при диабете. Введение инсулина нормализует указанные процессы и тем самым снижает гипергликемию и предотвращает исхудание.
Существенным нарушением обмена углеводов при диабете является недостаточное фосфорилирование глюкозы и недостаточное окисление промежуточных продуктов ее обмена. Это уменьшает переход глюкозы из внеклеточной жидкости в ткани.
Высокий уровень сахара крови, усиливая процесс фильтрации в клубочках и затрудняя реабсорбцию в канальцах, приводит к глюкозурии. Однако, в патогенезе диабетической глюкозурии играет роль не только гипергликемия, но и нарушение ферментативных процессов в почках (фосфорилирование и дефосфорилирование), обеспечивающих реабсорбцию глюкозы. Параллельно с глюкозурией развивается полиурия, которая ведет к обезвоживанию тканей и высыханию слизистой оболочки полости рта и глотки. Это рефлекторно вызывает раздражение питьевого центра, которое проявляется повышением жажды (полидипсия).
Если вместе с недостатком инсулина развивается и недостаточность липокаина, то наступает жировое перерождение печени («тотально-панкреатический диабет»).
Ожирение печени при диабете способствует развитию кетоза (накопление ацетоуксусной, b-оксимасляной кислот, ацетона). Кетоз проявляется повышением уровня кетоновых тел в крови – кетонемия и их появлением в моче – кетонурия. При выраженном кетозе ацетон выделяется не только с мочой, но и через легкие, поэтому от больного животного пахнет ацетоном (запах фруктов).
Кетоз ‑ грозное осложнение диабета, так как накопление кетоновых тел в крови оказывает угнетающее действие на центральную нервную систему, начиная от коры больших полушарий до продолговатого мозга. Действие кетоновых тел на центральную нервную систему может вызвать состояние, которое называется диабетической комой. Основными проявлениями которой является потеря сознания, патологическое дыхание типа Куссмауля, снижение артериального давления.
Сахарный диабет у животных может быть получен с помощью антител против инсулина. Такой диабет возникает как при активной, так и при пассивной иммунизации. Опыты Л.В. Соболева с перевязкой выводного протока поджелудочной железы (в этом случае не повреждается островковый аппарат железы и диабет не развивается) показали, что сахарный диабет связан с недостаточностью b-клеток островков поджелудочной железы.
Итак, все формы экспериментального диабета доказывают, что в основе развития сахарного диабета лежит абсолютная или относительная инсулиновая недостаточность.
Нарушение гормональной регуляции, сопровождающей сахарный диабет, может отражаться на течении беременности, приводить к патологии плаценты, самопроизвольным абортам, развитию эмбриопатий, приводящих к выраженным порокам развития плода.
В соответствии с клиническими и экспериментальными исследованиями комитет экспертов ВОЗ по сахарному диабету рекомендовал классификацию сахарного диабета (1985), которая применяется во всех странах мира.
Классификация сахарного диабета (М.И. Балаболкин, 1998)
I. Клинические формы диабета
1. Инсулинзависимый сахарный диабет (ИЗД – диабет I типа).
2. Инсулиннезависимый сахарный диабет (ИНЗД – диабет II типа).
3. Сахарный диабет, связанный с недостаточностью питания.
4. Другие формы сахарного диабета (вторичный или симптоматический диабет).
5. Диабет беременных.
II. Нарушения толерантности к глюкозе – латентный или скрытый диабет.
III. Группы статического риска или предиабет.
В клиническом течении сахарного диабета различают три стадии:
- предиабет;
- нарушения толерантности к глюкозе (латентный или скрытый диабет);
- манифестный сахарный диабет, ИЗД и ИНЗД, течение которого может быть легким, средней тяжести и тяжелым.
Клинические и экспериментальные наблюдения свидетельствуют, что в патогенезе сахарного диабета любого типа участвует одновременно несколько механизмов, степень выраженности которых различна при определенных типах этой патологии. Независимо от начальных механизмов деструкции b-клеток на последующих стадиях развития процесса происходит уменьшение их количества вплоть до полного исчезновения с развитием абсолютной инсулиновой недостаточности.
Наследственные нарушения углеводного обмена
Галактоземия, проявляется в неспособности к обмену галактозы, входящей в состав лактозы молока. Наследственным биохимическим дефектом является нарушение активности фермента ответственного за обмен галактозы.
Галактоземия сопровождается галактозурией. У новорожденных болезнь развивается при недостатке фермента. В результате обмен галактозы задерживается, она накапливается в крови, селезенке, печени, хрусталике. Развивается катаракта, цирроз печени. У детей наблюдается задержка развития, исхудание, умственная отсталость. Исключение галактозы из пищи сохраняет ребенку жизнь. Наследственно пониженная активность любого из ферментов распада или синтеза гликогена приводит к развитию гликогенозов.
Диффузный гликогеноз (болезнь Фербса) связан с пониженной активностью амило-1,6-глюкозидозы. У больных детей развиваются отеки и кровоточивость. Гликоген депонируется в печени, мышцах, эритроцитах, лейкоцитах.
К наследуемым патологическим состояниям относятся фруктозурия и пентозурия. Выделены две формы фруктозурии. Одна из них – наследственная непереносимость фруктозы, связанная с отсутствием фруктозодифосфат-альдолазы в печени, почках, слизистой оболочке кишок. После приёма фруктозы у больных возникает гипогликемия. Развивается поражение печени, почек. Вторая форма фруктозурии – доброкачественная, протекает бессимптомно, связана с недостаточностью в печени кетогексокиназы, катализирующей превращение фруктозы в фруктозо-1-фосфат, в результате чего фруктоза накапливается в крови.
Расстройства водно-электролитного обмена
Вода – самое распространенное химическое соединение в мире живого. Вода – оптимальная среда для растворения и транспорта органических и неорганических веществ и реакций метаболизма. В жидкой среде осуществляются пищеварение и всасывание в кровь питательных веществ. С водой из организма удаляются продукты его жизнедеятельности. Вода является необходимым компонентом для осуществления большинства функций организма.
Общее содержание воды в организме зависит от возраста, массы тела и пола. Содержание воды с возрастом уменьшается. Этот процесс продолжается до глубокой старости. Общее количество воды в организме составляет приблизительно 57-60% от общей массы тела. У новорожденных до 75%. Когда говорят о воде, содержащейся в организме, обычно пользуются термином «жидкостное пространство».
Различают следующие жидкостные пространства.
1. Внутриклеточное пространство, в котором сосредоточено около 35% воды организма (около 24 л).
2. Внеклеточное пространство. Жидкость, находящаяся вне клеток, называется внеклеточной жидкостью. Этот вид жидкости подразделяется на:
- интерстициальную межклеточную жидкость (около 12 л);
- плазму крови (около 3 л) Постоянно обменивается с интерстициальной жидкостью через поры в капиллярах;
- лимфу.
3. Трансцеллюлярная жидкость (1-3% внеклеточной жидкости):
- спиномозговая жидкость;
- внутриглазная жидкость;
- жидкость полостей:
- брюшной;
- плевральной;
- перикардиальной;
- суставных сумок;
- желудочно-кишечного тракта.
Водный обмен неразрывно связан с обменом электролитов.
Плазма крови содержит много ионов Na+ и Cl-, и мало К+; Ca2+, Mg2+ и ионов органических кислот. Коллоидно-осмотическое давление 25-28 мм рт.ст.
Внутриклеточная жидкость содержит мало Na+ и Cl-, почти не содержит ионов Ca2+; но много К+, умеренное количество Mg2+. Кроме того, внутриклеточная жидкость содержит белков в 4 раза больше плазмы.
Жидкость находится в постоянном движении. Жидкость, омывающая клетки, доставляет организму питательные вещества, кислород и удаляет продукты метаболизма и углекислый газ.
Клеточные мембраны проницаемы для воды, но не проницаемы для многих растворенных в ней веществ, поэтому движение жидкости между внеклеточным и внутриклеточным пространством происходит по осмотическому градиенту.
Вода перемещается через биологические мембраны в сторону более высокой концентрации растворенных веществ. Этот феномен называется осмосом и является одним из видов массивного транспорта воды. Уровень гидростатического давления, необходимый для прекращения осмоса называется осмотическим давлением.
Обмен воды между сосудистым руслом и тканями осуществляется по закону Старлинга. Через стенки капилляров легко перемещается вода, электролиты, но трудно перемещаются белки. Концентрация белка в плазме крови 60-80 г/л, а в тканевой жидкости – 10-30 г/л.
Величина онкотического давления в крови 25-28 мм рт. ст., а в межклеточном пространстве около 5 мм рт. ст. Разность этих давлений называется эффективным онкотическим давлением, которое тянет воду в капилляры. Гидростатическое давление крови в артериальном конце капилляра больше, чем в венозном.
Разность между гидростатическим давлением крови и гидростатическим давлением тканевой жидкости называется эффективным гидростатическим давлением, оно равно 36-38 мм рт. ст. в артериальном конце и 14-16 мм рт. ст. в венозном конце капилляра.
В тех капиллярах, где эффективное гидростатическое давление выше эффективного онкотического давления происходит фильтрация жидкости из сосудов в тканевое пространство, в тех капиллярах, где эффективное гидростатическое давление меньше эффективного онкотического давления происходит реабсорбция (всасывание) жидкости из ткани в сосудистое русло.
У здорового человека за сутки фильтруется до 20 л жидкости, 17 л всасывается обратно и около 3 л оттекает из ткани по лимфатическим капиллярам и через лимфатическую систему возвращается в сосудистое русло.
В регуляции водного баланса принимают участие антидиуретический гормон, альдостерон, тироксин и др. Нарушения водного обмена проявляются обезвоживанием (гипогидротация) или задержкой воды в организме (гипергидротация).
Суточный баланс воды в организме взрослого человека обусловлен потреблением и выведением жидкости.
|
- Поступление, мл |
- Выделение, мл |
|
- С твердой пищей (1000) |
- С мочой (1400) |
|
- С жидкой пищей (1200) |
- С потом (600) |
|
- Образующаяся в организме (300) |
- С выдыхаемым воздухом (300) |
|
|
- С фекальными массами (200) |
|
- Всего 2500 |
- Всего 2500 |
Изменения или нарушения водного обмена обозначаются как положительный (накопление в организме избытка воды) или отрицательный (дефицит в организме воды) баланс.
В норме количество выделяемой из организма воды соответствует количеству потребляемой воды (2,5 л).
Основы регуляции водного баланса
Система регуляции обмена воды имеет сложную структуру. Цель этой системы поддержание оптимального объема жидкости в организме. Функция системы регуляция водного обмена тесно связана с системами контроля солевого обмена и осмотического давления. Эта система включает центральное, афферентное и эфферентное звенья.
Центральное звено системы – это центр жажды, расположенный в переднем гипоталамусе. Центр связан с областями коры большого мозга, участвующими в формировании чувства жажды или водного комфорта.
Афферентное звено представлено волюмо- и осморецепторами и дистантными рецепторами (главным образом зрительным и слуховым). Раздражение осморецепторов гипоталамуса (при повышении осмолярности крови) и рефлекторные влияния волюморецепторов левого предсердия (при снижении объема крови) вызывают стимуляцию ядер гипоталамуса и увеличение выхода антидиуретического гормона, который усиливает реабсорбцию воды в канальцах почек.
Рефлекторное влияние с волюморецепторов правого предсердия (при уменьшении объема крови) и понижение давления в почечной артерии вызывает увеличение секреции альдостерона, который повышает реабсорбцию натрия и способствует его задержке в организме. Активация секреции альдостерона осуществляется через промежуточные гуморальные звенья (ренин-ангиотензиновая система, минералокортикоиды и др.). Регуляторные стимулы от нейронов центра жажды адресуются эффекторным структурам.
Эффекторное звено – почки, потовые железы, кишечник, легкие. Эти органы обеспечивают устранение отклонений содержания воды и солей в организме. Главными регуляторами экскреторной функции почек являются АДГ, система «ренин-ангиотензин-альдостерон», катехоламины, простагландины, минералокортикоиды. При нарушении эффективности этой системы развиваются различные нарушения водного обмена.
У здорового человека поддержание постоянства водного баланса контролируется поведенческими реакциями, обеспечивающими удовлетворение жажды и механизмами удаления воды почками, благодаря их способности концентрировать или разводить мочу. Высокое осмотическое давление плазмы способствует максимальной секреции АДГ и выделению концентрированной мочи с высоким удельным весом. Снижение осмотического давления подавляет высвобождение АДГ и обусловливает выделение мочи с низким удельным весом. При патологических состояниях нарушается механизм взаимодействия систем, регулирующих водный баланс.
Известны следующие нарушения водного баланса организма: отрицательный, сопровождающийся развитием обезвоживания (гипогидротация), и положительный, приводящий к развитию отеков и водянок (гипергидратация).
Расстройства водно-электролитного обмена развиваются и при нарушении поступления воды в организм из внешней среды. Избыточное ее поступление, по сравнению с выделительными способностями организма, приводит к развитию водной интоксикации. Недостаточное поступление к развитию водного истощения.
Формы нарушения водного баланса
Различают две основные формы нарушения водного баланса:
- увеличение объема внеклеточной жидкости (гиперволемия);
- уменьшение объема внеклеточной жидкости (гиповолемия).
Обезвоживание (гипогидротация) возникает при:
- ограничении приема воды;
- избыточном ее выведении;
- нарушении минерального обмена;
- при сочетании этих причин.
Ограничение приема воды возникает при: водном голодании (при полном водном голодании продолжительность жизни взрослого человека составляет 7-10 дней); коматозных состояниях; бешенстве.
Избыточное выведение наблюдается при: поносе, неукротимой рвоте, кровопотерях, усиленном мочевыведении, при некоторых заболеваниях гипофиза, сопровождающихся уменьшением секреции АДГ (несахарный диабет, несахарное мочеизнурение) при тяжелых обширных ожогах; обильном потоотделении.
Обезвоживание у детей первых двух лет протекает очень тяжело и может привести к смерти.
Экспериментальное воспроизведение обезвоживания
В эксперименте обезвоживание можно получить следующими путями:
- ограничением или лишением организма воды в сочетании с рационом богатым белками;
- дачей слабительных средств в сочетании с уменьшением воды;
- внутривенным введением гипертонических растворов;
- назначением рвотных средств (апоморфин).
Указанные методы приводят к длительному обезвоживанию организма, что сопровождается нарушением функций различных органов.
Нарушение деятельности сердечно-сосудистой системы.
Обезвоживание приводит к:
- сгущению крови – ангидремии;
- уменьшению объема циркулирующей крови – гиповолемии;
- падению артериального давления;
- снижению минутного объема крови;
- перераспределению крови (снижается кровоснабжение почек и мышц, но увеличивается кровоснабжение сердца, мозга, печени).
Нарушение деятельности цнс.
В основе расстройств ЦНС лежит нарушение кровообращения. Нарушение кровообращения приводит к:
- недостаточному поступлению питательных веществ (глюкозы);
- гипоксии;
- нарушению ферментативных процессов.
Нарушение выделительной системы приводит к судорогам, галлюцинациям, коматозному состоянию. Снижается выделительная функция почек, в основе лежит недостаточное кровоснабжение паренхимы почек. Развивается почечная недостаточность, приводящая к развитию негазового ацидоза
Расстройство деятельности желудочно-кишечного тракта. Торможение ферментативных процессов приводит к нарушению пищеварения и угнетению перистальтики желудка и кишечника.
Гипергидратация возникает при избыточном введении в организм жидкости или уменьшении ее выделения. Увеличение объема внутриклеточной жидкости, как правило, сопровождается развитием отеков.
Отек – избыточное накопление жидкости в межклеточном пространстве.
Водянка – скопление внеклеточной жидкости в полостях тела, скопление жидкости в брюшной полости называется асцитом; в плевральной полости – гидротораксом; в желудочках мозга – гидроцефалус; в околосердечной сумке – гидроперикардитом; скопление жидкости в межклеточном пространстве кожи и подкожной клетчатке – анасаркой.
Скопившаяся жидкость в полостях называется транссудатом.
Причинами развития отеков являются: задержка натрия (первичный и вторичный альдостеронизм); гипопротеинемия (уменьшение содержания белков в плазме (болезни печени, нефротический синдром)); увеличение выработки антидиуретического гормона.
В норме обмен воды между кровью и тканями происходит в микроциркуляторном русле через стенку капилляров. В артериальном конце жидкость уходит в межтканевое пространство, а в венозном возвращается в кровь. Отеки развиваются в результате увеличения выхода плазмы в интерстициальное пространство или в результате уменьшения ее реабсорбции в сосуды.
В механизмах развития отеков большое значение имеют: повышение гидростатического давления; понижение онкотического давления; повышение проницаемости мембран капилляров; снижение осмотического давления крови и повышение осмотического давления тканей.
Первый механизм включается при повышении кровяного давления в венах и давления в лимфатических сосудах.
Второй механизм включается при: уменьшении онкотического давления крови (при потере почками альбумина, снижении его синтеза в печени); увеличении онкотического давления тканей (усиленный распад белков тканей, выход альбуминов из крови, изменение гидрофильности белков при ацидозе).
Третий механизм включается при: расстройстве обмена веществ, приводящем к ацидозу; интоксикации и аллергии, вызывающих высвобождение биологически активных веществ, при потере калия мембранами клеток.
Четвертый механизм включается при снижении осмотического давления крови и повышении осмотического давления тканей (ацидоз, усиливающий диссоциацию солей; лихорадка, воспаление, венозная гиперемия).
В зависимости от причин и механизма развития выделяют: сердечные (застойные); почечные (нефротические); голодные (кахектические); печеночные; воспалительные; аллергические; лимфогенные и нейрогенные отеки.
Сердечные отеки возникают при венозном застое и повышении венозного давления, например, при недостаточности правого желудочка.
Почечный отек обусловлен уменьшением фильтрации жидкости в клубочках почки, что ведет к задержке воды в организме.
Печеночный отек развивается в результате нарушения синтеза белка, возникновения гипопротенемии или развития застойных явлений в системе воротной вены.
В развитии кахектических (голодных) отеков главную роль играют гипопротеинемия и повышение проницаемости стенок сосудов.
В патогенезе воспалительных и токсических отеков (действие отравляющих веществ, укусы змей, пчел) первостепенную роль играет нарушение сосудистой проницаемости.
Нейрогенный отек развивается в результате нарушения нервной регуляции водного обмена, трофики тканей и сосудов (ангиотрофоневроз). Отеки конечностей при частичных параличах, отек лица при заболевании тройничного нерва. В их происхождении главная роль принадлежит повышению сосудистой проницаемости и нарушениям обмена веществ в пораженных тканях.
Аллергический отек возникает в сенсибилизированном организме (крапивница, аллергическая сыпь). Механизм отека связан с высвобождением биологически активных веществ, повышающих сосудистую проницаемость и образованием иммунных комплексов.
В развитии любого отека различают две стадии.
В первой стадии избыток жидкости накапливается в коллагеновых волокнах основного вещества соединительной ткани, увеличивая массу фиксированной межтканевой жидкости. Когда масса фиксированной жидкости увеличивается примерно на 30%, начинается вторая стадия, характеризующаяся накоплением свободной межтканевой жидкости. Эта жидкость может перемещаться и поэтому дает «симптом ямки» при надавливании на отекшую ткань.
Последствия зависят от степени отека. Значительные отеки нарушают функцию органов и тканей и нередко создают угрозу для жизни пациента.
Отечная жидкость сдавливает ткани, нарушает в них кровообращение. Это расстраивает трофику тканей и вызывает в них дистрофические изменения. Особенно опасны отеки мозга, легких и гортани.
Нарушения электролитного обмена
Биологические жидкости организма человека (внутри- и внеклеточные) представляют собой растворы, содержащие электролиты. Определенный ионный
состав жидкостей необходим для поддержания многих жизненных процессов. Например, функция ферментов оптимальна только в условиях определенной концентрации ионов и величины pН. Многие гормоны могут «работать» благодаря изменению проницаемости сосудистой стенки для некоторых ионов.
Нарушения ионного обмена – причина различных расстройств жизнедеятельности организма. Это обусловлено участием ионов во многих процессах:
- поддержания осмотического давления, pH, pO2;
- распределения воды во внутри- и внеклеточном пространстве;
- реализации действия биологически активных веществ;
- метаболизма белков, жиров, углеводов;
- регуляции физико-химического состояния клеточных мембран (их проницаемости, возбудимости).
Ионный состав внутри клетки значительно отличается от ионного состава внеклеточной жидкости.
Например, калия больше внутри клетки, магний и фосфаты тоже сосредоточены в клетке, а натрия больше во внеклеточной жидкости.
Натрий – главный осмотический фактор и электролит внеклеточной жидкости. Около 30% всего натрия организма (34-46 г) находится в скелете. Отрицательный баланс натрия (гипонатриемия) возможен при повышенной его потере с мочой, потом или кишечным соком, недостаточном поступлении в организм (голодание полное и частичное). Нарушение обратного всасывания натрия наблюдается при недостаточной выработке альдостерона. Снижение содержания натрия развивается при длительном применении сульфаниламидных препаратов и салуретиков, усиливающих выведение натрия почками.
Проявления гипонатриемии
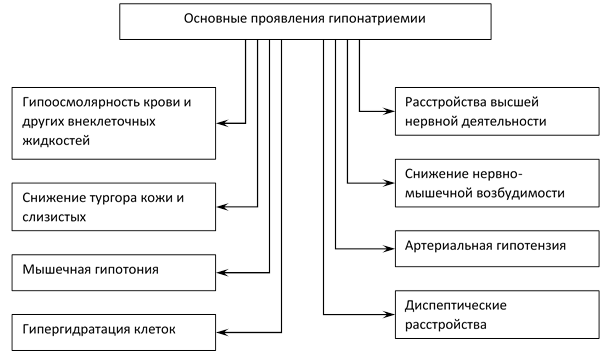
Рис. 7. Проявления гипонатриемии (П.Ф. Литвицкий, 2016).
Положительный баланс натрия (гипернатриемия) наблюдается при избыточном потреблении соли, при нарушении его выведения почками, при избыточной продукции альдостерона.
Избыток солей натрия способствует развитию отеков развитию гипертонии, гипогидратации клеток, повышению нервно-мышечной возбудимости.
Нарушения обмена хлора сопутствуют нарушениям обмена натрия и калия.
Гиперхлоремия – увеличение содержания Cl- в сыворотке крови выше нормы (более 108 ммоль/л).
Причины гиперхлоремии:
- повышенное потребление с пищей и питьем, в основном в составе поваренной соли;
- снижение выведения из организма;
- перераспределение Cl- из тканей в кровь (почечная недостаточность, экзогенный ацидоз).
Гипохлоремия – снижение содержания Cl- в сыворотке крови ниже нормы (96 ммоль/л).
Причины гипохлоремии:
- увеличение выведения Cl- из организма (обильная рвота, хронические поносы);
- перераспределение Cl- из крови в ткани (ацидоз, избыток жидкости в интерстициальном пространстве, асцит);
- снижение поступления хлоридов в организм (голодание, исключение из рациона поваренной соли).
Проявления гипо- и гиперхлоремии не имеют выраженной специфики. Они значительно перекрываются признаками гипо- и гипернатриемии и гипо- и гиперкалиемии.
Содержание калия в организме составляет 156-235 г, 2/3 этого количества приходится на мышцы и больше 5% - на скелет. Нарушение обмена калия тесно связано с нарушением обмена натрия.
Недостаток калия может развиваться при недостаточном поступлении его с пищей (овощи, молочные продукты), при потере его с рвотными массами, при поносе, при длительном применении кортикотропина, глюкокортикоидов и гиперальдостеронизме. Гипокалиемия приводит к развитию внутриклеточного ацидоза, снижению нервно-мышечной возбудимости, мышечной гипотонии, гипокинезии желудка и кишечника, дистрофии тканей, артериальной гипотензии, психастении, аритмии сердца, остановке сердца в диастоле. Задержка калия (гиперкалиемия) в организме наблюдает при избытке его в пище, при нарушении его выделения почками, при гипофункции коры надпочечников (Аддисонова болезнь), при тканевом распаде.
Основными проявлениями гиперкалиемии являются: мышечная гипотония, атония кишечника, параличи мышц, боли в мышцах, брадикардия, аритмии сердца.
Магний необходим для нормального функционирования некоторых ферментов, регулирующих углеводный обмен. В организме человека содержится около 24 г магния, половина которого находится в скелете. Гипермагниемия возникает при потреблении пищи богатой магнием (зеленые части растений, горох, фасоль, пшено и др.), при ацидозе, при нарушении выведения почками при уремии. При этом наблюдается угнетение высшей нервной деятельности вплоть до потери сознания («магнезиальный сон»), альвеолярная гиповентиляция, мышечная гипотония и гипокинезия, артериальная гипотензия.
Гипомагниемия возникает при: дефиците магния в пище, нарушении его всасывания в кишечнике, нарушении выведения из организма, респираторном алкалозе, алкогольной абстиненции. Основными проявлениями дефицита магния являются: повышение нервно-мышечной возбудимости, тахикардия, задержка роста организма, аритмии сердца, нарушение усвоения пищи в кишечнике, повышение артериального давления, гипотермия, гипокальциемия, гипокалиемия, дистрофии тканей.
Кальций содержится в основном в костях и зубах, в сыворотке крови и других жидкостях. Обмен кальция тесно связан с обменом фосфора: гиперкальциемия обусловливает снижение уровня фосфатов в крови, а гипокальциемия – увеличение.
Гиперкальциемия – повышение общего содержания кальция в сыворотке крови выше нормы (более 2,57 ммоль/л или 10,3 мг%).
Причины гиперкальциемии:
- избыточное поступление солей кальция в организм (парентеральное введение);
- уменьшение выведения Ca2+ почками;
- перераспределение кальция из тканей в кровь (ацидоз при сердечной, почечной недостаточности);
- ограничение двигательной активности и действия фактора невесомости;
- злокачественные опухоли.
Основными проявлениями гиперкальциемии являются: гиперкальциурия, нефро- и уролитиаз, остеопороз, психоневрологические расстройства, желудочно-кишечные расстройства.
Гипокальциемия – снижение концентрации кальция в сыворотке крови ниже нормы (менее 2,23 ммоль/л или 8,5 мг%).
Причины гипокальциемии:
- гипопаратиреоз;
- гиповитаминоз Д;
- патология кишечника;
- ахолия – отсутствие в кишечнике желчи;
- хронический некомпенсированный алкалоз;
- гипомагниемия;
- гипоальбуминемия.
Основные проявления гипокальциемии: повышение нервно-мышечной возбудимости, снижение свертываемости крови, повышенная кровоточивость, дистрофии тканей – производных эктодермы.
Фосфор является одним из основных минеральных компонентов костной ткани. В норме в организм с продуктами питания поступает 120 мг фосфата, такое же количество выводится из организма.
Гиперфосфатемия – увеличение фосфора в сыворотке крови выше нормы (более 1,45 ммоль/л или 4,5 мг%).
Причины гиперфосфатемии:
- введение в организм фосфатов (инъекции их препаратов, введение per os или в кишечник);
- уменьшение выведения фосфатов из организма (почечная недостаточность, гип
- опаратиреоз, гипертиреоз);
- увеличение высвобождения фосфатов из тканей (острая деструкция мышечной ткани, распад опухолевой ткани).
Основными проявлениями гиперфосфатемии являются: артериальная гипотензия, гипокальциемия, сердечная недостаточность.
Гипофосфатемия – уменьшение концентрации фосфатов в сыворотке крови (менее 0,8 ммоль/л или 2,5 мг%).
Причины гипофосфатемии:
- недостаточное поступление фосфатов с пищей;
- избыточное выведение фосфатов из организма почками;
- избыточная потеря фосфатов через желудочно-кишечный тракт;
- перераспределение фосфатов из крови и межклеточной жидкости в клетки (активация гликолиза, алкалоз).
Проявление гипофосфатемии: фосфатурия, мышечная гипотония и гипокинезия, расстройства высшей нервной деятельности, сердечная недостаточность, остеопороз, остеомаляция.
Нарушения кислотно-основного баланса
Постоянство pН внутренней среды является необходимым условием существования человека и высших организмов. Оно обеспечивается определенным соотношением кислот и щелочей (оснований) в биологических средах, при нарушениях которого организм может погибнуть. Кислотами называются вещества, которые в растворах отдают ионы водорода (доноры протонов), а основаниями – вещества, связывающие эти ионы (акцепторы протонов).
Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода. Показателем этого содержания служит pН артериальной крови при температуре 37оС.
В норме pН колеблется в пределах 7,37-7,43, составляя в среднем 7,4. Сдвиг pН на 0,1 за пределы физиологических колебаний приводит к значительным нарушениям функционирования жизнеобеспечивающих систем, сдвиг на 0,3 обычно вызывает коматозное состояние, а на 0,4 – часто несовместимо с жизнью.
Поддерживается постоянство pН крови буферными системами крови, клеток, лёгкими, почками. Буфер – это слабая кислота или основание, которые противостоят изменению pН при добавлении сильной кислоты или основания.
Под кислотно-основным балансом (КОБ) понимают имеющееся в организме соответствие между поступлением извне, образованием внутри и выведением наружу кислот и оснований. К изменению КОБ могут приводить процессы, в результате которых изменяется или поступление в организм, или образование внутри организма в процессе метаболизма, или выделение во внешнюю среду веществ, обладающих свойствами кислот и оснований.
В организме имеются мощные гомеостатические механизмы, которые способны, во-первых, экстренно взаимодействовать с избытком водородных ионов или высвобождать дополнительное их количество при их недостатке; во-вторых, более или менее быстро удалять из крови углекислоту; в-третьих, достаточно медленно экскретировать нелетучие кислоты и основания. Данные механизмы, поддерживающие постоянство pН, осуществляются при участии: буферных систем крови; дыхательной системы; выделительных органов, – главным образом, почек, хотя в этом процессе принимают участие желудочно-кишечный тракт, печень и кожа.
Под буфером понимают водный раствор слабой кислоты и сопряженного с ней хорошо растворимого основания.
Общим свойством буферов является способность препятствовать изменению pН раствора при внесении в него щелочей или кислот.
К буферным системам относятся:
- бикарбонаты крови (NaHCO3);
- фосфаты – Na2HPO4 и Na H2PO4 (главный буфер почек);
- белки плазмы крови и белки в составе гемоглобина (главные внутриклеточные буферы);
- белки и фосфаты тканей.
Главная роль гемоглобиновой буферной системы заключается в ее участии в транспорте CO2 от тканей к легким.
Кислород в эритроците соединяется с гемоглобином, образуя оксигемоглобин (HbO2), имеющий очень кислую реакцию, но pН крови не изменяется, так как в эритроците есть бикарбонат калия (KHCO3). К оксигемоглобину присоединяется калий (KHbO2), а ион бикарбоната (HCO3)- взаимодействует с водородным ионом (Н+), образуя угольную кислоту (H2CO3), которая является более слабой кислотой, чем HbO2 (оксигемоглобин). Под влиянием карбоангидразы угольная кислота диссоциирует на воду и углекислый газ (H2O и CO2). CO2, раздражая дыхательный центр, выводится из организма через легкие. Легкие – это первая линия защиты в поддержании кислотно-основного баланса. Они обеспечивают механизм почти немедленной регуляции выделения кислоты. Следовательно, любое нарушение дыхания, сопровождающееся изменением минутной альвеолярной вентиляции, может стать причиной развития нарушения кислотно-основного баланса.
Важным физиологическим механизмом поддержания pН внутренней среды является выведение с мочой кислых и основных (щелочных) продуктов. В почках происходит дезаминирование аминокислот с образованием аммиака, который сберегает щелочные катионы плазмы крови Na+, К+, Ca2+, Mg2+, особенно Na+.
Угольная кислота в эпителии канальцев служит источником секретируемых в мочу ионов водорода, а образовавшийся из угольной кислоты бикарбонат (HCO3)- и обратное всасывание Na в почечных канальцах, взамен секретировавшихся ионов водорода, обеспечивают поступление натрия в кровь.
В почках угольная кислота взаимодействует с фосфатами натрия.
(H2CO3 + Na2HPO4 → NaHCO3 + NaH2PO4) в результате бикарбонат натрия (NaHCO3) обратно всасывается, а кислый фосфат выводится с мочой, поэтому реакция мочи кислая (pН 5,3-6,5), таким образом восстанавливается щелочной резерв. В почках действует три механизма, поддерживающих постоянство внутренней среды:
- реабсорбция (обратное всасывание) Na+ и бикарбоната (HCO3)- при участии карбоангидразы клеток эпителия почечных канальцев;
- реабсорбция Na+ в процессе превращения однозамещенных фосфатов в двузамещенные в просвете канальцев;
- реабсорбция Na+ в сочетании с образованием аммиака в клетках эпителия дистальных почечных канальцев.
Роль желудочно-кишечного тракта, печени и кожи в регуляции кислотно-основного баланса.
Концентрация ионов Н+ в крови зависит также от деятельности желудка и кишечника. Клетки слизистой оболочки желудка секретируют с участием карбоангидразы соляную кислоту (HCl) в очень высокой концентрации. Взамен хлоридов в плазму в процессе желудочной секреции поступает бикарбонат. Существенного сдвига pН в сторону избытка оснований при этом не происходит, так как у здорового человека ионы хлора желудочного сока быстро всасываются в кровь в кишечнике, в обмен на бикарбонаты, которыми богат секрет поджелудочной и кишечных желез. Нарушение всасывания желудочного и кишечного соков или их массивная потеря вызывают сдвиг кислотно-основного баланса.
Печень также принимает участие в регуляции кислотно-основного баланса несколькими путями:
- окисляет недоокисленные вещества, поступающие по воротной вене из кишечника;
- синтезирует мочевину из аммиака;
- выделяет с желчью нелетучие кислоты и основания при их избыточном накоплении в желудочно-кишечном тракте.
Кожа в условиях избытка нелетучих кислот и оснований выделяет их с потом. Это имеет особое значение при нарушении функции почек.
Изменение pН в кислую сторону называется ацидозом, а в щелочную ‑ алкалозом.
Причины расстройств КОБ могут быть эндо- и экзогенными.
Эндогенные причины сдвигов КОБ являются наиболее частыми и значимыми в клинической практике. Это объясняется тем, что при многих заболеваниях нарушаются функции, как химических буферных систем, так и физиологических механизмов поддерживающих оптимальный уровень КОБ.
Экзогенные причины связаны с избыточным поступлением в организм веществ кислого или щелочного характера:
- лекарственные средства, применяемые с нарушением дозировки и/или схем лечения (салицилаты, растворы для искусственного питания, включающие белки);
- токсические вещества, употребляемые случайно или осознанно (метанол, соляная кислота, паральдегид и др.);
- продукты питания. Ацидоз развивается при использовании синтетических диет, содержащих аминокислоты. Потребление в больших количествах щелочных минеральных вод и молока.
По степени выраженности ацидоз и алкалоз могут быть компенсированными, субкомпенсированными и декомпенсированными.
При компенсированной форме за счет буферных систем pН крови удерживается в пределах физиологической нормы (7,37-7,43).
При субкомпенсированных формах нарушений кислотно-основного баланса изменения pН крови лежит в пределах 7,32-7,20 для ацидоза и 7,46-7,50 для алкалоза.
При декомпенсированной форме буферные системы оказываются неэффективными и поэтому pН крови выходит за пределы 7,19-6,80 для ацидоза и 7,55 для алкалоза.
По механизму развития ацидозы и алкалозы классифицируются на обменные (метаболические или негазовые) и дыхательные (респираторные или газовые).
Респираторный (газовый ацидоз) или первичная гиперкапния – это нарушение КОБ, обусловленное увеличением концентрации углекислоты и повышением ее парциального давления в крови. Причинами респираторного ацидоза могут быть:
- высокая концентрация CO2 (углекислого газа) во вдыхаемом воздухе;
- недостаточность легочной вентиляции (угнетение дыхательного центра, тяжелые заболевания легких, асфиксия, нарушение регуляции бронхолегочной системы);
- недостаточность кровообращения, когда в результате резкого снижения кровотока замедляется выведение углекислоты из крови;
- патологические процессы в центральной нервной системе, спинном мозге, при нарушениях нервно-мышечного аппарата грудной клетки или скелетных мышц (например, кифосколиоз, ожирение) могут способствовать развитию газового ацидоза.
Острый респираторный ацидоз наблюдается при остром затруднении прохождения вдыхаемого воздуха по воздухоносным путям (отек гортани, острый бронхиолит и др.)
Хронический газовый ацидоз развивается при хронических процессах (хронический бронхит, бронхоэктазы, эмфизема, слабость дыхательной мускулатуры).
Клинические проявления респираторного ацидоза обусловлены, главным образом, изменениями центральной нервной системы в связи с развитием гиперкапнической энцефалопатии. Тяжесть расстройств зависит от величины гиперкапнии, быстроты ее развития, степени снижения pН и степени сопутствующей гипоксии.
Появляется раздражительность, головные боли, анорексия (отсутствие аппетита), спутанность сознания, в тяжелых случаях – галлюцинации, преходящий психоз. Могут появиться изменения в сердечно-сосудистой системе (снижение сократительной способности сердца).
Метаболический (негазовый) ацидоз – нарушение КОБ, вызванное снижением содержания иона бикарбоната (НСО3)- в плазме и характеризующиеся снижением pН.
Метаболический ацидоз может быть вызван несколькими причинами:
- неспособностью почек удалять ионы водорода (почечная недостаточность, не резко выраженный гипоальдостеронизм, нефриты, уремия);
- появлением избытка ионов водорода в плазме;
- избыточным образованием органических кислот при нарушении обмена веществ, например, при декомпенсированном сахарном диабете, врожденном дефекте метаболизма, голодании, гипоксии, наркозе;
- потерей организмом большого количества бикарбонатов с пищеварительными соками (панкреатический и кишечный) и мочой, при продолжительных поносах, свищах кишечника, хирургическом удалении большой части кишечника, непроходимости кишечника. Бикарбонаты могут теряться с мочой при врожденном недоразвитии участка нефрона, ответственного за их реабсорбцию, при нефропатии беременных;
- избыточном введении минеральных кислот (передозировка ацетилсалициловой кислоты, отравление уксусной кислотой).
Негазовый ацидоз – самая частая и очень тяжелая форма нарушения КОБ. В его основе лежит накопление в организме нелетучих кислых продуктов (молочная, b-оксимасляная, ацетоуксусная кислота и др.). Особенно тяжело метаболический ацидоз протекает у детей, так как у них ограничены щелочные резервы.
На ранних стадиях метаболического ацидоза для нейтрализации избытка водородных ионов (Н+) мобилизуются бикарбонаты (НСО3)- и фосфаты. Увеличивается способность почек выводить органические кислоты. Если эти механизмы истощаются, то развивается декомпенсированная форма метаболического ацидоза.
Метаболический ацидоз клинически проявляется: развитием дыхания Куссмауля, тахикардией, снижением сократительной функции сердца, возможно возникновение угрожающей жизни аритмии, нарушением образования мочи, судорогами, нарушением сознания, понижением сродства гемоглобина к кислороду, в результате чего затрудняется образование в легких оксигемоглобина и отдача кислорода в тканях. Это в совокупности с нарушениями сердечной деятельности ведет к развитию гипоксемии и гипоксии. При падении pН крови ниже 7,2 развивается коматозное состояние.
Респираторный алкалоз, или первичная гипокапния, - нарушение КОБ, вызванное снижением напряжения СО2 в биологических жидкостях (менее 35 мм. рт. ст.).
Причины респираторного алкалоза:
- высокогорная дыхательная гипоксия (дыхательный центр возбуждается недостатком кислорода);
- гипервентиляция легких, в механизме которой лежит возбуждение дыхательного центра, вызванное патологическим процессом в мозге (опухоль, инсульт, травма);
- длительная усиленная искусственная вентиляция легких.
Быстро включающимся механизмом компенсации при газовом алкалозе является снижение возбудимости дыхательного центра. Это ведет к урежению дыхания и задержке СО2 в организме. При дефиците угольной кислоты из эритроцитов в плазму поступают ионы хлора. Они вытесняют натрий из бикарбоната, в результате чего его содержание уменьшается, а концентрация угольной кислоты увеличивается. Через 16-18 часов начинает проявляться почечный компенсаторный механизм – снижается секреция водородных ионов и тормозится реабсорбция бикарбоната, который усиленно выводится с мочой. Моча становится щелочной. При истощении и недостаточности этих механизмов развивается декомпенсированный алкалоз.
Клинические проявления – появление периодического дыхания, снижение артериального давления, может развиться коллапс, уменьшается объем циркулирующей крови снижается снабжение кислородом головного мозга. В связи с выведением солей натрия и калия снижается осмотическое давление крови, возрастает диурез и развивается обезвоживание организма.
При декомпенсированном алкалозе может развиться тетания, так как уменьшение концентрации ионов водорода ведет к снижению содержания ионов кальция, что вызывает повышение нервно-мышечной возбудимости.
Метаболический (негазовый алкалоз) – нарушение КОБ, характеризующееся повышением концентрации ионов бикарбоната и увеличением pН крови. Причинами развития могут быть:
- накопление бикарбонатов в результате избыточного их введения;
- образование избытка бикарбонатов при окислении органических кислот (лактата, цитрата), поступающих с пищей;
- потеря больших количеств соляной кислоты с желудочным соком (неукротимая рвота, желудочный свищ);
- дефицит калия (потеря его через желудочно-кишечный тракт, прием диуретиков, увеличение продукции альдостерона);
- врожденный метаболический алкалоз у детей (хлордиарея), в основе которого лежит потеря хлора и калия в связи с патологическими изменениями в кишечнике. У детей отмечаются упорные поносы, при этом каловые массы богаты хлором. Дети отстают в физическом развитии.
Компенсаторные механизмы при этом виде алкалоза направлены на выведение из организма бикарбонатов и задержку угольной кислоты. Понижается чувствительность дыхательного центра к СО2, в результате снижается легочная вентиляция. Почки выделяют щелочную мочу.
Клинические проявления: угнетение дыхания, увеличение мышечного тонуса, тетания и судороги, гиповолемия, нарушение ритма сердца.
Смешанные нарушения КОБ
Смешанный метаболический ацидоз и респираторный ацидоз.
Сочетание дефицита бикарбоната и гиперкапнии может снижать pН до очень низкого и опасного уровня. Это наблюдается при сочетании недостаточности дыхания и кровообращения.
Смешанный метаболический и респираторный алкалоз.
Сочетание избытка бикарбоната и гипокапнии часто развивается при токсикозах первой половины беременности – тошноте и рвоте.
Смешанный метаболический ацидоз и респираторный алкалоз наблюдается часто у больных в критических состояниях (при печеночной недостаточности, а также в том случае, если к первичному респираторному алкалозу присоединяется метаболический ацидоз в результате сепсиса или алкогольного кетоацидоза).
Алкогольный кетоацидоз развивается при хроническом алкоголизме, в тех случаях, когда в период злоупотребления алкоголя пациент потребляет мало пищи (частичное голодание). В этом случае происходит образование b-оксимасляной кислоты вместо ацетоуксусной кислоты, то есть образуются кетоновые тела (кетоацидоз).
Скачано с www.znanio.ru
[1] Танжье – остров в Чесапикском заливе (Вирджиния, США), где впервые зафиксирована болезнь.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.