
ПЛАН ЗАНЯТИЯ
1. Дата занятия; дисциплина (МДК): Химия
2. Тема занятия: Непредельные углеводороды
3. Вид занятия: теоретическое, тип: комбинированное;
4. Продолжительность занятия в минутах: (90 минут)
5. Цель занятия:
- Изучить материал по теме «Непредельные углеводороды»
6. План занятия:
6.1. Изучение нового материала (45 минут):
1) Изучение материала по данной теме (используй Приложение 1).
6.2. Закрепление нового материала (40 минут):
2) Выполните задания (используй Приложение 2).
Приложение №1
Ненасыщенные (непредельные) углеводороды (алкены)
Ненасыщенными, или непредельными, углеводородами называют такие углеводороды, элементарный состав которых характеризуется меньшим содержанием водорода по сравнению с соответствующими по числу углеродных атомов предельными углеводородами.
Согласно теории химического строения в ненасыщенных углеводородах углерод также имеет валентность равную четырем, но строение этих соединений отличается тем, что в их молекулах имеются пары углеродных атомов, соединенные так называемыми кратными – двойными или тройными – связями. Благодаря наличию кратных связей атомы углерода в непредельных углеводородах не до предела насыщены водородом; отсюда и возникло название - непредельные или ненасыщенные.
Все другие органические соединения, в молекулах которых имеются кратные связи между углеродными атомами, являются производными ненасыщенных углеводородов; их также называют непредельными органическими веществами.
В противоположность насыщенным, ненасыщенные углеводороды проявляют высокую активность в химических реакциях и особенно склонны к реакциям присоединения.
Этиленовые углеводороды образуют гомологический ряд, состав каждого члена которого выражается общей эмпирической формулой CnH2n. Родоначальником этого ряда является углеводород этилен состава С2Н4. Замещая в этилене каждый из водородных атомов на радикал метил, мы можем вывести следующий гомолог этого ряда – пропилен состава С3Н6, имеющий строение СН2=СН—СН3.
Точно также, в результате замещения на метил водородных атомов пропилена можно вывести формулу следующего непредельного углеводорода С4Н8. Как и в предыдущем ряду, у непредельных углеводородов, начиная с гомологов, содержащих четыре углеродных атома, проявляется изомерия.
В молекуле каждого изомера непредельного углеводорода С4Н8 должна быть одна двойная связь. Напишем вначале нормальные цепи из четырех углеродных атомов с двойной связью, причем в одном случае после первого, а во втором – после второго углеродного атома:
1 2 3 4 1 2 3 4
С=С—С—С С—С=С—С.
Очевидно, что помещать двойную связь после третьего атома углерода не имеет смысла, так как это будет равноценно ее расположению после первого углерода. Помня, что углерод всегда четырехвалентен, напишем около каждого углеродного атома цепи необходимое количество водородных атомов; таким образом, получим формулы непредельных углеводородов С4Н8 нормального строения, различающихся положением двойной связи и называемых бутиленами:
1 2 3 4 1 2 3 4
СН2=СН—СН2—СН3 (1) СН3—СН=СН—СН3 (2)
Номенклатура алкенов:
Двойную связь обозначают с помощью суффикса -ен. Основная цепь должна включать кратную связь. Нумерация цепи проводится с того конца, к которому ближе двойная связь.
|
CH3-CH2-CH2-CH=CH-CH3 |
|
|
гексен-2 (гексен-4) |
2-этилпентен-1 |
Строение алкенов
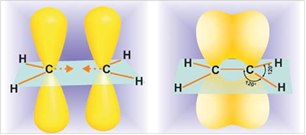
Рис. 1. Строение этилена
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о (рис. 1).
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью (рис. 2). В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи (рис. 3). В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
|
|
|
|
Рис. 2. Модель молекулы этена |
Рис. 3. Модель молекулы пропена |
Изомерия алкенов:
1. Изомерия углеродного скелета.
|
|
|
|
бутен-1 |
2-метилпропен |
2. Изомерия положения двойной связи.
|
|
|
|
бутен-1 |
бутен-2 |
3. Межклассовая изомерия (с циклоалканами).
|
|
|
|
циклобутан |
метилциклопропан |
4. Геометрическая изомерия.
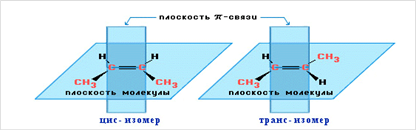
Рис. 4. Геометрические изомеры бутена-2
Вращения вокруг двойной связи не происходит, ведь для этого нужно разорвать π-связь. Из-за этого у алкенов существует изомерия, связанная с тем, что заместители могут располагаться по одну или по разные стороны двойной связи, как, например, у бутена-2 (рис. 4).
Для бутена-1 геометрическая изомерия невозможна (у одного из атомов С при двойной связи оба заместителя одинаковы: 2 атома водорода).
Физические свойства и нахождение в природе алкенов
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.
Это интересно
Этилен образуется в фруктах, регулируя процесс их созревания. К классу алкенов принадлежат феромоны некоторых насекомых.
Приложение№2
1. Непредельные углеводороды гомологического ряда первого представителя этилена имеют общую формулу Сn Н2n + 3?
2. Молекулярная формула бутена С2Н4?
2) Составьте изомеры состава:
а) СН3 –СН = СН – СН2- СН2- СН3;
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.