
Оксиды
Оксиды – это соединения, состоящие из двух элементов, одним их которых является кислород в степени окисления -2.
Например, оксид кальция: Са+2О-2. Не стоит путать оксиды и пероксиды. В состав пероксида входит кислород в степени окисления -1. Например, Н+12О-12, атомы кислорода связаны друг с другом.
Классификация оксидов
- По строению оксиды могут быть ионными или ковалентными соединениями. К ионным соединениям относятся оксиды щелочных и щелочноземельных металлов. Остальные оксиды – это оксиды с ковалентной полярной связью. Такие оксиды в твердом состоянии могут иметь либо атомную (SiO2), либо ионную кристаллическую решетку (твердые СО2 или SO2).
- По кислотно-основным свойствам оксиды делятся на:
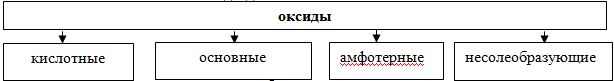
Кислотным оксидам соответствуют кислоты. Основным оксидам соответствуют основания. Амфотерным – амфотерные соединения. Несолеобразующими называются те оксиды, которым не соответствуют ни кислота, ни основание.
· Основные оксиды
К основным оксидам относятся оксиды металлов главной подгруппы первой и второй групп и оксиды некоторых переходных металлов в низших степенях окисления (Ag2O, HgO, NiO, Cu2O).
· Кислотные оксиды
Кислотные оксиды – это оксиды неметаллов (CO2, SO2, SiO2, SO3, P2O5) и некоторых переходных металлов в высоких степенях окисления (CrO3, Mn2O7, V2O5).
· Амфотерные оксиды
К амфотерным оксидам относятся оксиды некоторых металлов в степени окисления +2, +3, +4.
Это: BeO, ZnO, Cr2O3, Al2O3, SnO, TiO2, MnO2 .
· Несолеобразующие оксиды
Несолеобразующие оксиды представлены в основном такими: CO, NO, N2O, H2O, F2O, SiO.
Оксиды в природе
Оксиды – это довольно распространённый тип соединений. Примером такого соединения является вода, которая очень важна для жизни всех живых организмов, а также кварц и огромное количество его разновидностей (рис. 1-2). Массовая доля кварца и его разновидностей в земной коре составляет 60 %.
|
|
|
|
Рис. 1 |
Рис. 2 |
К оксидам относится углекислый газ, ржавчина и очень многие известные минералы.
Физические свойства оксидов
Оксиды обладают физическими свойствами.
Многие оксиды неметаллов при стандартных условиях газообразны CO2, SO2, SO3, оксиды азота.
Есть жидкие оксиды. Это, например, Mn2O7, Сl2O7.
Большинство оксидов металлов – твердые (Ag2O, HgO, NiO, Cu2O).

Рис. 3
Оксиды бывают бесцветными (CO2, SO2) или имеют окраску, например, NO2-, бурый газ (лисий хвост) (рис. 3).
Химические свойства оксидов
1. Отношение к воде: С водой реагируют оксиды щелочных и щелочноземельных металлов (Li2O, Na2O, K2O, Pb2O, Cs2O, CaO, SrO, BaO, RaO).
Na2O + H2O → 2NaOH (1)
CaO + H2O → Ca(OH)2 (2)
Оксиды, которым соответствуют нерастворимые основания, с водой не реагируют.
Кислотные оксиды реагируют с водой с образованием кислот. Исключение – SiO2.
N2O5 + H2O → 2HNO3 (3)
SO3 + H2O → H2SO4 (4)
Амфотерные и несолеобразующие оксиды с водой не взаимодействуют.
2. Важным химическим свойством оксидов являются реакции, приводящие к образованию солей.
В реакциях солеобразования участвуют вещества, обладающие противоположными кислотно-основными свойствами.
· Основные оксиды взаимодействуют с кислотами с образованием соли и воды.
MnO + 2HCl → MnCl2 + H2O (5)
· Амфотерные оксиды реагируют как с кислотами с образованием соли и воды, так и со щелочами.
ZnO + 2HCl → ZnCl2 + H2O (6)
ZnO + 2KOH → K2ZnO2 + H2O (7)
Такая реакция (7) может протекать как в растворе, так и при сплавлении. При этом образуются различные продукты, в которых металл, образующий оксид, находится в ионной форме.
· Кислотные оксиды реагируют с основаниями, с образованием соли и воды.
SO2 + 2KOH → K2SO3 + H2O (8)
· Основные и кислотные оксиды способны взаимодействовать между собой с образованием солей.
MnO + SO2 → MnSO3 (9)
3CaO + P2O5 → Ca3(PO4)2 (10)
Получение оксидов
1. При горении простых веществ. Не реагируют благородные газы, галогены, золото и платина.
Li + O2 → Li2O (11)
4P + 5O2 → 2P2O5 (12)
2. При горении сложных веществ.
CH4 + 2O2 → CO2 + 2H2O (13)
2H2S + 3O2 → 2SO2 + 2H2O (14)
3. Термическое разложение некоторых сложных веществ.
Mg(OH) ![]() MgO +
H2O
MgO +
H2O
H2SiO3 ![]() SiO2 +
H2O
SiO2 +
H2O
(CuOH)2CO3 ![]() 2CuO +
CO2 + H2O
2CuO +
CO2 + H2O
2Cu(NO3)2 ![]() 2CuO +
4NO2 + O2
2CuO +
4NO2 + O2
Диоксид циркония
Диоксид циркония – чрезвычайно стабильное соединение, поэтому его образование очень выгодно и приводит к выделению большого количества энергии. Из-за этого, если удается поджечь цирконий, его практически невозможно затушить, потому что он отбирает кислород даже у углекислого газа и песка. Затушить горящий цирконий можно только инертными газами.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.