
Тема урока: Периодическая система химических элементов.
Цель урока: рассмотреть периодическую систему химических элементов.
Задачи урока:
1) дать понятие о структуре периодической системы;
2) помочь учащимся выяснить сходство и различие в характере изменения свойств атомов элементов больших и малых периодов, особенности групп А и групп В.
3) обучать умению обобщать полученные сведения.
Тип урока: урок изучения нового материала
Методы: словесные, словесно-наглядные.
Формируемые понятия: периодическая система, главная группа, побочная группа, период.
Развиваемые понятия: периодический закон, периодичность, систематизация.
Литература для учителя: учебник 8 класса,
Сечко, О. И. Химия: 7 – 8 классы: дидактические материалы: пособие для учителей общеобразоват. учреждений / О. И. Сечко, И. И. Окова. – Минск: Аверсэв, 2009. – 128 с.
Литература для учащихся: учебник 8 класса
Ход урока
1) Организация начала занятия
Здравствуйте! Присаживайтесь. Кто дежурный? Кто сегодня отсутствует? У всех есть всё необходимое на партах? Приступим к занятию.
2) Проверка выполнения домашнего задания
2 ученика вызываются к доске для выполнения письменного задания (задания на карточках).
1. Составить уравнения реакций полной нейтрализации между кислотами (серная, фосфорная) и основаниями (гидроксид натрия и гидроксид магния). Назвать все образующиеся соединения.
Решение.
H2SO4 + 2 NaOH →Na2SO4 + 2H2O (сульфат натрия)
H2SO4 + Mg(OH)2 → MgSO4 + 2H2O (сульфат магния)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (фосфат натрия)
2H3PO4 + 3Mg(OH)2 → Mg3(PO4)2 + 6H2O (фосфат магния)
2. Составьте уравнения реакций, при помощи которых можно осуществить превращения согласно приведенной схеме:
Mg→MgO→ Mg(OH)2 →MgCl2
Решение.
2Mg + O2 → 2MgO
MgO + H2O → Mg(OH)2
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
В это время остальной класс занят фронтальным опросом.
Вопросы:
1. Какие характеристики химических элементов взял Д. И. Менделеев за основу своей систематизации? (атомная масса).
2. Почему открытый Д. И. Менделеевым закон носит название «периодического»? Каков смысл этого названия? (смысл заключается в том, что по мере непрерывного увеличения относительной атомной массы через определенное число элементов регулярно появляется схожесть состава и свойств соединений элементов).
3. Сформулируйте периодический закон.(отвечает несколько человек).
4. В каком году был открыт периодический закон? (1869).
5. Как изменяются металлические свойства простых веществ в периодах с возрастанием относительных атомных масс элементов, которые образуют эти вещества? (уменьшаются).
6. Как изменяются неметаллические свойства простых веществ в периодах с возрастанием относительных атомных масс элементов, которые образуют эти вещества? (увеличиваются).
7. Как изменяются свойства высших оксидов и соответствующих им гидроксидов (оснований и кислот) с возрастанием относительных атомных масс? (от основных к кислотным).
Учитель проходит по классу и проверяет наличие домашнего задания в тетрадях.
Зачитывается сообщение «Интересные факты из жизни Д. И. Менделеева».
3) Подготовка к основному этапу занятия
На предыдущем уроке мы рассмотрели периодический закон Д. И. Менделеева. Опираясь на периодический закон, Менделеев построил естественную классификацию химических элементов – периодическую систему химических элементов. Ее графическим изображением является таблица, которая так и называется – периодическая система химических элементов. Запишите в тетради тему урока.
4) Усвоение новых знаний и способов действий.
Формы таблиц различны (показать различные изображения таблицы Менделеева). В настоящее время наиболее широко используется таблица, представленная на первом форзаце учебника.
Каждый химический элемент занимает одну клетку, в которой указаны химический знак элемента, его название, значение относительной атомной массы и его атомный (порядковый) номер.
Основные структурные единицы периодической системы это периоды и группы. Горизонтальные ряды элементов называются периодами, а вертикальные столбцы – группами. Всего в таблице 7 периодов. Первые три периода называются малыми, остальные четыре большими. В таблице 18 групп. Группы А называются главными, а группы В – побочными. (записать в тетради определение периода и группы). В каждой группе находятся элементы со сходными химическими свойствами их атомов. Номер группы указывает (римскими цифрами), как правило, высшую валентность элементов в соединениях с кислородом.
Причину периодичности в изменении свойств химических элементов можно объяснить только на основе знаний о строении атома. К изучению строения атома мы приступим на следующем уроке.
5) Первичная проверка понимания
Давайте повторим:
Как назвал Д. И. Менделеев естественную классификацию химических элементов?(периодическая система химических элементов).
Назовите основные структурные единицы периодической системы. (периоды и группы).
Что такое период? (период – это горизонтальный ряд химических элементов, расположенных в порядке возрастания их относительных атомных масс, начинающийся щелочным металлом (или водородом) и заканчивающийся благородным газом).
Какие свойства элементов закономерно изменяются в периоде? (металлические и неметаллические свойства).
Дайте определение понятию «группа».(группа – это вертикальный ряд химических элементов в периодической системе, атомы которых обладают сходными свойствами).
6) Закрепления знаний и способов действий
1. Вычислить массовую долю кислорода в высшем оксиде химического элемента, порядковый номер которого 17.
Решение.
Элемент: хлор
Высший оксид: Cl2O7
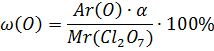
![]()
Ответ: ![]() = 61%
= 61%
2. Формула высшего оксида некоторого химического элемента ЭО. Укажите атомные номера, символы, номера периодов и типы групп трех химических элементов которые могут соответствовать данной формуле (задание выполняется устно).
7) Контроль и самопроверка знаний.
Весь класс проверяет правильность выполнения письменного задания в тетради. Исправляются ошибки на доске.
8) Подведение итогов занятия
Сегодня мы рассмотрели периодическую систему химических элементов, изучили такие понятия как период и группа, закрепили полученные знания. Все ли вам было понятно? Для того чтобы лучше усвоить изученный материал необходимо выполнить домашнее задание.
9) Информация о домашнем задании. Инструктаж по его выполнению.
Запишите задание на дом: § 8 задания 5 – 8.
10) Рефлексия
Продолжить предложения:
1) Сегодня на уроке я узнал…
2) Сегодня на уроке мне понравилось…
3)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.