
Публикация является частью публикации:
Габриелян, О.С.
Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений/О.С. Габриелян.- 3-е изд. перераб.- М.: Дрофа, 2007. – 191, [1] с.: ил.
Тема урока: «Аминокислоты».
Цель: изучить состав, строение, изомерию и химические свойства аминокислот.
Домашнее задание: § 17 (стр. 122-127), упр.10, задача 11.
Оборудование для проведения демонстрационного опыта: порошок CuO, растворы NaOH, глицина, индикаторов (фенолфталеина, метилоранжа, лакмуса), глутаминовой кислоты, универсальная индикаторная бумага, пробирки.
План изучения нового материала
1. Аминокислоты – производные карбоновых кислот.
2. Функциональные группы аминокислот
3. Номенклатура и изомерия аминокислот
4. Физические свойства аминокислот
5. Химические свойства. Аминокислоты – амфотерные органические соединения.
6. Пептидная связь. Полипептид
7. Нахождение в природе, значение и применение аминокислот.
Ход урока
Фронтальная беседа
1. Как изменяются физические свойства предельных аминов в гомологическом с ↑Mr? (Ответ: растворимость падает, агрегатное состояние Г-Ж-Т, плотность растёт, растут t•С кипения и плавления);
2. Какая группа является функциональной группой аминов и почему? (Ответ: аминогруппа, она определят основные химические свойства аминов как органических оснований);
3. Каково взаимное влияние атомов в молекуле анилина? (Ответ: радикал фенил влияет на аминогруппу, ослабляя основные свойства анилина; аминогруппа влияет на фенил, реакции замещения идут по положениям 2,4,6 цикла).
Демонстрационные опыты
· Определение реакции среды в водном растворе глицина и глутаминовой кислоты. С помощью полоски универсальной индикаторной бумаги (или растворов индикаторов) определяют рН 1% раствора глицина. Отсутствие кислой реакции раствора глицина объясняется образованием внутримолекулярной соли. Глицин – моноаминомонокарбоновая кислота. Аналогичные действия проводят с раствором глутаминовой кислоты – моноаминодикарбоновой кислотой. Реакция среды – кислая, рН-3,4-3,6.
· Реакция глицина с оксидом меди (II). В пробирку вносят 2 мл 1% раствора глицина, добавляют 1 г порошка оксидом меди (II). Появление голубой окраски раствора свидетельствует об образовании медной соли глицина.
· Реакция раствора глутаминовой кислоты с раствором гидроксида натрия. В пробирку вносят 1 мл раствора NaOH, несколько капель раствора фенолфталеина, затем по каплям добавляют раствор глутаминовой кислоты. Протекает реакция нейтрализации, раствор обесцвечивается.
Опорная схема № 1. Аминокислоты
(NH2)m R(COOH)n
 - NH2
аминогруппа - СООН карбоксильная группа
- NH2
аминогруппа - СООН карбоксильная группа
 Строение: бифункциональные
вещества, взаимное влияние атомов, новые специфические свойства, «внутренние
соли», ионный тип связи.
Строение: бифункциональные
вещества, взаимное влияние атомов, новые специфические свойства, «внутренние
соли», ионный тип связи.
Физические свойства: б/ц кристалл. в-ва, х. р. в H2O, плавящиеся с разложением
при t >200ºС, б/в или вкус сладкий, горький.
Изомерия: - углеродного скелета;
- положения аминогруппы;
- межклассовая (нитросоединения, сложные эфиры);
- оптическая.
Номенклатура: «амино» + название кислоты
Химические свойства: NH2− R− СООН
↓ ↓
основные кислотные
свойства
↓ ↓
взаимодействие
с кислотами с основаниями и спиртам
Возможно образование двух видов солей одной аминокислоты
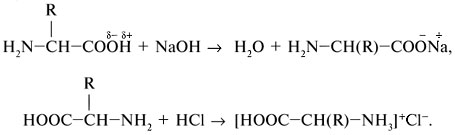


NH2− Аминокислоты - амфотерные органические соединения. − СООН
Поликонденсация аминокислот
O H
|| |
−C−N− пептидная связь, полипептид (см. стр. № 126)
Природные←Аминокислоты→Синтетические
↓
Незаменимые, пища
Синтезируемые организмом
Применение: пищевая, медицинская, химическая, микробиологическая промышленности.
Вопросы для беседы после изучения материала учебника: 1. Как называется первая аминокислота, выделенная химиками из природных объектов? (аспарагин из сока спаржи); 2. Каково значение аспарагиновой и глутаминовой кислоты для живых организмов? (аспарагиновая кислота связывает аммиак, глутаминовая содержится в мозге, сердечной мышце и плазме крови, связывает аммиак); 3. Каково применение глутаминовой кислоты и её солей? (пищевые добавки).
Латинское название вещества: Glycinum (род. Glycini)
Химическое название: аминоуксусная кислота
Брутто-формула: C2H5NO2
Характеристика вещества. Заменимая аминокислота. Белый кристаллический порошок, легко растворим в воде.
Применение вещества. Стрессовые состояния, психоэмоциональное напряжение, повышенная возбудимость, эмоциональная лабильность, неврозы, неврозоподобные состояния, вегетососудистая дистония, последствия нейроинфекций и черепно-мозговой травмы, нарушение сна; острый ишемический инсульт. Для повышения умственной работоспособности, в т.ч. подросткам с девиантными формами поведения.
Применение вещества. Эпилепсия, шизофрения, психозы, реактивные состояния, протекающие с явлениями истощения, депрессия, последствия менингита и энцефалита и др. В педиатрии — задержка психического развития, церебральный паралич, последствия внутричерепной родовой травмы, болезнь Дауна, полиомиелит (острый и восстановительный периоды).
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.