Предлагаемый методический материал может быть использован в качестве опорного плана при проведении урока химии в 8 классе соответствующей тематики. План урока может быть легко модифицирован учителем в соответствии со своими задумками – дополнен, расширен. В представленном плане указываются элементы содержания, требования к уровню подготовки, представлен краткий план самого урока.
П Л А Н У Р О К А Х И М И И В 8 К Л А С С Е
КЛАССИФИКАЦИЯ И СВОЙСТВА ОКСИДОВ
Э л е м е н т ы с о д е р ж а н и я : основные классы неорганических веществ.
Т р е б о в а н и я : уметь характеризовать свойства основных классов
неорганических веществ.
О б о р у д о в а н и е : колба, ложка для сжигания веществ, спиртовка, спички,
красный фосфор, вода, лакмус, растворы: NaOH, CaO, фенолфталеин, раствор
HCl.
Х о д у р о к а
I. Проверка домашнего задания (5–7 минут).
II. Экспрессконтроль.
I, III варианты – воспроизведение схемы на листочках (3 минут).
II, IV – работа по вариантам в тетрадях (7 минут).
Потом наоборот.
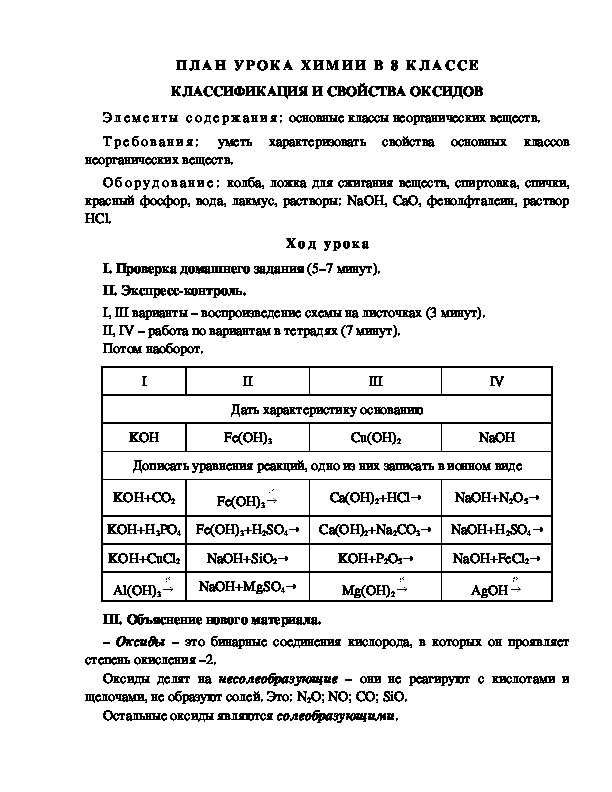
I
II
III
IV
Дать характеристику основанию
KOH
Fe(OH)3
Cu(OH)2
NaOH
Дописать уравнения реакций, одно из них записать в ионном виде
KOH+CO2
Fe(OH)3
Ca(OH)2+HCl→
NaOH+N2O5→
KOH+H3PO4 Fe(OH)3+H2SO4→ Ca(OH)2+Na2CO3→ NaOH+H2SO4→
NaOH+FeCl2→
KOH+P2O5→
KOH+CuCl2
Al(OH)3
NaOH+SiO2→
NaOH+MgSO4→
Mg(OH)2
AgOH
III. Объяснение нового материала.
– Оксиды – это бинарные соединения кислорода, в которых он проявляет
степень окисления –2.
Оксиды делят на несолеобразующие – они не реагируют с кислотами и
щелочами, не образуют солей. Это: N2O; NO; CO; SiO.
Остальные оксиды являются солеобразующими.Среди них выделяют
оксиды, которым соответствуют
основания (как правило, они образованы металлами) и кислотные оксиды,
которым соответствуют кислоты (они образованы неметаллами и переходными
элементами в степенях окисления выше +4).
основные
Упражнения:
составьте формулу
соответствующего основания или кислоты: CaO, N2O4, SO2, ZnO, SO3, CrO3, CrO,
Na2O.
определите характер оксида,
Химические свойства оксидов
Учитель демонстрирует опыт: получение P2O5, его растворение в воде и
щелочи. Учащиеся записывают уравнения реакций.
P2O5 + 3H2O = 2H3PO4
P2O5 + 6NaOH = 2Na3PO4 + 3H2O.
Далее учитель показывает взаимодействие CaO с H2O (фенолфталеин
доказывает наличие щелочи), с HCl. Учащиеся записывают уравнения.
CaO + H2O = Ca(OH)2
CaO + 2HCl = CaCl2 + H2O.
Оксиды реагируют между собой:
3CaO + P2O5 = Ca3(PO4)2
Д о м а ш н е е з а д а н и е : § 40, упр. 1–3; после § 38 упр. 6; после § 39 упр. 5.