Презентация по химии к уроку "Общая характеристика галогенов" Урок с использованием интерактивного обучения. Значение форм и методов обучения:
Стимулирование мотивации и интереса в области изучаемых предметов и в
общеобразовательном плане.
Повышение уровня активности и самостоятельности обучаемых.
Развитие навыков анализа, критичности мышления, взаимодействия, коммуникации.
Изменение установок и социальных ценностей.
Саморазвитие и развитие активизации с
преподавателем и учащимися.Презентация по химии к уроку "Общая характеристика галогенов"
разработка урока по
разработка урока по
Методическая
Методическая
химии в 9 классе
химии в 9 классе
Юлия Константиновна
Юлия Константиновна
МАОУ СОШ №36
МАОУ СОШ №36
Учитель:
Учитель:
Сушко
Сушко
г.Тамбова
г.Тамбова
МОУ СОШ № 5
МОУ СОШ № 5
им. Ю.А.Гагарина
им. Ю.А.Гагарина
Кабинет химии
Кабинет химии
Скажи мне - и я забуду,
Скажи мне - и я забуду,
Покажи мне - и я запомню,
Покажи мне - и я запомню,
Дай сделать - и я пойму.
Дай сделать - и я пойму.
(китайская притча)
(китайская притча)
Интерактивное обучение
Интерактивное обучение
Значение форм и методов обучения:
Стимулирование мотивации и интереса в
области изучаемых предметов и в
общеобразовательном плане.
Повышение уровня активности и
самостоятельности обучаемых.
Развитие навыков анализа, критичности
мышления, взаимодействия, коммуникации.
Изменение установок и социальных
ценностей.
Саморазвитие и развитие активизации с
преподавателем и учащимися.
Интерактивное обучение
Интерактивное обучение
Виды
активности
учащихся
физическая
социальная
познавательная
Общая характеристика
««Общая
характеристика
Девиз урока:
Девиз урока:
«Учитесь, читайте, размышляйте и
«Учитесь, читайте, размышляйте и
извлекайте из всего самое полезное.»
извлекайте из всего самое полезное.»
галогенов»
галогенов»
Тема урока:
Тема урока:
Н.И.Пирогов
Н.И.Пирогов
Цель урока:
Цель урока:
Углубление и расширение знаний
Углубление и расширение знаний
обучающихся о химических
обучающихся о химических
элементах и простых веществах.
элементах и простых веществах.
Задачи урока:
Задачи урока:
Дать общую сравнительную характеристику
Дать общую сравнительную характеристику
галогенов в свете трёх форм существования
галогенов в свете трёх форм существования
элементов: свободных атомов, простых
элементов: свободных атомов, простых
веществ и важнейших их соединений, в плане
веществ и важнейших их соединений, в плане
общего, особенного и единичного.
общего, особенного и единичного.
Рассмотреть физические свойства галогенов.
Рассмотреть физические свойства галогенов.
Изучить химические свойства галогенов.
Изучить химические свойства галогенов.
Развивать навыки самостоятельной учебной
Развивать навыки самостоятельной учебной
деятельности, работы в группе.
деятельности, работы в группе.
Привлечь учащихся к коллективной творческой
Привлечь учащихся к коллективной творческой
деятельности.
деятельности.
Оборудование урока
Оборудование урока
Таблица «Периодическая система
Таблица «Периодическая система
химических элементов Д.И.Менделеева»
химических элементов Д.И.Менделеева»
Схема «Галогены»
Схема «Галогены»
Кроссворд «Галогены»
Кроссворд «Галогены»
Кодоскоп
Кодоскоп
Карандаши, маркеры, бумага
Карандаши, маркеры, бумага
Хлор в колбе, бром в ампуле, кристаллы
Хлор в колбе, бром в ампуле, кристаллы
иода в ступке, алюминий, натрий
иода в ступке, алюминий, натрий
Карточки-инструкции «Характеристика
Карточки-инструкции «Характеристика
неметаллического элемента по
неметаллического элемента по
положению в ПСХЭ»
положению в ПСХЭ»
Карточки с заданиями и списками
Карточки с заданиями и списками
литературы для работы в группах
литературы для работы в группах
Информационные ресурсы
Информационные ресурсы
Аликберова Л.Ю. Занимательная химия.
1.1. Аликберова Л.Ю. Занимательная химия.
Большой энциклопедический словарь.
2.2. Большой энциклопедический словарь.
Химия.
Химия.
Врублевский А.И. и др. Химия элементов.
3.3. Врублевский А.И. и др. Химия элементов.
Габриелян О.С. и др. Настольная книга
4.4. Габриелян О.С. и др. Настольная книга
учителя.
учителя.
Габриелян О.С. Химия, 9.
5.5. Габриелян О.С. Химия, 9.
Гузей Л.С. Химия, 8.
6.6. Гузей Л.С. Химия, 8.
Малышкина В. Занимательная химия.
7.7. Малышкина В. Занимательная химия.
Популярная библиотека химических
8.8. Популярная библиотека химических
элементов.
элементов.
Рудзитис Г.Е. Химия, 8.
9.9. Рудзитис Г.Е. Химия, 8.
Трифонов Д.Н. и др. Как были открыты
10.10. Трифонов Д.Н. и др. Как были открыты
химические элементы.
химические элементы.
Оформление доски и класса
Оформление доски и класса
В центре доски: тема урока, дата
В центре доски: тема урока, дата
В левой части доски: девиз урока
В левой части доски: девиз урока
С обратной стороны доски: схема
С обратной стороны доски: схема
«Галогены»
«Галогены»
На стене: ПСХЭ Д.И.Менделеева
На стене: ПСХЭ Д.И.Менделеева
На демонстрационном столе:
На демонстрационном столе:
оборудование и реактивы для опытов
оборудование и реактивы для опытов
В кабинете парты расставлены для
В кабинете парты расставлены для
работы в группах по 5-6 учащихся
работы в группах по 5-6 учащихся
План урока
План урока
Организационная
часть
(3 мин.)
Активизация
мыслительной
деятельности
(5 мин.)
Информационный
блок
(7 мин.)
Решение
экспериментальных
заданий
по группам
(10 мин.)
Заключительный
этап
урока
(3 мин.)
Обобщение
и
составление
схемы
(7 мин.)
Информационный
блок
(10 мин.)
Активизация мыслительной
Активизация мыслительной
деятельности
деятельности
Ученик дает характеристику элементу
по положению ПСХЭ с помощью
карточки-инструкции

Информационный блок
Информационный блок
(сообщения учащихся об истории открытия галогенов)
(сообщения учащихся об истории открытия галогенов)
Йод.
«В маточном растворе щелока,
полученного из водорослей, содержится
достаточно большое количество
необычного и любопытного вещества…
Новое вещество превращается при
нагревании в пары великолепного
фиолетового цвета».
(из статьи
французского химика Куртуа)
Этим веществом был йод. В 1811 году
химиктехнолог и фармацевт Бернар
Куртуа, изучая состав золы морских
водорослей, заметил, что медный котёл, в
котором выпаривались зольные растворы,
разрушается слишком быстро. Куртуа
начал исследовать свойства таких
растворов и однажды обнаружил, что при
добавлении к ним серной кислоты H2SO4
происходит выделение фиолетового пара
неизвестного вещества:
2NaI + 2H2SO4 = I2 + SO2 +
Na2SO4 + 2H2O
Куртуа опубликовал свои наблюдения, но
природу выделенного им вещества не
установил. Только в 1813 году другой
французский химик ГейЛюссак доказал,
что вещество Куртуа сходно с хлором и
принадлежит к группе галогенов. Он дал
ему имя «йод», что в переводе с
греческого означает фиолетовый, тёмно
синий. ГейЛюссак синтезировал
впоследствии многие производные иода:
иодоводород HI, монохлорид иода ICl,
пентаоксид диода I2O5 и др.
Фтор.
Первое упоминание о соединениях этого
элемента относится к шестнадцатому
веку. В 1780 году шведский химик К.
Шееле впервые высказал
предположение, что в плавиковой
кислоте содержится новый активный
элемент. В 1809 году французские
химики Гей-Люссак и Л. Тенар получили
безводную плавиковую кислоту и
сделали вывод, что это соединение
воды с новым элементом. А. Ампер и Г.
Дэви в 1810 году назвали новый элемент
флюорином или флуором от лат. Fluere –
течь. Это название берёт своё начало от
флюорита (плавикового шпата), давно
применявшегося в металлургии для
получения легкоплавких шлаков. В 1816
году А. Ампер, ближе познакомимвшись
со свойствами плавиковой кислоты,
передал название «флуор» на «фтор» от
греч. Phthoros – разрушающий. В России
с 1830 года используется это название
элемента. Выделить фтор в свободном
виде удалось только в 1886 году
французскому химику
А. Муассану.
Хлор (Cl)
в
то
время
Хлор – химический элемент седьмой группы
периодической системы Менделеева; атомный
номер 17; относится к семейству галогенов.
Первооткрывателем химического элемента
хлора считается Шееле. Он так описал свой
опыт, выполненный в 1774 г.: «Я поместил
смесь черной магнезии с муриевой кислотой в
реторту. К горлышку которой присоединил
пузырь, лишенный воздуха, и поставил её на
песчаную баню. Пузырь наполнился газом,
окрасившим его в жёлтый цвет… Газ имел
жёлтозелёный цвет, пронзительный запах».
Черная магнезия – минерал пиролюзит MnO
(хим. Название диоксид марганца). «Муриевой
кислотой»
называли
хлороводородную кислоту HCl. Реакцию, о
которой сообщил Шееле, записывают так:
MnO + 4HCl=Cl + 2H O.
Полученный
назвал
«дефлогистированной муриевой кислотой». В
то
считали
химическим Английский
самостоятельным
химик
основатель
электрохимии
помощью
электрического тока поваренную соль на
натрий и, как он считал, газообразную «окись
мурия». Только в 1810 г. Дэви сделал
правильный вывод: этот газ – простое
вещество, образованное элементом, который
Дэви назвал хлорином.
Только в 1812 г. Французский химик Гей
Люссак дал этому газу современное название
– хлор.
раствор
Наибольшее
хлороводорода или соляная кислота. Её
применяют
в
хим.промышленности и т.п.
Гэмфри Дэви
металлургии,
разложил
значение
Шееле
время
имеет
этот
газ
газ
не
–
с
в
Экспериментальные задания
Экспериментальные задания
для групп
для групп
1 группа
2 группа
Нахождение
галогенов
в природе
Физические
свойства
галогенов
3 группа
4 группа
Химическая
активность
галогенов
Применение
галогенов
и их
биологическое
значение
Работа в группах
Работа в группах
Результаты работы групп
Результаты работы групп
Галоген
Агрегатное
состояние
Фтор
Газ
Цвет
Желтый
F2
Хлор
Газ
Желто
зеленый
Cl2
Бром
Йод
Жидкость
Кристаллы
Красно
бурый
Br2
Черно
синий
I2
1,696 г/л
3,214 г/л
3,123 г/л
4,93 г/л
219,47
187,99
100,83
33,82
7,1
58,93
113,7
184,5
Состав
молекул
Плотность
tпл , ◦С
tкип , ◦С
Химические
свойства
галогенов
с
металлами
с водородом
с водородом
с водой
Вытеснение
галогенов
из
растворов
их солей
Информационный блок
Информационный блок
Форму отчета
сами
ребята
определяют
Проведение опытов
Проведение опытов
Начало опыта
Возгонка иода
Окончание опыта
Обобщение и составление схемы
Обобщение и составление схемы
«Галогены».
«Галогены».
Состав
Тип
и класс
веществ
Тип
химической
связи
Тип
кристаллической
решетки
Химические
свойства
Физические
свойства
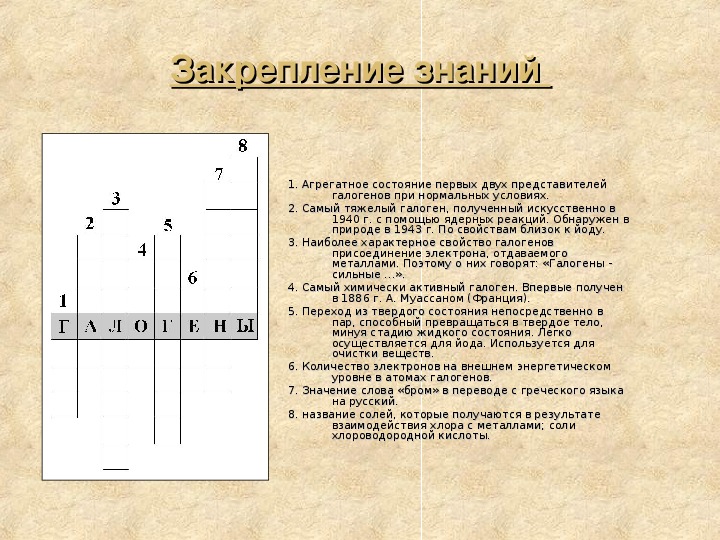
Закрепление знаний
Закрепление знаний
1. Агрегатное состояние первых двух представителей
1. Агрегатное состояние первых двух представителей
2. Самый тяжелый галоген, полученный искусственно в
2. Самый тяжелый галоген, полученный искусственно в
3. Наиболее характерное свойство галогенов
3. Наиболее характерное свойство галогенов
галогенов при нормальных условиях.
галогенов при нормальных условиях.
1940 г. с помощью ядерных реакций. Обнаружен в
1940 г. с помощью ядерных реакций. Обнаружен в
природе в 1943 г. По свойствам близок к йоду.
природе в 1943 г. По свойствам близок к йоду.
присоединение электрона, отдаваемого
присоединение электрона, отдаваемого
металлами. Поэтому о них говорят: «Галогены -
металлами. Поэтому о них говорят: «Галогены -
сильные …».
сильные …».
4. Самый химически активный галоген. Впервые получен
4. Самый химически активный галоген. Впервые получен
в 1886 г. А. Муассаном (Франция).
в 1886 г. А. Муассаном (Франция).
5. Переход из твердого состояния непосредственно в
5. Переход из твердого состояния непосредственно в
пар, способный превращаться в твердое тело,
пар, способный превращаться в твердое тело,
минуя стадию жидкого состояния. Легко
минуя стадию жидкого состояния. Легко
осуществляется для йода. Используется для
осуществляется для йода. Используется для
очистки веществ.
очистки веществ.
уровне в атомах галогенов.
уровне в атомах галогенов.
на русский.
на русский.
взаимодействия хлора с металлами; соли
взаимодействия хлора с металлами; соли
хлороводородной кислоты.
хлороводородной кислоты.
6. Количество электронов на внешнем энергетическом
6. Количество электронов на внешнем энергетическом
7. Значение слова «бром» в переводе с греческого языка
7. Значение слова «бром» в переводе с греческого языка
8. название солей, которые получаются в результате
8. название солей, которые получаются в результате
Заключительный этап урока
Заключительный этап урока
Подведение
итогов
Домашнее
задание
Объективность
оценок
Взаимо-
и
самооценка
Индивидуально-
дифференцированное
качественное
оценивание
с комментариями
Задание
для
всего класса
Дифференцированные
задания
Задания
для
любознательных
хвалился: «Нет мне равных!
ХлорХлор хвалился: «Нет мне равных!
Галоген я самый главный.
Галоген я самый главный.
Зря болтать я не люблю:
Зря болтать я не люблю:
Все на свете отбелю!»
Все на свете отбелю!»
ЙодЙод красой своей гордился,
красой своей гордился,
Твердым был, но испарился.
Твердым был, но испарился.
«Я ведь бром! Не кто-нибудь!..»
«Я ведь бром! Не кто-нибудь!..»
ФторФтор молчал и думал: «Эх!..
молчал и думал: «Эх!..
Ведь приду - окислю всех…».
Ведь приду - окислю всех…».
Фиолетовый, как ночь,
Фиолетовый, как ночь,
Далеко умчался прочь.
Далеко умчался прочь.
БромБром разлился океаном,
разлился океаном,
Хоть зловонным, но - румяным.
Хоть зловонным, но - румяным.
Бил себя он грозно в грудь:
Бил себя он грозно в грудь:
Результативность урока
Результативность урока
Применение перечисленных приемов
Применение перечисленных приемов
способствует активизации
способствует активизации
познавательной, творческой,
познавательной, творческой,
мыслительной, самостоятельной
мыслительной, самостоятельной
деятельности учащихся, тренирует
деятельности учащихся, тренирует
внимание, логику, положительно влияет
внимание, логику, положительно влияет
на эмоциональную атмосферу в классе.
на эмоциональную атмосферу в классе.
У ребят появляется интерес к предмету и
У ребят появляется интерес к предмету и
желание повысить уровень своих знаний.
желание повысить уровень своих знаний.
