
Департамент образования Администрации МО г. Салехард
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №2»
|
«РАССМОТРЕНО» протокол № ____от _____________г. заседания ШМО |
«СОГЛАСОВАНО» протокол № ____от _____________г. заседания НМС |
«УТВЕРЖДЕНО» приказ № _______ от ____________г |
|
Руководитель ШМО |
Председатель НМС___________Губогло З.И. |
Директор школы___________ Сивицкая Е.А. |
|
Зам.дир. по УВР ___________ |
Рабочая программа
Педагогический работник Жукова Татьяна Александровна, учитель химии
(ФИО, должность)
Направление программы: естественнонаучное
Название программы: Решение экспериментальных задач олимпиадного уровня по химии.
Целевая группа: обучающиеся 8-11 классов
Срок реализации: 4 дня/12 часов
Салехард
2016год
Пояснительная записка
При обучении химии и в процессе подготовки к химической олимпиаде серьезное внимание необходимо уделять эксперименту, его совершенствованию. Экспериментальный тур – неотъемлемая часть олимпиады по химии.
Как правило, он проводится в форме экспериментальных задач, в процессе решения которых учащиеся должны применить теоретические знания и практические умения; продемонстрировать творческий подход к работе, эрудицию, проявить индивидуальность. Поэтому в процессе подготовки к экспериментальному туру химической олимпиады перед учителем встает задача создания (при выполнении экспериментальной работы) учебной ситуации, обеспечивающей ученикам самостоятельное приобретение знаний в условиях творческого поиска.
Любая количественная экспериментальная работа является средством развития исследовательских способностей учащихся
Особую роль в формировании у учащихся самостоятельного творческого мышления играет проблемный эксперимент. Это эффективное средство обучения и развития учащихся в процессе их подготовки к химической олимпиаде.
Важным приемом познания в процессе обучения химии и подготовки к олимпиаде является так называемый мысленный “эксперимент”. В нем нет процесса воспроизведения на практике изучаемого явления, что характерно для реального эксперимента. Это рассуждения, точность которых зависит от правильности мышления. Мысленный “эксперимент” происходит исключительно в сфере сознания. Между мысленным и реальным экспериментом имеется общее: и тому, и другому предшествует продумывание, выдвижение гипотез, составление плана решения проблемы, задачи. Для них характерна высокая активность учащихся. Мысленный “эксперимент” начинается с построения учеником идеальной (мысленной) модели решения вопроса с учетом конкретного материала. При построении идеальной модели учащийся исходит из наколенного багажа знаний. Правильность выводов мысленного “эксперимента” проверяется, как правило, реальным экспериментом.
В процессе организации экспериментальной работы учащихся следует различать количественный опыт и количественную задачу. На решение задачи нет инструкции и учащиеся должны исходить исключительно из собственного запаса знаний, проектируя ход ее решения и прогнозируя результат. Иногда один и тот же количественный эксперимент, в зависимости от степени самостоятельности учащихся при его проведении, можно расценивать и как количественный опыт и как количественную задачу.
Цели и задачи программы:
Развивать и углублять знания учащихся о ключевых физических свойствах, о качественных реакциях неорганических и органических веществ,
формировать умения и навыки решения экспериментальных задач (задач экспериментального тура Всероссийской олимпиады школьников различного уровня);
формировать новые, более глубокие и полные знания в области анализа состава вещества;
уметь доказывать генетическую связь между отдельными представителями органических и неорганических веществ;
знать основные лабораторные и промышленные способы получения веществ;
работать с химическими реактивами и оборудованием;
уметь составлять план анализа выданных веществ или смеси.
Актуальность:
В связи с этим особое значение приобретает многовариантная форма организации ученического эксперимента, которая позволяет обеспечить его индивидуальный характер.
Опыт работы показывает, что многовариантная форма ученического эксперимента вызывает у учеников повышенный интерес. Учащиеся более тщательно выполняют индивидуальные опыты, чаще обращаются к учебным пособиям. Такая форма организации экспериментальной работы в большей степени способствует развитию познавательной деятельности и самостоятельности учащихся, активизируя их мышление. Одновременно многовариантная форма работы позволяет выявить учеников, уровень знаний которых дает возможность предложить им дополнительные более сложные опыты.
Данная программа позволяет формировать и развивать у учащихся:
Педагогические концепции, на основе которых разработана программа: достижение не только предметных, но также личностных и метапредметных результатов общего образования, формировать познавательный интерес, умение решать проблемные задачи
Эффективность реализации программы заключается во взаимодействии учителя и ученика; способности ученика к самореализации; мобильности учебной деятельности.
Вид контроля - коррекция знаний.
Планируемые результаты
Любая количественная экспериментальная работа является средством развития исследовательских способностей учащихся. В процессе ее выполнения у учащихся вырабатываются навыки измерения массы, объема, плотности веществ, температуры. Ученики осваивают приемы работы с весами, бюретками, термометрами и т.д. Изучая количественную сторону химических явлений экспериментально, ученики начинают более глубоко понимать стехиометрические законы химии и правильно использовать их в процессе количественной оценки химических явлений; осознают значение соотношений между реагирующими веществами и продуктами реакций. Таким образом, обучающиеся должны уметь: осуществлять анализ условия экспериментальной задачи, составлять алгоритм её решения, оценивать правильность суждений, последовательность действий, легко и свободно проводить эксперимент, анализировать полученные результаты, сравнивать их с теоретическими данными, составлять логический вывод о проведенной работе, о составе выданных веществ, смесей. Правильно оформлять полученные результаты.
Позиционный состав педагогической команды - учителя химии:
Перечень основных содержательных блоков
Качественный анализ неорганических веществ. Органолептические свойства, позволяющих предсказать состав вещества. Методы классификации ионов. Качественные реакции на группы катионов и анионов. Определение веществ по физическим свойствам и признакам качественных реакций на катионы и анионы. Характеристика аналитических реакций, условия и способы их выполнения. Качественный анализ выданных веществ (эксперимент).
Неорганический синтез и разделение смесей. Лабораторные и промышленные способы получения неорганических веществ. Разделение смесей и выделение компонентов в индивидуальном виде. Лабораторный синтез хлорида меди (I) (эксперимент).
Количественный анализ смесей неорганических веществ. Способы количественного анализа смесей неорганических веществ. Свойства веществ, на которых основан количественный анализ. Анализ состава сплавов на примере монеты (эксперимент).
Качественный анализ органических веществ. Особенности физических свойств органических веществ, позволяющих предсказать их состав (так называемые ключевые свойства). Качественные реакции органические вещества. Определение органических веществ по физическим свойствам и признакам качественных реакций. Характеристика реакций в органической химии, условия и способы их выполнения. Качественный анализ органических веществ (эксперимент).
Основные формы и методы: лекция, семинар, экспериментальная работа: индивидуальные (практические работы), групповые (работа в микрогруппах).
Режим занятий: ежедневно с 1000 до 1300
Перечень требований к условиям осуществления программы: наличие необходимого оборудования (приборы, реактивы), инструктивные (методические) карт, инструкция по технике безопасности, компьютер, интерактивна доска, соблюдение основных правил по технике безопасности при проведении экспериментальной работы.
Формы последующего сопровождения: систематическое решение задач олимпиадного уровня как теоретического так и практического плана.
Формы и критерии оценки обучающихся: задания теоретического характера оцениваются по пятибалльной системе; задания практического содержания – по десятибалльной системе, включая следующие элементы: правильность решения задачи; оформление решения теоретической и практической части; соблюдение техники безопасности при выполнении практической части.
Учебно-тематический план
|
№ п/п |
Наименование разделов, тем |
Количество часов |
|
|
Теория |
Практика |
||
|
1. |
Качественный анализ неорганических веществ |
1 |
2 |
|
2. |
Неорганический синтез и разделение смесей |
1 |
2 |
|
3. |
Количественный анализ смесей неорганических веществ |
1 |
2 |
|
4. |
Качественный анализ органических веществ |
1 |
2 |
Методическое обеспечение программы:
Занятие 1. Качественный анализ неорганических веществ
Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаружить катионы или анионы. Проведя их можно подтвердить однозначно их наличие. Эти реакции широко используются при проведении качественного анализа, целью которого является определение наличия веществ или ионов в растворах или смесях.
Примеры качественных реакций на катионы
|
Катион |
Воздействие и реактив |
Наблюдаемая реакция |
|
|
Пламя |
Карминово-красное окрашивание |
|
|
Пламя |
Жёлтое окрашивание |
|
|
Пламя |
Фиолетовое окрашивание |
|
|
Пламя |
Кирпично-красное окрашивание |
|
|
Пламя |
Карминово-красное окрашивание |
|
|
1. Пламя
|
1. Жёлто-зелёное окрашивание 2. Выпадение белого осадка, не растворимого в кислотах |
|
|
Вода |
Гидратированные ионы имеют голубую окраску |
|
|
|
Выпадение чёрного осадка
|
|
|
|
Выпадение белого осадка
|
|
|
Гексацианоферрат (III) калия |
Выпадение синего осадка
|
|
|
Реактив Чугаева |
Выпадение красного осадка |
Занятие 2. Неорганический синтез и разделение смесей.
В качестве исходного соединения мы взяли медный купорос (CuSO4*5H2O), который растворили в минимальном количестве воды. К стакану, содержащему концентрированный раствор сульфата меди (CuSO4), мы добавили рассчитанное количество хлорида калия(KCl), подкислили раствор 20% серной кислотой (H2SO4) и добавили рассчитанное количество сульфита натрия (Na2SO3). В растворе происходит реакция:
2CuSO4+4KCl+Na2SO3+H2O=2H[CuCl2]+2K2SO4+Na2SO4
При этом раствор становится желто-зеленого цвета, так как это окраска анионов [CuCl2]—. В следующей реакции:
H[CuCl2] = CuCl + HCl
равновесие смещается вправо при добавлении воды, так как комплекс разрушается и выпадает белый осадок CuCl. Полученный осадок нужно отфильтровать на стеклянном фильтре Шотта, следя за тем, чтобы осадок всегда находился под слоем жидкости, так как он подвержен окислению, промыть хлорид меди (I) (CuCl) ацетоном до полного удаления воды. Осадок быстро собираем в бюкс.
Итак, был получен хлорид меди (I) (CuCl), для подтверждения состава этого соединения мы проводим две качественные реакции:
1) CuCl + KOH = CuOH + KCl; 2CuOH = Cu2O + H2O
2) CuCl + 2NH3 = [Cu(NH3)2]Cl
В результате первой выпадает оранжевый осадок одновалентной меди (Cu2O), а второй – голубой раствор из-за комплексного катиона [Cu(NH3)2]+ .
Разделение гомогенных смесей методом бумажной хроматографии.
А) Разделить гомогенную смесь красного и зелёного красителя.
Оборудование: полоска фильтровальной бумаги, химический стакан, пробка на стакан, фломастеры красный и зелёный, спирт (70% водный раствор).
Методика проведения эксперимента:
Взять полоску фильтровальной бумаги, длина которой на 2-3 см больше высоты химического стакана. На середине этой полоски отметить простым карандашом точку, отступив от края 1. 5 см. В отмеченную точку нанести фломастерами пятна красителей диаметром не более 5 мм. Сначала сделать точку размером 1-2 мм красным фломастером, а затем поверх красного пятнышка нанести зелёное так, чтобы зелёное пятнышко выступало за границу красного примерно на 1 мм. Дать пятну смеси просохнуть (1-2 минуты) и затем осторожно, чтобы не повредить бумагу, обвести его простым карандашом по контуру.
В химический стакан налить спирт слоем 0,5-1 см. Поместить вертикально бумажную полоску с пятном смеси красителей в стакан и отогнуть выступающую часть полоски к наружной поверхности стакана. Пятно красителей должно быть над жидкостью на расстоянии 0,5 см. Накрыть стакан перевёрнутой пробкой. Наблюдать смачивание полоски бумаги и движение окрашенного пятна вверх с разделением его на два пятна. Для полного разделения смеси красителей потребуется около 20 минут. После того, как бумага полностью пропитается спиртом, вынуть её и дать просохнуть 5-10 минут. Отметить цвета разделения пятен. Результаты наблюдений занести в таблицу.
Б) Разделите методом хроматографии на бумаге следующие смеси: спиртовой раствор «зелёнки»; водный раствор чёрной туши для чертёжных работ.
Цель эксперимента: освоить метод бумажной хроматографии, научиться определять разницу между чистыми веществами и смесями.
Оборудование: химический стакан, полоска фильтровальной или промокательной бумаги, спиртовой раствор «зелёнки», водный раствор туши для чертёжных работ.
Методика проведения эксперимента:
Полоску из фильтровальной бумаги необходимо подвесить над сосудом с раствором «зелёнки» и чёрной туши так, чтобы бумага только касалась раствора.
Граница подъёма «зелёнки» и красящего вещества будут отставать от границы подъёма спирта и воды соответственно. Таким образом, происходит разделение двух веществ в составе однородных смесей: а) спирта и бриллиантового зелёного, б) воды и красящего вещества.
Разделение гомогенных смесей методом кристаллизации.
Вырастить кристалл или кристаллы из насыщенного раствора поваренной соли, медного купороса или алюмокалиевых квасцов.
Цель эксперимента: научиться приготавливать насыщенный раствор поваренной соли или других веществ, выращивать кристаллы различных размеров, закрепить умения и навыки при работе с веществами и химическим оборудованием.
Оборудование: стакан и литровая банка для приготовления раствора, деревянная ложка или палочка для перемешивания, соль для эксперимента – поваренная соль, медный купорос или квасцы, горячая вода, затравка – кристаллик соли, подвешенный на нитке, воронка и фильтровальная бумага.
Методика проведения эксперимента:
Приготовьте насыщенный раствор соли. Для этого сначала налейте в банку горячей воды до половины её объёма, затем порциями добавляйте соответствующую соль, постоянно перемешивая. Добавляйте соли до тех пор, пока она не перестанет растворяться. Отфильтруйте полученный раствор в стакан через воронку с фильтровальной бумагой или ватой и оставьте раствор остывать на 2-3 часа. Внесите в остывший раствор затравку – кристаллик соли, подвешенный на нити, осторожно накройте раствор крышкой и оставьте на продолжительное время (2-3 дня и более).
Результаты работы и выводы:
Изучите свой кристалл и ответьте на вопросы:
• Сколько дней вы выращивали кристалл?
• Какова его форма?
• Какого цвета кристалл?
• Прозрачный он или нет?
• Каковы размеры кристалла: высота, ширина, толщина?
• Какова масса кристалла?
Зарисуйте или сфотографируйте свой кристалл.
Опыт №10. Экстракция.
Провести на практике процесс экстракции.
Цель эксперимента: осуществить практически процесс экстракции.
А) Оборудование: семечки подсолнуха, бензин, пробирка, блюдце, ступка с пестиком.
Методика проведения эксперимента:
Измельчите в ступке несколько штук семечек подсолнуха. Измельчённые семечки переложите в пробирку, и залейте небольшим количеством бензина, хорошо встряхните несколько раз. Дадим пробирке постоять часа два (подальше от огня), не забывая время от времени её встряхивать. Слейте бензин на блюдце и выставьте на балкон. Когда бензин испарится, на дне останется немного масла, которое растворилось в бензине.
Б) Оборудование: йодная настойка, вода, бензин, пробирка.
Методика проведения эксперимента:
Бензином можно извлечь также йод из аптечной йодной настойки. Для этого налейте в пробирку воды на треть, добавьте примерно 1мл йодной настойки и к образовавшемуся буроватому раствору прилейте столько же бензина. Встряхните пробирку и оставьте её в покое. Когда смесь расслоится, то верхний бензиновый слой станет тёмно-бурым, а нижний, водный, - почти бесцветным: ведь йод в воде растворяется плохо, а в бензине – хорошо.
Что такое – экстракция? Процесс разделения смеси жидких или твёрдых веществ с помощью экстрагирования – избирательного растворения в определённых жидкостях (экстрагентах) того или иного компонента смеси. Чаще всего экстрагируют вещества из водных растворов органическими растворителями, обычно не смешивающимися с водой. Главные требования к экстрагентам: селективность (избирательность действия), нетоксичность, возможно малая летучесть, химическая инертность и низкая стоимость. Экстракцией пользуются в химической промышленности, нефтепереработке, производстве лекарств и особенно широко в цветной металлургии
Заключение.
Выводы по работе.
Занятие 3. Количественный анализ смесей неорганических веществ
Вначале проводятся внешние наблюдения: наличие или отсутствие осадка (проверяются возможные малорастворимые или гидролизующиеся соединения), цвет раствора (возможно наличие окрашенных ионов). С помощью универсальной индикаторной бумаги определяется значение рН.
При анализе смеси катионов по аммиачно-фосфатному методу рекомендуется по схеме 1 выполнить отделение катионов 4 и 5 групп от катионов 1-3 групп.
Схема 1.
Отделение катионов 1-3 аналитических групп от ионов 4 и 5 группы.
 |
+ 2н HCl
 |
+ 6н HNO3
 |
Для дальнейшего разделения и исследования раствора, содержащего катионы 1-3 аналитических групп, в отдельных порциях раствора необходимо выполнить следующие предварительные испытания:
После предварительных испытаний переходят к систематическому анализу, в ходе которого прежде всего разделяют оставшиеся катионы на аналитические группы согласно схеме 2. Затем катионы каждой аналитической группы (кроме 1 группы, которые определены в дробных обнаружениях) отделяют друг от друга и проводят качественные реакции по схемам 3-5.
Занятие 4. Качественный анализ органических веществ
При исследовании качественного состава чистых органических соединений чаще всего приходится встречаться с небольшим числом элементов. Это — углерод, водород, кислород, азот, сера, галоиды ифосфор. Открытие всех этих элементов, кроме водорода и кислорода, основано на переводе их в растворимые в воде ионизирующиеся соединения, анализируемые с применением соответствующихреакций, хорошо известных из неорганической химии. Водород же открывается в виде воды.
Большая часть органических соединений при нагревании либо сгорает, либо обугливается (обычно с запахом гари). В зависимости от вида пламени (будет ли оно бесцветным или коптящим), по выделению кислотныхпаров, а также по запаху продуктов сгорания уже при сжигании можно иногда сделать заключение о составе испытуемого вещества.
Контрольно-измерительные материалы
К занятию 1.
Задача 1
Химический элемент А – металл, довольно широко распространённый в природе, причём встречается исключительно в виде соединений. В России крупные месторождения одного из галогенидов этого металла известны на Урале в районе г. Соликамска Пермской области. Это же соединение входит в состав солей морской воды. Во всех своих соединениях элемент А одновалентен, и его можно обнаружить по характерной фиолетовой окраске пламени. Установите химический элемент А и опишите его свойства.
Задача 2
Химический элемент Х – неметалл, широко распространён в природе, причём значительные залежи самородного неметалла Х встречаются в Европе (прежде всего в Сицилии), в Америке (штаты Луизиана и Техас, США), а также в Японии.
Элемент Х образует несколько аллотропных модификаций. Кроме самородного неметалла Х встречается в природе в виде соединений с металлами, которые применяются для получения металлов и различных соединений элемента Х. Как простое вещество, Х широко используется в производстве чёрного пороха, спичек, в пиротехнике, а также в медицине для лечения кожных заболеваний.
Определите химический элемент Х и опишите его свойства.
Задача 3
Химические элементы А и В относятся к одному периоду, но к разным группам, и образуют друг с другом соединение АВ, имеющее большое значение в технике. Единственный оксид элемента А содержит 68,6% кислорода. Напишите формулы высших оксидов и гидроксидов элементов А и В, опишите их химические свойства.
К занятию 2.
Задача 1. В четырех пробирках находится по 1 г порошков меди, свинца, железа и магния. Как различить эти металлы?
Задача 2.У вас в распоряжении имеется вода и любое лабораторное оборудование. Предложите пару таких веществ, чтобы из них, используя все, что имеется в вашем распоряжении, получить как можно больше новых веществ
(но не более 20). Напишите уравнения соответствующих химических реакций. Для получения новых веществ можно использовать исходные вещества и продукты их превращений. Материал оборудования в качестве дополнительных веществ использовать нельзя.
Задача 3
В запаянных стеклянных ампулах находятся образцы следующих индивидуальных веществ (н. у.):
а) углекислого газа; б) воды;
в) хлора; г) брома;
д) йода; е) серы;
ж) серной кислоты; з) карбоната натрия;
и) свинца; к) алюминия.
Как, не вскрывая ампулы, распознать эти вещества?
(0,5 балла за каждое рационально распознанное вещество.)
Задача 4
В стеклянных бюксах без надписей находятся образцы следующих оксидов:
а) оксида алюминия; б) оксида хрома (III);
в) оксида марганца (IV); г) оксида железа (III);
д) оксида меди (I); е) оксида меди (II);
Как, не пользуясь никакими реактивами, различить эти вещества?
(0,5 балла за каждое правильно распознанное вещество.)
Задача 5
В пробирках без надписей находятся разбавленные растворы следующих веществ:
а) дихромата натрия; б) перманганата калия;
в) нитрата алюминия; г) сульфата железа (II);
д) хлорида железа (III); е) сульфата меди.
Как, не прибегая к каким-либо химическим методам, распознать растворы этих веществ?
(0,5 балла за каждое правильно распознанное вещество)
Задача 6
В химической лаборатории обнаружили смесь, состоящую из стружек железа и меди, порошка серы, кристаллов сахара и йода. Предложите один из способов разделения этой смеси, который позволил бы сохранить химически неизменными все её компоненты.
К занятию 2
Задача 1. Как химическим путем из смеси меди, железа, цинка и ртути выделить индивидуальные простые вещества в чистом виде? Приведите соответствующие уравнения химических реакций.
Решение. В состав смеси входят два достаточно активных металла, реагирующих с раствррами кислот и два малоактивных металла, растворяющихся в азотной кислоте:
![]()
Разделение соединений цинка и железа основано на амфотерности гидроксида цинка. Выделение этих металлов можно осуществить, например, следующей последовательностью реакций:
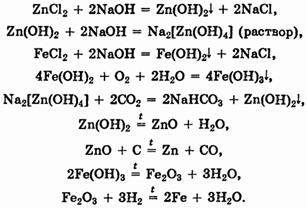
Для разделения нерастворимых в соляной кислоте меди и ртути можно перевести оба металла в раствор действием азотной кислоты, а затем воспользоваться следующими превращениями:
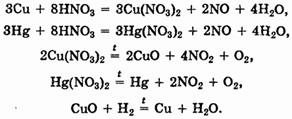
Задача 2. Напишите уравнения реакций, с помощью которых можно разделить следующие смеси с выделением их компонентов в индивидуальном виде: а) серебро и золото (МГУ, Факультет Фундаментальной Медицины, 1999); б) железо и медь (МГУ, факультет почвоведения, 1999).
Решение а) Для разделения смеси серебра и золота нужно воспользоваться таким реагентом, кото- рый переведет в раствор только один металл. Для растворения золота необходим очень сильный окислитель (например, «царская водка») или реагент, связывающий ионы золота в прочный ком- плексный ион (например, кислород в растворах цианидов щелочных металлов). Проще перевести в раствор серебро, которое в отличие от золота окисляется концентрированной азотной кислотой: Ag + 2HNO3 = AgNO3 + NO2↑ + H2O. Из полученного раствора серебро можно осадить на пластинку из более активного металла, например меди: 2AgNO3 + Cu = Cu(NO3)2 + 2Ag↓. Возможен другой путь: раствор выпарить, а остаток прокалить: 2AgNO3 = 2Ag + 2NO2↑ + O2↑. б) В электрохимическом ряду напряжений металлов медь находится после водорода, по- этому она не реагирует с разбавленной соляной кислотой1 . Подействуем на смесь металлов разбавленной соляной кислотой, медь останется без изме- нения, а железо растворится: Fe + 2HCl = FeCl2 + H2↑. Обратите внимание, в соляной кислоте (а также в других галогеноводородных кислотах) железо не окисляется до степени окисления +3, так как протон не достаточно сильный окислитель. Из полученного раствора железо можно выделить осаждением на более активном металле: Zn + FeCl2 = ZnCl2 + Fe↓. Другой вариант разделения исходной смеси базируется на пассивации железа концентри- рованными растворами серной или азотной кислот.
Задача 3. Как из смеси цинка и алюминия приготовить чистые оксиды Al2O3 и ZnO? Запи- шите уравнения соответствующих реакций
Решение Цинк и алюминий — активные металлы, но алюминий в отличие от цинка пассивируется холодными сильно концентрированными (практически безводными) растворами серной и азотной кислот. Рассмотрим вариант решения задачи, основанный на этом факте. Цинк реагирует с концентрированной азотной кислотой: Zn + 4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O. Выпарим воду из раствора и прокалим нитрат цинка: 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑. Таким образом можно получить чистый оксид цинка. Алюминий, не прореагировавший с азотной кислотой, прокалим на воздухе. В результате также образуется чистое вещество: 1 В концентрированной соляной кислоте в присутствии кислорода воздуха возможен сле- дующий процесс: 2Cu + 8HCl + O2 = 2H2[CuCl4] + 2H2O. 4Al + 3O2 = 2Al2O3.
Задача 4. Имеется смесь алюминия, кальция и серебра. Как химическим путем выделить каждый из металлов в индивидуальном виде? Решение Кальций — щелочноземельный металл, он реагирует с водой: Ca + 2H2O = Ca(OH)2 + H2↑. Отделяем алюминий и серебро, которые не растворяются в воде. К фильтрату добавляем соляную кислоту: Ca(OH)2 + 2HCl = CaCl2 + 2H2O. Раствор выпариваем, расплав хлорида кальция подвергаем электролизу: CaCl2 = Ca + Cl2↑. На смесь серебра и алюминия действуем концентрированной азотной кислотой. Алюминий пассивируется, а серебро растворяется: Ag + 2HNO3 = AgNO3 + NO2↑ + H2O. Из полученного раствора серебро можно выделить осаждением на пластинке из более ак- тивного металла, например, меди: 2AgNO3 + Cu = Cu(NO3)2 + 2Ag↓
Задача 5. Навеску тонко измельченных хрома, цинка и серы нагрели до окончания реакции. Полученный твердый продукт полностью растворился в соляной кислоте с выделением 448 мл (н. у.) газа, пропускание которого через избыток раствора нитрата серебра дало 2,48 г осадка. На- пишите уравнения проведенных реакций и вычислите максимально возможное содержание каж- дого компонента в исходной смеси в процентах по массе. (МГУ, химический факультет, 1997.)
Решение При сплавлении с металлами сера дает сульфиды: 2Cr + 3S = Cr2S3; Zn + S = ZnS. Эти вещества растворяются в соляной кислоте: Cr2S3 + 6HCl = 2CrCl3 + 3H2S↑; ZnS + 2HCl = ZnCl2 + H2S↑. Если серы недостаточно для взаимодействия с металлами, то с соляной кислотой реагиру- ют оставшиеся цинк и хром: Zn+ 2HCl = ZnCl2 + H2↑; Cr + 2HCl = CrCl2 +H2↑. Найдем суммарное количество вещества газов, выделившихся при взаимодействии остатка с соляной кислотой: n = 0,448 / 22,4 = 0,02 (моль). С раствором нитрата серебра реагирует сероводород: H2S + 2AgNO3 = Ag2S↓ + 2HNO3. n(Ag2S) = n(H2S) = 2,48 / 248 = 0,01 (моль). Следовательно, выделяется 0,01 моль сероводорода и 0,01 моль водорода. Для ответа на поставленный в задаче вопрос рассмотрим два предельных случая. Сначала предположим, что в исходной смеси практически нет хрома. Так как в ходе реак- ции выделяется 0,01 моль сероводорода, то в смеси содержится 0,01 моль цинка и 0,01 моль, или 0,32 г, серы. Для получения 0,01 моль водорода требуется еще 0,01 моль цинка, следовательно, в начальной смеси содержится 0,02 моль, или 1,3 г, цинка. Масса исходной смеси в этом случае рав- на 1,62 г. Рассчитаем ее процентный состав: w(S) = (0,32 / 1,62) ⋅ 100 % = 20 %; w(Zn) = 100 % – 20 % = 80 %. Теперь рассмотрим вариант, когда в исходной смеси практически нет цинка. В этом случае в исходной смеси также содержится 0,01 моль, или 0,32 г, серы. На взаимодействие с серой идет 0,007 моль (2/3 ⋅ 0,01) хрома. С соляной кислотой реагирует еще 0,01 моль хрома, следовательно, в исходной смеси содержится 0,017 моль, или 0,88 г хрома. Масса исходной смеси равна 1,2 г. Ее процентный состав: w(S) = (0,32 / 1,2) ⋅ 100 % = 27 %; w(Cr) = 100 % – 27 % = 73 %. Ответ: wmax(S) = 27 %; wmax(Zn) = 80 %; wmax(Cr) = 73 %.
К занятию 3.
Пример 1. Предложите схему анализа смеси сухих солей: BaCl2, CuSO4, NH4Cl, Zn(NO3)2.
Предложите схему анализа смеси сухих солей: BaCl2, CuSO4, NH4Cl, Zn(NO3)2.
Решение
Анализируемая
смесь
![]()
![]()
![]()
![]() .
.
+ Н2О
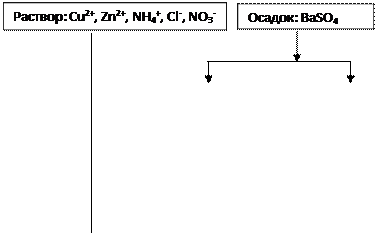 |
+ NaOH, t + Na2CO3
|
|
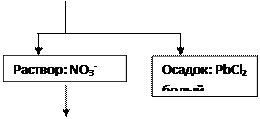
![]()
![]() + HCl + BaCl2
+ HCl + BaCl2
 |
|
|||
+ Na2SO4
Осадок: BaSO4, белый
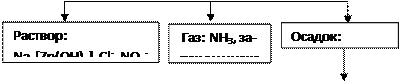
![]() + HCl
+ HCl
Раствор: Cu2+
+ СН3СООН
Раствор: Zn2+, Cl-, NO3-
![]()
+ KI
Осадок: Cu2I2 + I2 серо-коричневый
+ Na2S
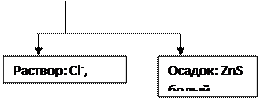
+ PbAc2
Синее окрашивание-
+ Дифениламин
Реакции:
BaCl2 + CuSO4 ¾® BaSO4¯ + CuCl2
BaSO4 + Na2CO3 ¾® BaCO3¯ + Na2SO4
Na2SO4 + BaCl2 ¾® BaSO4¯ + 2NaCl (кач. реакция)
BaCO3 + 2HCl ¾® BaCl2 + CO2 + H2O
BaCl2 + Na2SO4 ¾® BaSO4¯ + 2NaCl (кач. реакция)
NH4Cl + NaOH ―® NH3 + NaCl + H2O (кач. реакция)
CuCl2 + 2NaOH ―® Cu(OH)2¯ + 2NaCl
Cu(OH)2 + 2HCl ―® CuCl2 + 2H2O
2CuCl2 + 4KI ―® Cu2I2¯ + I2¯ + 4KCl (кач. реакция)
Zn(NO3)2 + 4NaOH ―® Na2[Zn(OH)4] + 2NaNO3
Na2[Zn(OH)4] + 4CH3COOH ―® Zn(CH3COO)2 + 2CH3COONa + 4H2O
К занятию 4.
I. В склянках без надписей находятся растворы органических веществ. Предложите радикальный способ определения этих веществ. Hапишите уравнения реакций, укажите их признаки (по 1 баллу за каждое вещество: всего 6 баллов)
1. Гексан, гексен-1, гексин-1, бензол, анилин, фенол.
2. Этанол, глицерин, фенол, глюкоза, ацетальдегид, муравьиная кислота.
3. Глюкоза, сахароза, крахмал, этиловый спирт, глицин, молочная кислота.
4. Этанол, этаналь, этандиол, диэтиламин, диэтиловый эфир, этановая кислота.
5. Муравьиная кислота, уксусная кислота, молочная кислота, карболовая кислота, салициловая кислота, вода.
II. Как с помощью только одного реактива распознать растворы следующих органических веществ? Напишите уравнения соответствующих реакций, укажите их признаки (4 балла).
1. Циклогексан, циклогексен, бензол, анилин.
2. Этин, диэтиловый эфир, этаналь, этановая кислота.
3. Ацетальдегид, этиленгликоль, Д-манноза, муравьиная кислота.
4. Пропановая кислота, пропаналь, пропанон, пропантриол-1,2,3.
5. В 10 пробирках без надписей находятся образцы следующих веществ:
1) безводного сульфата меди;
2) аммиачной селитры;
3) глицерина;
4) 96%-ной серной кислоты;
5) поваренной соли;
6) карбоната кальция;
7) едкого кали;
8) бензола;
9) этилового спирта;
10) хлороформа.
Как с помощью только одной воды распознать эти вещества?
Примеры мысленного эксперимента:
В лаборатории юные химики собрали установку, показанную на рисунке.
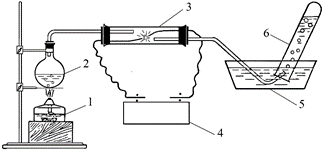
В колбу 2 налили воду и нагрели до кипения с помощью спиртовки 1. Образующиеся пары отводили в кварцевую трубку 3. В ту же трубку были вставлены два железных электрода, соединенных с индукционной катушкой 4 для получения искры. Продукты реакции отводили в пробирку 6. После того, как пробирка 6 была наполнена газом, ее поднесли к пламени и услышали характерный хлопок.
А. Какой газ (или смесь газов) получили юные химики в пробирке 6? Ответ подтвердите уравнением реакции.
Б. Почему был слышан хлопок при поджигании газа, собранного в пробирке 6?
В. Как изменится состав газа, собираемого в пробирке 6, если вместо железных электродов воспользоваться угольными?
Г. Для усиления эффекта учитель посоветовал юным химикам положить куски льда в кристаллизатор с водой 5. Объясните данный совет учителя. Об усилении какого эффекта идет речь?
Школьный синтез
В колбу Вюрца (на рисунке обозначена цифрой 1) поместили водную суспензию* оксида марганца (IV) (2) и закрыли пробкой, в которую была вставлена капельная воронка (3). В капельной воронке находился раствор вещества X. Затем открыли кран (4) и добавили раствор вещества X в колбу Вюрца, сразу началась бурная реакция, сопровождающаяся выделением бесцветного газа Y. Газ Y собрали в банку (5) и внесли в нее горящую серу. Голубое пламя горящей серы стало более ярким, горение более интенсивным.
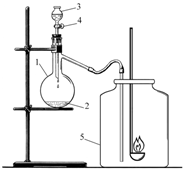
По окончании реакции банка (5) заполнилась бесцветным газом Z, имеющим резкий запах. В банку с газом Z налили раствор вещества X, встряхнули и получили серную кислоту.
А. Определите, какие вещества зашифрованы буквами X, Y и Z.
Б. Напишите уравнения следующих реакций:
– получения газа Y из вещества X,
– горения серы в Y с образованием газа Z,
– образования серной кислоты при взаимодействии X с Z.
В. Какие реакции следует провести, чтобы доказать, что в результате всех превращений образуется серная кислота?
Г. С какой целью раствор вещества X используется в домашней аптечке?
Д. Предложите еще один способ получения серной кислоты, который можно было бы осуществить в школьной лаборатории.
Список литературы:
Астафуров В.И. «Основы химического анализа», М.; «Просвещение», 1992, 159 с.
Жилин Д.М., «Лабораторный журнал» Химия. 9 класс, М.; Бином, Лабораторные знания, 2011,43с.тандартные алгоритмы решения нестандартных химических задач», М.; ФИЗМАТЛИТ, 2012г, 253 с.
Чуранов С.С., «Химические олимпиады в школе», М.; «Просвещение», 1992, 190с.
СD-диск химия, 8-11 класс, «Учитель»
Лекции «Фоксфорд» М.; МГУ, онлайн-курсы, 2015, 2016 год
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.