
АДМИНИСТРАЦИЯ ДУБРОВСКОГО РАЙОНА БРЯНСКОЙ ОБЛАСТИ
ФИЛИАЛ МУНИЦИПАЛЬНОГО БЮДЖЕТНОГО ОБЩЕОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ «СЕЩИНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА ИМЕНИ К.Я. ПОВАРОВА» АЛЕШИНСКАЯ ОСНОВНАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА /ФИЛИАЛ МБОУ «СЕЩИНСКАЯ СОШ ИМЕНИ К.Я.ПОВАРОВА» АЛЕШИНСКАЯ ООШ/
242741 Брянская область, Дубровский район, с.Алешня, ул. Школьная д.6
ОКПО 478801.03, ОГРН 1023201737492, ИНН/КПП 3210003331/321001001
Е-mail: aleschny@mail.ru. Тел./8-48332-9-52-29
|
РАССМОТРЕНО на заседании районного МО учителей химии Протокол № _1_ от 27.08.2019г. Руководитель РМО
________Чернова В.А. |
«СОГЛАСОВАНО»
Директор филиала «МБОУ Сещинская СОШ им.К.Я.Поварова» Алешинской ООШ
_______Ковальская С.П. . 29.08.2019 г. |
ПРИНЯТО
на заседании педагогического совета филиала «МБОУ Сещинская СОШ им.К.Я.Поварова» Алешинской ООШ Протокол №1 от 29.08.19 г.
|
«УТВЕРЖДАЮ»
Приказ № 26-од от 30.08.2019 г.
Директор «МБОУ Сещинская СОШ им. К.Я.Поварова»
_________Романов С.В.
|
Рабочая программа предмета
«Химия»
для 8 класса
Филиала «МБОУ Сещинская СОШ имени К.Я. Поварова»
Алешинской ООШ
на 2019-2020 учебный год.
Составитель:
учитель химии
филиала «МБОУ Сещинская СОШ имени К.Я. Поварова»
Алешинской ООШ
Алгиничева Г.С.
С.Алешня, 2019 г.
Рабочая программа предмета «химия» для 8 класса филиала «МБОУ Сещинская СОШ имени К.Я. Поварова» Алешинской ООШ на 2019-2020 учебный год разработана в соответствии с Положением о рабочей программе учебного предмета, курса в условиях реализации ФГОС (утв. приказом от 01.09.2017г. № 28_) на основании Примерной программы учебного предмета «Химия»//Примерная основная образовательная программа основного общего образования (протокол от 8 апреля 2015 г. № 1/15).- http://fgosreestr.ru/.
Рабочая программа обеспечена УМК:
1. Учебник: «Химия 8 класс» О.С.Габриелян - рекомендовано Министерством образования и науки РФ / 10-е издание, переработанное – М.: Дрофа, 2018.;
3. Авторская программа О.С.Габриеляна, соответствующая Федеральному компоненту Государственного стандарта общего образования и допущенная Министерством образования и науки Российской Федерации (О.С.Габриелян Программа курса химии для 8-9 классов общеобразовательных учреждений / О.С.Габриелян. –– М.: Дрофа, 2016г.).
4. Габриелян О. С., Остроумов И. Г. Настольная книга учителя. Химия. 8 к л.: Методическое пособие. — М.: Дрофа, 2007г
5. Химия. 8 к л.: Контрольные и проверочные работы к учебнику О. С. Габриеляна «Химия. 8 / О. С. Габриелян, П. Н. Березкин, А. А. Ушакова и др. — М.: Дрофа, 2009г.
6. Габриелян О. С., Остроумов И. Г. Изучаем химию в 8 к л.: Дидактические материалы. — М.: Блик плюс, 2009г.
7. Габриелян О. С., Яшукова А. В. Рабочая тетрадь. 8 кл. К учебнику О. С. Габриеляна «Химия. 8». — М.: Дрофа, 2010г.
8. Габриелян О. С., Воскобойникова Н. П. Химия в тестах, задачах, упражнениях. 8— 9 кл. — М.: Дрофа, 2009г.
Рабочая программа рассчитана на 70 часов (2 часа в неделю).
1. Планируемые результаты освоения учебного предмета.
Личностные результаты.
· осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки;
· постепенно выстраивать собственное целостное мировоззрение: осознавать потребность и готовность к самообразованию, в том числе и в рамках самостоятельной деятельности вне школы;
· оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья;
· оценивать экологический риск взаимоотношений человека и природы.
· формировать экологическое мышление: умение оценивать свою деятельность и поступки других людей с точки зрения сохранения окружающей среды - гаранта жизни и благополучия людей на Земле.
Метапредметными результатами изучения курса «Химия» является формирование универсальных учебных действий (УУД).
Регулятивные УУД:
· самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности;
· выдвигать версии решения проблемы, осознавать конечный результат, выбирать из предложенных и искать самостоятельно средства достижения цели;
· составлять (индивидуально или в группе) план решения проблемы;
· работая по плану, сверять свои действия с целью и, при необходимости, исправлять ошибки самостоятельно;
· в диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки.
Познавательные УУД:
· анализировать, сравнивать, классифицировать и обобщать факты и явления. Выявлять причины и следствия простых явлений.
· осуществлять сравнение, классификацию, самостоятельно выбирая основания и критерии для указанных логических операций;
· строить логическое рассуждение, включающее установление причинно-следственных связей.
· создавать схематические модели с выделением существенных характеристик объекта.
· составлять тезисы, различные виды планов (простых, сложных и т.п.).
· преобразовывать информацию из одного вида в другой (таблицу в текст и пр.).
· уметь определять возможные источники необходимых сведений, производить поиск информации, анализировать и оценивать её достоверность.
Коммуникативные УУД:
Самостоятельно организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом и т.д.).
Предметные результаты.
В результате изучения предмета на базовом уровне ученик должен знать/понимать:
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: атом, молекула, химическая связь, вещество и его агрегатные состояния, классификация веществ, химические реакции и их классификация, электролитическая диссоциация;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
важнейшие химические понятия: вещество, физическое тело, химический элемент, атом, молекула, химическая реакция, знаки первых 20 химических элементов; определение химической формулы вещества, относительной атомной и молекулярной массы; массовой доли элементов в веществах.
-важнейшие химические понятия: протоны, нейтроны, электроны, ионы, изотопы;
химическая связь, электроотрицательность, кристаллические решетки, аморфные вещества;
- особенности строения атома, состав ядра, определение понятий: протоны, нейтроны, электроны, изотопы;
- сущность и значение периодического закона химических элементов Д.И. Менделеева;
- особенности строения Периодической системы;
- образование химических связей: ионной, ковалентной неполярной, ковалентной полярной, металлической.
-важнейшие химические понятия: химическая связь, степень окисления, кристаллические решетки, аморфные вещества, формулы кислот;
- классификацию веществ;
- способы разделения смесей.
- важнейшие химические понятия: аллотропия, моль, молярная масса, молярный объем, постоянная Авогадро;
- сущность и значение Закона Авогадро;
- относительность понятий «металлические» и «неметаллические» свойства.
- важнейшие химические понятия: растворимость, растворы, гидраты и кристаллогидраты, ион, электролиты, неэлектролиты, электролитическая диссоциация, окислитель, восстановитель, окисление, восстановление, генетическая связь
- классификацию веществ по растворимости;
- основные положения ТЭД;
- механизм электролитической диссоциации; сильные и слабые электролиты;
- реакции ионного обмена; условия протекания реакций ионного обмена до конца;
- окислительно-восстановительные реакции.
важнейшие химические понятия: химическая реакция, тепловой эффект реакции, типы химических реакций, химические уравнения, реагенты, продукты реакции, коэффициент, химическая символика, уравнения химических реакций. Ряд активности металлов. Реакции разложения. Скорость химической реакции. Катализатор. Ферменты. Реакции соединения. Реакции замещения. Реакции нейтрализации. Сущность химических реакций обмена. - основные законы химии: закон сохранения массы веществ;
- классификацию химических реакций;
- признаки протекания химических реакций;
- сущность понятия «тепловой эффект химической реакции», классификацию химических реакций по поглощению или выделению энергии.
уметь:
- называть признаки и условия осуществления химических реакций;
- объяснять отличие химических явлений от физических;
- определять типы химических реакций по числу и составу исходных и полученных веществ;
- составлять уравнения химических реакций различных типов (расставлять коэффициенты в уравнениях химических реакций на основе закона сохранения массы веществ.);
- прогнозировать возможность протекания реакций между металлом и раствором кислот
- применять закон сохранения массы веществ для решении задач по уравнениям химических реакций;
- следовать правилам пользования химической посудой и лабораторным оборудованием;
- определять реагенты и продукты реакции;
- вычислять количество (массу) по количеству вещества (массе) одного из вступивших или полученных веществ;
- характеризовать химические свойства воды;
- составлять уравнения реакций по цепочке переходов;
- соблюдать технику безопасности в кабинете химии, уметь пользоваться лабораторным оборудованием, реактивами.
характеризовать химические элементы металлы и неметаллы по таблице Д.И. Менделеева;
- объяснять связь между составом, строением и свойствами веществ. – вычислять количество вещества, массу, объем по известному количеству вещества, массе или объему;
- использовать постоянную Авогадро;
- вычислять относительную плотность газов.
- составлять уравнения диссоциации кислот, щелочей, солей;
- составлять уравнения реакций ионного обмена в молекулярном и ионном виде;
-определять возможность протекания реакций ионного обмена;
- делать классификацию кислот, оснований, солей, оксидов;
- характеризовать химические свойства кислот, оснований, солей, оксидов в свете ТЭД;
- объяснять сущность реакций ионного обмена;
- распознавать опытным путем растворы кислот и щелочей;
- называть соединения изученных классов;
- определять степень окисления элемента в соединении;
- составлять уравнения окислительно-восстановительных реакций методом электронного баланса;
- составлять генетические ряды металлов и неметаллов;
- соблюдать технику безопасности в кабинете химии, уметь пользоваться лабораторным оборудованием, реактивами.
-определять степень окисления элементов в соединениях;
- называть бинарные соединения, основания, кислоты, соли;
- определять принадлежность веществ к определенному классу;
- составлять формулы бинарных соединений, оснований, кислот и солей по степени окисления;
- распознавать опытным путем растворы кислот и щелочей;
- определять тип вещества (кристаллическое или аморфное)
- производить расчеты с использованием понятий: массовая доля вещества в смеси, объемная доля компонента газовой смеси, примеси;
- соблюдать технику безопасности в кабинете химии, уметь пользоваться лабораторным оборудованием, реактивами;
- вычислять массу воды и веществ в растворах с определенной массовой долей растворенного вещества.
- отличать физические явления от химических реакций;
- называть химические элементы по их символам;
- называть признаки химических реакций;
- определять качественный и количественный состав вещества по их формулам и принадлежность к простым или сложным веществам;
- распознавать простые и сложные вещества;
- вычислять относительную молекулярную массу веществ
-вычислять массовую долю химического элемента по формуле вещества;
- характеризовать химический элемент по его положению в Периодической системе химических элементов Д.И.Менделеева;
- классифицировать вещества по составу на простые и сложные;
- соблюдать технику безопасности в кабинете химии, уметь пользоваться лабораторным оборудованием.
- объяснять физический смысл порядкового номера химического элемента, номера группы и периода;
- составлять схемы строения атомов первых 20 элементов Периодической системы Д.И.Менделеева;
- объяснять сходство и различие в строении атомов химических элементов;
-характеризовать щелочные металлы как химические элементы, обосновывать их свойства как типичных металлов;
- характеризовать галогены как химические элементы, обосновывать их свойства как типичных неметаллов;
- объяснять закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп;
- определять тип химической связи в соединениях
называть: знаки химических элементов, соединения изученных классов, типы химических реакций;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым он принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; причины многообразия веществ; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; общие свойства неорганических и органических веществ;
определять: состав веществ по их формулам; принадлежность веществ к определенному классу соединений; валентность и степень окисления элементов в соединениях;
составлять: формулы оксидов, водородных соединений неметаллов, гидроксидов, солей; схемы строения атомов первых двадцати элементов периодической системы; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: кислород, водород, углекислый газ, аммиак; растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы, ионы аммония;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю растворенного вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- экологически грамотного поведения в окружающей среде, школьной лаборатории и в быту,
- объяснения химических явлений, происходящих в природе, быту и на производстве;
- экологически грамотного поведения в окружающей среде;
- оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
- безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
- критической оценки достоверности химической информации, поступающей из разных источников.
2. Содержание учебного предмета.
Введение (7 ч)
Предмет химии. Вещества. Превращения веществ. Роль химии в жизни человека. Краткие сведения по истории развития химии. Основоположники отечественной химии. Знаки (символы) химических элементов. Таблица Д. И. Менделеева. Химические формулы. Относительная атомная и молекулярная массы. Массовая доля элемента в соединении
Демонстрации. 1. Модели (шаростержневые и Стюарта— Бриглеба) различных простых и сложных веществ. 2. Коллекция стеклянной химической посуды. 3. Коллекция материалов и изделий из них на основе алюминия. 4. Взаимодействие мрамора с кислотой и помутнение известковой воды.
Лабораторные опыты.
1. Сравнение свойств твердых кристаллических веществ и растворов.
2. Сравнение скорости испарения воды, одеколона и этилового спирта с фильтровальной бумаги.
Тема 1. Атомы химических элементов (12 ч)
Основные сведения о строении атомов. Состав атомных ядер: протоны и нейтроны. Изотопы Электроны. Строение электронных оболочек атомов элементов № 1 — 20 в таблице Д. И. Менделеева. Металлические и неметаллические свойства элементов. Изменение свойств химических элементов по группам и периодам. Ионная химическая связь. Ковалентная неполярная химическая связь. Электроотрицательность. Ковалентная полярная химическая. Металлическая химическая связь.
Демонстрации.
5.Модели атомов химических элементов.
6.Периодическая система химических элементов Д. И. Менделеева (различные формы).
Лабораторные опыты. 3. Моделирование принципа действия сканирующего микроскопа. 4. Изготовление моделей молекул бинарных соединений. 5. Изготовление модели, иллюстрирующей свойства металлической связи.
Тема 2. Простые вещества (6 ч)
Простые вещества-металлы. Простые вещества-неметаллы, их сравнение с металлами. Аллотропия. Количество вещества. Молярный объем газообразных веществ. Решение задач с использованием понятий «количество вещества», «постоянная Авогадро», «молярная масса», «молярный объем газов»
Демонстрации.
7.Получение озона.
8.Образцы белого и серого олова, белого и красного фосфора.
9.Некоторые металлы и неметаллы с количеством вещества 1 моль. Молярный объем газообразных веществ.
Лабораторные опыты.
6. Ознакомление с коллекцией металлов.
7. Ознакомление с коллекцией неметаллов.
Тема 3. Соединения химических элементов (13ч)
Степень окисления. Основы номенклатуры бинарных соединений. Оксиды. Основания. Кислоты. Соли как производные кислот и оснований. Аморфные и кристаллические вещества. Чистые вещества и смеси. Массовая и объемная доли компонентов в смеси. Расчеты, связанные с понятием «доля». Обобщение и систематизация знаний по теме «Соединения химических элементов».
Демонстрации.
1. Образцы оксидов, кислот, оснований и солей.
2. Модели кристаллических решеток хлорида натрия, алмаза, оксида углерода (IV).
3. Кислотно-щелочные индикаторы, изменение их окраски в различных средах.
4. Универсальный индикатор и изменение его окраски в различных средах.
5. Шкала pH.
Лабораторные опыты.
8. Ознакомление с коллекцией оксидов.
9. Ознакомление со свойствами аммиака.
10. Качественная реакция на углекислый газ.
11. Определение pH растворов кислоты, щелочи и воды.
12. Определение pH лимонного и яблочного соков на срезе плодов.
13. Ознакомление с коллекцией солей.
14. Ознакомление с коллекцией веществ с разным типом кристаллической решетки. Изготовление моделей кристаллических решеток.
15. Ознакомление с образцом горной породы.
Тема 4. Изменения, происходящие с веществами (12 ч)
Физические явления. Разделение смесей. Химические явления. Условия и признаки протекания химических реакций. Закон сохранения массы веществ. Химические уравнения. Расчеты по химическим уравнениям. Реакции разложения. Понятие о скорости химической реакции и катализаторах.
Реакции соединения. Цепочки переходов. Реакции замещения. Ряд активности металлов.
Реакции обмена. Правило Бертолле. Типы химических реакций на примере свойств воды. Понятие о гидролизе.
Демонстрации.
6. Примеры физических явлений: а) плавление парафина; б) возгонка иода или бензойной кислоты; в) растворение окрашенных солей; г) диффузия душистых веществ с горящей лампочки накаливания.
7. Примеры химических явлений: II) горение магния, фосфора; б) взаимодействие соляной кислоты с мрамором или мелом; в) получение гидроксида меди (II);
I) растворение полученного гидроксида в кислотах; д) взаимодействие оксида меди (II) с серной кислотой при нагревании; с) разложение перманганата калия; ж) разложение пероксида водорода с помощью диоксида марганца и каталазы картофеля или моркови;
з) взаимодействие разбавленных кислот с металлами.
Лабораторные опыты.
16. Прокаливание меди в пламени спиртовки.
17. Замещение меди в растворе хлорида меди (II) железом.
Тема 5. Практикум 1. Простейшие операции с веществом (3 ч)
1. Правила техники безопасности при работе в химическом кабинете. Приемы обращения с лабораторным оборудованием и нагревательными приборами
2. Признаки химических реакций.
3. Приготовление раствора сахара и расчет его массовой доли в растворе.
Тема 6. Растворение. Растворы. Свойства растворов электролитов (18 ч)
Растворение как физико-химический процесс. Растворимость. Типы растворов. Электролитическая диссоциация. Основные положения теории электролитической диссоциации. Ионные уравнения реакций . Кислоты: классификация и свойства в свете. Основания: классификация и свойства в свете ТЭД . Оксиды: классификация и свойства. Соли: классификация и свойства в свете ТЭД. Генетическая связь между классами неорганических веществ.
Контрольная работа №4 «Растворение. Растворы. Свойства растворов электролитов»
Классификация химических реакций. Окислительно-восстановительные реакции. Свойства изученных классов веществ в свете окислительно-восстановительных реакций.
Демонстрации.
8. Испытание веществ и их растворов на электропроводность,
9. Зависимость электропроводности уксусной кислоты от концентрации.
10. Движение окрашенных ионов в электрическом поле.
11. Взаимодействие цинка с серой, соляной кислотой, хлоридом меди (II).
12. Горение магния.
13. Взаимодействие хлорной и сероводородной воды.
Лабораторные опыты.
18. Взаимодействие растворов хлорида натрия и нитрата серебра.
19. Получение нерастворимого гидроксида и взаимодействие его с кислотами.
20. Взаимодействие кислот с основаниями.
21. Взаимодействие кислот с оксидами металлов.
22. Взаимодействие кислот с металлами.
23. Взаимодействие кислот с солями.
24. Взаимодействие щелочей,с кислотами.
25. Взаимодействие щелочей с оксидами неметаллов. Взаимодействие щелочей с солями.
27. Получение и свойства нерастворимых оснований.
28. Взаимодействие основных оксидов с кислотами.
29. Взаимодействие основных оксидов с водой.
30. Взаимодействие кислотных оксидов со щелочами.
31. Взаимодействие кислотных оксидов с водой.
32. Взаимодействие солей с кислотами.
33. Взаимодействие солей со щелочами.
34. Взаимодействие солей с солями.
35. Взаимодействие растворов солей с металлами.
Тема 7. Практикум 2. Свойства растворов электролитов (1ч)
4. Решение экспериментальных задач.
Изменения, внесенные в авторскую программу:
1.Увеличено количество часов на изучение тем:
- «Введение» 7 часов вместо 5 часов
- Тема 1 «Атомы химических элементов» до 12 часов вместо 10 часов.
- Практические работы внесены в соответствующие темы.
Часы взяты из резервного времени.
3. Тематическое планирование.
|
№ п/п |
№ урока в теме |
Дата по плану |
Дата по факту |
Тема раздела, урока
|
Часы |
Примечание |
||
|
|
|
|
|
Введение |
7 |
|
||
|
1 |
1 |
3.09.19 |
|
Предмет химии. Вещества. |
1 |
§1,2 упр.3,4 из §1 Знаки хим. элементов |
||
|
2 |
2 |
4.09.19 |
|
Превращения веществ. Роль химии в жизни человека. |
1 |
§3,4. Знаки хим. элементов. Подг. к практ. работе №1 |
||
|
3 |
3 |
10.09.19 |
|
Практическая работа №1 «Правила техники безопасности при работе в хим. кабинете. Приёмы обращения с лабораторным оборудованием» |
1 |
Знаки хим. элементов |
||
|
4 |
4 |
11.09.19 |
|
Периодическая система химических элементов Д.И.Менделеева. Знаки химических элементов. |
1 |
§5 Знаки хим. элементов. |
||
|
5 |
5 |
17.09.19 |
|
Химические формулы |
1 |
§6, упр.2,3,4 |
||
|
6 |
6 |
18.09.19 |
|
Относительная атомная и молекулярная массы, массовая доля химического элемента в веществе. |
1 |
§6, упр.6,7. |
||
|
7 |
7 |
24.09.19 |
|
Расчёты по химической формуле. |
1 |
§6, упр.8 |
||
|
|
|
|
Тема 1. Атомы химических элементов
|
12 |
|
|||
|
8 |
1 |
25.09.19 |
|
Основные сведения о строении атомов. |
1 |
§ 7,8 упр.2,4 из §7 |
||
|
9
|
2 |
1.10.19 |
|
Строение электронных оболочек атомов. |
1 |
§ 9 упр.1,2 |
||
|
10
|
3 |
2.10.19 |
|
Электронная и электронно-графическая формулы элементов. |
1 |
§ 9 упр.3,4
|
||
|
11
|
4 |
8.10.19 |
|
ПСХЭ и строение атомов. |
1 |
§9
|
||
|
12 |
5 |
9.10.19 |
|
Закономерности периодической таблицы. |
1 |
§10 (стр. 60-63) |
||
|
13 |
6 |
15.10.19 |
|
Ионы. Ионная связь. |
1 |
§10 упр.1-3 |
||
|
14 |
7 |
16.10.19 |
|
Ковалентная неполярная связь. |
1. |
§ 11 упр.3,4,5 |
||
|
15 |
8 |
22.10.19 |
|
Ковалентная полярная связь. |
1 |
§ 12 упр. 1,2 |
||
|
16 |
9 |
23.10.19 |
|
Металлическая связь. |
1 |
§ 13 упр.4 |
||
|
17
|
11 |
29.10.19 |
|
Повторение. Урок обобщения, систематизации и коррекции знаний по изученным темам. |
1 |
|
||
|
18
|
12 |
12.11.19 |
|
Контрольная работа №1 «Строение атома» |
1 |
|
||
|
|
|
|
|
Тема 2. Простые вещества. 6ч |
|
|||
|
19 |
1 |
13.11.19 |
|
Металлы. |
1 |
§ 14 |
||
|
20 |
2 |
19.11.19 |
|
Неметаллы. |
1 |
§ 15, упр.3 |
||
|
21 |
3 |
20.11.19 |
|
Количество вещества. Моль. Молярная масса. |
1 |
§ 16, упр.2,3 |
||
|
22 |
4 |
26.11.19 |
|
Молярный объём газообразных веществ. |
1 |
§ 17, упр.2 |
||
|
23 24 |
5 6
|
27.11.19 3.12.19
|
|
Решение задач с использованием понятий «количество вещества», «молярная масса», «молярный объём». |
3 |
Задачи из варианта ОГЭ |
||
|
|
|
|
Тема3. Соединения химических элементов 13ч |
|
||||
|
25 |
1 |
4.12.19 |
|
Степень окисления. |
1 |
§ 18, упр. 1,2. |
||
|
26 |
2 |
10.12.19 |
|
Бинарные соединения. Оксиды. Летучие водородные соединения. |
1 |
§ 19 упр.3 |
||
|
27 |
3 |
11.12.19 |
|
Основания. |
1 |
§ 20 упр.2,5 |
||
|
28 |
4 |
17.12.19 |
|
Кислоты. |
1 |
§ 21, упр.3 |
||
|
29 |
5 |
18.12.19 |
|
Соли. |
1 |
§ 22 упр.2,3 |
||
|
30 |
6 |
24.12.19 |
|
Повторение. Урок обобщения, систематизации и коррекции знаний по изученным темам. |
1 |
Повторить § 16-22. |
||
|
31 |
7 |
25.12.19 |
|
Контрольная работа №2 «Состав веществ» |
1 |
|
||
|
|
8 |
14.01.20 |
|
Виды кристаллических решёток. |
1 |
§ 23. |
||
|
34
|
9 |
15.01.20 |
|
Чистые вещества и смеси. Способы разделения смесей. |
1 |
§24, 26 упр.1-4 из § 24 |
||
|
35 |
10 |
21.01.20 |
|
Массовая доля компонента смеси. |
1 |
§ 25, упр.2,3. |
||
|
36 |
11 |
22.01.20 |
|
Объёмная доля компонента смеси. |
1 |
§ 25, упр.5,6. |
||
|
37 |
12 |
28.01.20 |
|
Решение задач связанных с понятием «доля». |
1 |
§ 25, упр.7 |
||
|
38
|
13 |
29.01.20 |
|
Практическая работа № 2 «Приготовление раствора сахара и определение массовой доли его в растворе» |
1 |
|
||
|
|
|
Тема 4. Изменения, происходящие с веществами 12 ч |
|
|||||
|
39 |
1 |
4.02.20 |
|
Химические реакции. Химические уравнения. |
1 |
§ 27,28 упр.2 |
||
|
40
|
2 |
5.02.20 |
|
Типы химических реакций: разложения и соединения. |
1 |
§ 30,31, упр.1,2 |
||
|
41
|
3 |
11.02.20 |
|
Типы химических реакций: замещения и обмена. |
1 |
§ 32,33 упр.4 |
||
|
42 |
4 |
12.02.20 |
|
Окислительно- восстановительные реакции. |
1 |
§ 44, упр.7 |
||
|
43
|
5 |
18.02.20 |
|
Упражнения в составлении окислительно - восстановительных реакций. |
1 |
§ 44, упр.3
|
||
|
44 |
6 |
19.02.20 |
|
Классификация химических реакций |
1 |
|
||
|
45 |
7 |
25.02.20 |
|
Расчёты по химическим уравнениям. |
1 |
§ 28, упр.1,2. |
||
|
46 |
8 |
26.02.20 |
|
Решение задач по уравнению химической реакции. |
1 |
|
||
|
47 |
9 |
3.03.20 |
|
Решение задач на примеси. |
1 |
Повторить § 28, |
||
|
48
|
10 |
4.03.20 |
|
Практическая работа № 3 «Признаки химических реакций» |
1 |
Практическая работа № 3 «Признаки химических реакций» |
||
|
49
|
11 |
10.03.20 |
|
Повторение. Урок обобщения, систематизации и коррекции знаний по изученным темам. |
1 |
Повторить § 23-28. |
||
|
50
|
12 |
11.03.20 |
|
Контрольная работа №3. «Изменения, происходящие с веществами» |
1 |
|
||
|
|
|
|
|
Тема 5. Свойства растворов электролитов |
18 |
|
||
|
51 |
1 |
17.03.20 |
|
Растворение. Растворимость. |
1 |
§ 35, упр.4,5 |
||
|
52 |
2 |
18.03.20 |
|
Электролитическая диссоциация. |
1 |
§ 36, упр.5. |
||
|
53 |
3 |
1.04.20 |
|
Теория электролитической диссоциации |
1 |
§ 37 упр.4. |
||
|
54 |
4 |
7.04.20 |
|
Диссоциация кислот, оснований, солей. |
1 |
§ 37 упр.5. |
||
|
55 |
5 |
8.04.20 |
|
Ионные уравнения реакций. |
1 |
§ 38 упр.5 |
||
|
56 |
6 |
14.04.20 |
|
Упражнения в составлении ионных уравнений реакций. |
1 |
|
||
|
57 |
7 |
15.04.20 |
|
Кислоты, их классификация и свойства. |
1 |
§ 39, упр.4,5 |
||
|
58 |
8 |
21.04.20 |
|
Основания, их классификация и свойства |
1 |
§40, упр.3 |
||
|
59 |
9 |
22.04.20 |
|
Оксиды, их классификация и свойства. |
1 |
§ 41, упр.2,3 |
||
|
60 |
10 |
28.04.20 |
|
Соли, их классификация и свойства. |
1 |
§ 42, упр.2,3. |
||
|
61 |
11 |
5.05.20
|
|
Практическая работа № 4 «Решение экспериментальных задач» |
1 |
|
||
|
62 |
12 |
6.05.20 |
|
Генетические ряды металла и неметалла. |
1 |
§ 43, упр.1. |
||
|
63
|
13 |
6.05.20 |
|
Генетическая связь между классами неорганических веществ. |
1 |
§ 43, упр.2 |
||
|
64
|
14 |
12.05.20
|
|
Решение упражнений по теме «Генетическая связь классов неорганических веществ» |
1 |
§ 43, упр.3,4 |
||
|
65 |
15 |
13.05.20 |
|
Решение задач на избыток и недостаток |
1 |
Подготовиться к контрольной работе |
||
|
66 |
16 |
19.05.20 |
|
Решение задач на примеси. |
1 |
|
||
|
67 |
17 |
20.05.20 |
|
Итоговая контрольная работа |
1 |
|
||
|
68 |
18 |
26.05.20 |
|
Анализ контрольной работы. |
1 |
|
||
|
69
|
1
|
27.05.20 |
|
Повторение. Обобщение, систематизация и коррекция знаний по изученным темам |
2 |
|
||
|
70 |
2 |
27.05.20 |
|
Обобщение, систематизация и коррекция знаний по изученным темам |
1 |
|
||
Приложение.
Контрольная работа №1 по теме: «Периодическая система, строение атома». (8 кл)
1.Атомный радиус с увеличением заряда ядра в главной подгруппе:
1) увеличивается, 2) уменьшается, 3) не изменяется.
2.Атом элемента, наиболее легко отдающий электроны:
1) натрий, 2) магний, 3) алюминий, 4) кремний.
3.Распределение электронов в атоме фтора:
1) 2е,8е; 2) 2е,8е,3е; 3) 2е,5е; 4) 2е,7е.
4.Какой элемент проявляет наиболее ярко выраженные неметаллические свойства:
1) кислород, 2) сера, 3)селен, 4) теллур.
5.Сколько энергетических уровней у атома скандия:
1) 1; 2) 2; 3) 3; 4) 4.
6.Элементарная частица ядра атома, определяющая его заряд:
1) нейтрон, 2) протон, 3) электрон.
7. Какой элемент имеет строение внешнего энергетического уровня, выраженного электронной формулой …3s23p3:
1) бор, 2) хлор, 3) магний, 4) фосфор.
8.Чем различаются ядра атомов изотопов:
1) числом протонов и числом нейтронов,
2) числом протонов,
3) числом нейтронов.
9.Максимальное число электронов на р-подуровне:
1) 2; 2) 6; 3) 10; 4) 14.
10. 4-й период периодической системы содержит (элементов):
1) 2; 2) 8; 3) 18; 4) 32.
11.Как определить, используя периодическую систему химических элементов, количество энергетических уровней атома элемента:
1) по порядковому номеру элемента;
2) по номеру группы;
3) по номеру ряда;
4) по номеру периода.
12.Электроотрицательность в ряду Na, Mg, Al, Si, P, S, Cl:
1) уменьшается, 2) увеличивается, 3) не изменяется.
13. Формула соединения с ковалентной полярной связью:
1) Н2; 2) NН3; 3) LiCl
14. Формула вещества, имеющего ионную кристаллическую решетку в твердом состоянии:
1) H2O, 2) J2, 3) C (алмаз), 4) NaCl .
15. Какой тип связи в молекуле СН4:
1) ионная; 2) ковалентная неполярная;
3)металлическая; 4) ковалентная полярная.
Вариант - 1
1.Как определить, используя периодическую систему химических элементов, число энергетических уровней атома элемента:
1) по порядковому номеру элемента;
2) по номеру группы;
3) по номеру ряда;
4) по номеру периода.
2.Электроотрицательность в ряду Na, Mg, Al, Si, P, S, Cl:
1) уменьшается, 2) увеличивается, 3) не изменяется.
3. Формула соединения с ковалентной полярной связью:
1) Н2; 2) NН3; 3) LiCl
4. Какой тип связи в молекуле СН4:
1) ионная; 2) ковалентная неполярная;
3)металлическая; 4) ковалентная полярная.
Вариант - 2
1.Как определить, используя периодическую систему химических элементов, число электронов на внешнем энергетическом уровне атома элемента:
1) по порядковому номеру элемента;
2) по номеру группы;
3) по номеру ряда;
4) по номеру периода.
2.Радиус атомов элементов в ряду Na, Mg, Al, Si, P, S, Cl:
1) уменьшается, 2) увеличивается, 3) не изменяется.
3. Формула соединения с ковалентной неполярной связью:
1) Н2; 2) NН3; 3) LiCl
4. Какой тип связи в молекуле СaО:
1) ионная; 2) ковалентная неполярная;
3)металлическая; 4) ковалентная полярная.
Вариант - 3
1.Как определить, используя периодическую систему химических элементов, число электронов в атоме элемента:
1) по порядковому номеру элемента;
2) по номеру группы;
3) по номеру ряда;
4) по номеру периода.
2.Неметаллические свойства в ряду Na, Mg, Al, Si, P, S, Cl:
1) уменьшается, 2) увеличивается, 3) не изменяется.
3. Формула соединения с ионной связью:
1) Н2; 2) NН3; 3) LiCl
4. Какой тип связи в молекуле Са:
1) ионная; 2) ковалентная неполярная;
3)металлическая; 4) ковалентная полярная.
Вариант - 1
1.Атомный радиус с увеличением заряда ядра в главной подгруппе:
1) увеличивается, 2) уменьшается, 3) не изменяется.
2.Атом элемента, наиболее легко отдающий электроны:
1) натрий, 2) магний, 3) алюминий, 4) кремний.
3.Распределение электронов в атоме фтора:
1) 2е,8е; 2) 2е,8е,3е; 3) 2е,5е; 4) 2е,7е.
4.Какой элемент проявляет наиболее ярко выраженные неметаллические свойства:
1) кислород, 2) сера, 3)селен, 4) теллур.
5.Сколько энергетических уровней в атоме скандия:
1) 1; 2) 2; 3) 3; 4) 4.
6.Элементарная частица ядра атома, определяющая его заряд:
1) нейтрон, 2) протон, 3) электрон.
7. Какой элемент имеет строение внешнего энергетического уровня, выраженного электронной формулой …3s23p3:
1) бор, 2) хлор, 3) магний, 4) фосфор.
Вариант - 2
1.металлические свойства с увеличением заряда ядра в главной подгруппе:
1) увеличиваются, 2) уменьшаются, 3) не изменяются.
2.Атом элемента, наиболее легко принимающий электроны:
1) натрий, 2) магний, 3) алюминий, 4) кремний.
3.Распределение электронов в атоме алюминия:
1) 2е,8е; 2) 2е,8е,3е; 3) 2е,5е; 4) 2е,7е.
4.Какой элемент проявляет наиболее ярко выраженные металлические свойства:
1) кислород, 2) сера, 3)селен, 4) теллур.
5.Сколько энергетических уровней в атоме кислорода:
1) 1; 2) 2; 3) 3; 4) 4.
6.Элементарная частица атома, не имеющая заряда:
1) нейтрон, 2) протон, 3) электрон.
7. Какой элемент имеет строение внешнего энергетического уровня, выраженного электронной формулой …3s2:
1) бор, 2) хлор, 3) магний, 4) фосфор.
Вариант - 3
1.Электроотрицательность с увеличением заряда ядра в главной подгруппе:
1) увеличивается, 2) уменьшается, 3) не изменяется.
2.Атом элемента, наиболее легко отдающий электроны:
1) бериллий, 2) магний, 3) кальций, 4) барий.
3.Распределение электронов в атоме азота:
1) 2е,8е; 2) 2е,8е,3е; 3) 2е,5е; 4) 2е,7е.
4.Какой элемент проявляет наиболее ярко выраженные неметаллические свойства:
1) фосфор, 2) сера, 3)кремний, 4) хлор.
5.Сколько энергетических уровней в атоме хлора :
1) 1; 2) 2; 3) 3; 4) 4.
6.Элементарная отрицательно заряженная частица атома:
1) нейтрон, 2) протон, 3) электрон.
7. Какой элемент имеет строение внешнего энергетического уровня, выраженного электронной формулой …3s23p5:
1) бор, 2) хлор, 3) магний, 4) фосфор.
Контрольная работа №2 «Состав веществ»
Задание – 1
Дать определения:
1В – оксиды, аллотропия, ионы.
2В – основания, моль, степень окисления.
3В – кислота, щелочи, металлы.
Задание – 2
Даны формулы веществ:
KOH, SO2, Mg(NO3)2, HCl, P2O5, FeBr2, Zn(OH)2, H2SiO3, CuO, NH3, Al(OH)3, C2H2, BaCl2, H3PO4.
Выпишите формулы:
1В – кислот, дайте им названия и рассчитайте массовую долю кремния в кремневой кислоте.
2В - оксидов, дайте им названия и рассчитайте массовую долю кислорода в оксиде фосфора(5).
3В – оснований, дайте им названия и рассчитайте массовую долю калия в гидроксиде калия.
Задание – 3
Напиши формулы веществ:
1В – гидроксид бария, азотная кислота, оксид железа (3)
2В – серная кислота, оксид углерода (4), гидроксид лития.
3В – оксид водорода, гидроксид натрия, угольная кислота.
Задание – 4
Рассчитай степени окисления элементов в веществах:
1В – Na2O, HBr, MgCl2, CO, Al2S3
2В – HCl, CaO, SO3, K3P, Zn3N2
3В – BaS, HI, FeCl2, Cu2O, Cr2O3
Задание – 5
Рассчитай:
1В – количество вещества, число структурных частиц, массу, которые соответствуют 2,24 л оксида азота (4).
2В – число структурных частиц, объём, количество вещества, которые соответствуют 15 г оксида азота (2)
3В – объём, количество вещества, массу, которые соответствуют 3,01∙1023молекулам оксида азота (3)∙∙


 Дополнительно:
выберите из предложенных моделей отдельно простые и сложные вещества.
Дополнительно:
выберите из предложенных моделей отдельно простые и сложные вещества.
 |
 |
 |
|||||
 |
|||||||




![]()
![]()

![]() Водород
сера озон
Водород
сера озон
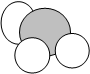



гелий угарный газ кислород метан
Контрольная работа № 3 по теме: « Изменения, происходящие с веществами».
1. Дать определения:
1В: реакция замещения, окислитель, уравнение реакции;
2В: реакция разложения, окисление, экзотермическая реакция;
ЗВ: реакция обмена, восстановитель, эндотермическая реакция;
4В: реакция соединения, восстановление, окислительно-восстановительные реакции.
2. Уравняй уравнение, укажи тип химической реакции,
дай названия всем
веществам:
1В; а) Н2+02 = Н20 2В: а) Fe(0H)3 = Fe2O3 + H20
б) КОН + Н3Р04 = К3Р04 + Н20 б) СаО + Н20 = Са(ОН)2
в) СаСОз = СаО + С02 в ) А1 + НС1 = А1С13 + Н2
г) FeO + С = Fe + С02 г) Mg(N03)2 + NaOH = Mg(OH)2 + NaN03
ЗВ: a) MgO + P205 = Mg3(P04)2 4B: a) Zn + HC1 = ZnCl2 + H2
б) BaO + HN03 = Ba(N03)2 + H20 б) FeCl3 + Fe = FeCl2
в) Ca(0H)2
= CaO +H20
в) Cu(OH)2 + H2S04 = CuS04 + H20
r) H2S + 02 = H2
+ S02
r) Al(OH)3 = A1203 + H20
З.Уравнять уравнение, указать окислитель и восстановитель:
1В:С0 + 02 =С02
2B:CuO + H2 = Cu + H20
3B:N2 +02 = NO
4B:Na + H20 = NaOH + H2
4.Реши задачу:
1B: Рассчитайте массу щёлочи и воды, которые необходимы для приготовления 8% раствора массой 200г.
2В: При выпаривании раствора соли массой 80г. образовался сухой остаток массой 8г. Определите массовую долю (в %) соли в исходном растворе.
ЗВ: Определите массовую долю (в %) кислоты в растворе, если для его приготовления взяли 80г. воды и 20г. кислоты.
4В: Определите массу соли, которая потребуется для приготовления 5%-ного раствора массой 480 г.
5. Реши задачу:
1В: Какое количество водорода образуется при разложении 54 г воды?
2В: Какая масса углерода необходима для получения метана ( СН4) в реакции с 2,24 л водорода?
3В: Какая масса воды образуется при взаимодействии 6 г водорода с кислородом?
4В: Рассчитайте массу оксида
кальция, образующуюся при взаимодействии 3 моль кальция с кислородом.
Контрольная работа №4 по теме «Электролитическая диссоциация». 8 класс
Вариант №1
1.Сильными электролитами являются:
А) KOH б)HCl
В) Mg(OH)2 г) SO3
2.Слабым электролитом является кислота:
А) серная б) азотная
В) сероводородная г) соляная.
3.Сокращённому ионному уравнению
Cu2+ + Zn = Zn2+ + Cu
Соответствует взаимодействие
А) меди с раствором хлорида цинка,
Б) гидроксида меди (2) с цинком,
В) раствора хлорида меди (2) с цинком,
Г) оксида меди (1) с цинком.
Напишите уравнение соответствующей реакции.
4. Сумма коэффициентов в сокращенном ионном уравнении реакции
HNO3 + NaOH = NaNO3 + H2O
Равна: а) 4 б) 3 в)8 г) 6
5. Молекулярному уравнению реакции
FeCl3 + Ba(OH)2 = BaCl2 + Fe(OH)3
Соответствует ионное уравнение:
А) 2 Cl- + Ba2+ = BaCl2
Б) Fe2+ + 2OH- = Fe(OH)2
В) FeCl3 + Ba2+ = Fe3+ + BaCl2
Г) Fe3+ + 3OH- = Fe(OH)3
6.Нерастворимая соль образуется при сливании водных растворов:
А) гидроксида калия и хлорида алюминия,
Б) сульфата меди (2) и сульфида калия,
В) серной кислоты и гидроксида лития,
Г) карбоната натрия и соляной кислоты.
Напишите уравнение соответствующей реакции.
7.При нагревании гидроксида меди (2) образуются:
А) Cu, H2O; б) CuO, H2O;
В) CuO, H2; г) Cu, H2, O2.
8.В цепочке превращений CaCO3 → X → Ca(OH)2 веществом Х является
А) CaCl2 б) Ca3(PO4)2
В) CaO г) CaSO4
9. Масса соли, которую необходимо добавить к 250 г 5%-ного раствора, для того, чтобы получить 12%-ный раствор, равна -------------- г. (Запишите число с точностью до целых).
10.Масса газа, выделившегося при обработке избытком соляной кислоты 3 моль сульфида натрия, равна ---- г. (Запишите число с точностью до целых).
Контрольная работа №4 по теме «Электролитическая диссоциация» 8 класс
Задание №1 Дать определения
Вариант – 1 электролит, ион, кислота.
Вариант – 2 электролитическая диссоциация, катион, основание.
Вариант – 3 анион, средняя соль, степень электролитической диссоциации.
Вариант – 4 кислая соль, неэлектролит, ион.
Задание №2 Составьте уравнения реакций в молекулярной и ионных формах, используя формулы указанных веществ:
Вариант - 1 Нитрат цинка + гидроксид калия → нитрат калия + гидроксид цинка
Вариант - 2 Сульфат меди (2) + гидроксид натрия → гидроксид меди (2) + сульфат натрия
Вариант - 3 Хлорид алюминия + гидроксид калия → хлорид калия + гидроксид алюминия
Вариант - 4 Фосфат калия + нитрат серебра → фосфат серебра + нитрат калия
Задание №3 С какими из перечисленных веществ вступает в реакцию раствор
Вариант – 1 азотной кислоты: CaO, Au, SO2, Al(OH)3, K2CO3.
Вариант – 2 гидроксида натрия: SO3, Ca, H3PO4, AL(NO3)3.
Вариант – 3 хлорида : AgNO3,S, KOH, HCl, Zn.
Вариант – 4 оксид углерода (4) : NaOH, P, H2O, HCl, CaO.
Составьте уравнения возможных реакций.
Задание №4 Составьте молекулярное уравнение реакции, соответствующее сокращенному ионному:
Вариант – 1 SO32- + 2H+ = H2O + SO2
Вариант – 2 Mg2+ + S2- = MgS
Вариант – 3 Fe3+ + 3OH- = Fe(OH)3
Вариант – 4 3Zn2+ + 2PO43- = Zn3(PO4)2
Задание №5 Реши задачу:
Вариант – 1
(1. Какая масса воды образуется при взаимодействии 6 г водорода с кислородом?)
2. Какой объём водород (н.у.) выделится при взаимодействии соляной кислоты с 337,5 г технического алюминия, содержащего 80% чистого алюминия?
Вариант – 2
(1. Какая масса углерода необходима для получения метана ( СН4) в реакции с 10 г водорода?)
2. В реакцию с соляной кислотой вступило 5,9 г железа , содержащего 5% примесей. Какой объём водорода (н.у.) выделился при этом?
Вариант – 3
(1. Сколько граммов водорода образуется при разложении 54 г воды?)
2. Какой объём водорода ( н.у.) необходим для получения железа при взаимодействии с 25,52 г оксида железа (2), содержащего 30% примесей?
Вариант - 4
(1. Сколько граммов серы необходимо для получения 128 г оксида серы (4)?)
2. Какой объём водорода (н.у.) образуется при взаимодействии с соляной кислотой 13,65 г технического цинка, содержащего 5% примесей?
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.