
Скорость химических реакций
 Если энергия активации мала, то скорость
реакции будет высокой, но если энергия активации велика, то реакции
будут протекать медленно.
Если энергия активации мала, то скорость
реакции будет высокой, но если энергия активации велика, то реакции
будут протекать медленно.
Известно, что некоторые химические реакции протекают очень быстро. Например, если добавить раствор нитрата серебра к раствору хлорида натрия, то практически мгновенно выпадает белый творожистый осадок, или если к раствору карбоната калия добавить соляной кислоты, то сразу же вы увидим выделение пузырьков газа, с огромной скоростью протекают реакции, сопровождающиеся взрывом.
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой пленкой. Такие реакции, как рост сталактитов и сталагмитов в пещерах, разрушение статуй под действием кислотных дождей, протекают очень медленно.

Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой – миллионы лет. Почему так? Термодинамика ответить на этот вопрос бессильна: в этой теории не учитывается время скорости химических реакций, которую изучает химическая кинетика. Более того, химическая кинетика дает ключ к управлению реакций.
Что же такое скорость?
Например, Бальзак прочитывал 200 страниц за полчаса
Наполеон читал со скоростью две тысячи слов в минуту, т.е. 12.000 знаков.
Археолог Р. Шлиман путём тренировок добился того, что очередной иностранный язык выучивал за 6-8 недель. Ураган движется со скоростью 125 миль в час.




Как определить скорость, а в частности скорость химической реакции? Количественной характеристикой быстроты протекания химической реакции является скорость химической реакции, которую обозначают латинской буквой υ.
Скорость химической реакции определяется изменением концентрации исходных веществ или продуктов реакции в единицу времени.

От чего же зависит сама скорость химической реакции?
· Первый фактор. Скорость химической реакции зависит от природы реагирующих веществ.
Сейчас мы это докажем. Нальём в две пробирки 1-2 мл соляной кислоты, в одну поместим гранулу цинка, а во вторую кусочек железа такого же размера. Понаблюдаем, что же происходит? В первой пробирке реакция протекает быстрее, чем во второй, это видно по интенсивности выделения водорода. Почему? Да потому, что цинк более активный металл, чем железо и реакция буде протекать быстрее с цинком, чем с железом. То есть природа металла оказывает влияние на скорость этой реакции.
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
А теперь поместим в две пробирки по грануле цинка и прильём в первую пробирку соляной кислоты, во вторую – уксусной кислоты, но эти кислоты будут одинаковой концентрации. Проследим за изменениями. В первой пробирке скорость реакции гораздо выше, чем во второй. Значит, природа кислоты тоже оказывает влияние на скорость реакции. Т.к. интенсивность выделения водорода в первой реакции больше, значит, и кислота там более сильная, чем во второй пробирке.
Zn + 2HCl = ZnCl2 + H2↑
Zn + 2CH3COOH = (CH3COO)2Zn + H2↑
· Второй фактор. Скорость реакции зависит и от концентрации реагирующих веществ.
 Нальём в три пробирки разное количество соляной
кислоты: в первую – 3мл, во втору – 2 мл, а в третью – 1 мл. Затем во
вторую пробирку добавим 1 мл воды, а в третью – 2 мл. Получается, что объём
жидкости в трёх пробирках у нас одинаковый. А концентрация кислоты?
Подумайте? Затем добавим в каждую пробирку по грануле цинка и
посмотрим, что будет происходить. Интенсивнее всего водород выделяется
в первой пробирке, во второй – менее интенсивно, а в третьей – меньше
всего наблюдается выделение водорода. Получается, что концентрация
кислоты в первой пробирке была больше всего, а меньше всего в
третьей. Следовательно, чем выше концентрация веществ, тем и больше
скорость взаимодействия между ними.
Нальём в три пробирки разное количество соляной
кислоты: в первую – 3мл, во втору – 2 мл, а в третью – 1 мл. Затем во
вторую пробирку добавим 1 мл воды, а в третью – 2 мл. Получается, что объём
жидкости в трёх пробирках у нас одинаковый. А концентрация кислоты?
Подумайте? Затем добавим в каждую пробирку по грануле цинка и
посмотрим, что будет происходить. Интенсивнее всего водород выделяется
в первой пробирке, во второй – менее интенсивно, а в третьей – меньше
всего наблюдается выделение водорода. Получается, что концентрация
кислоты в первой пробирке была больше всего, а меньше всего в
третьей. Следовательно, чем выше концентрация веществ, тем и больше
скорость взаимодействия между ними.
· Третьим фактором, влияющим на скорость реакции, является площадь соприкосновения реагирующих веществ.
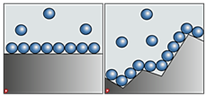 Нальём в две пробирке равное количество соляной
кислоты, в первую пробирку поместим кусочек мрамора, а во
вторую – мраморную крошку. И что же наблюдаем? Во второй пробирке
реакция прошла гораздо быстрее, чем в первой. Ведь площадь
соприкосновения во второй пробирке гораздо больше, чем в первой.
Поэтому, чем больше площадь соприкосновения реагирующих веществ, тем
выше скорость реакции.
Нальём в две пробирке равное количество соляной
кислоты, в первую пробирку поместим кусочек мрамора, а во
вторую – мраморную крошку. И что же наблюдаем? Во второй пробирке
реакция прошла гораздо быстрее, чем в первой. Ведь площадь
соприкосновения во второй пробирке гораздо больше, чем в первой.
Поэтому, чем больше площадь соприкосновения реагирующих веществ, тем
выше скорость реакции.
Из повседневного опыта вы знаете, что быстрее сгорит 1 кг стружек, чем 1 кг цельной древесины. Когда вы разжигаете костёр, то наверняка, подкладываете под дрова мелкие щепки, а под них скомканную бумагу. При тушении пожаров, наоборот, уменьшают площадь соприкосновения горящих предметов с воздухом.

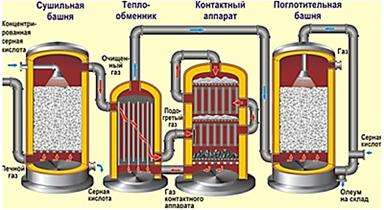 А на производстве используют так называемый кипящий
слой, т.е. измельчают твёрдое вещество до состояния пыли, затем через него
снизу пропускают второе вещество, чаще газообразное, когда оно проходит через
мелкораздробленный слой, то создает эффект кипения. Этот метод
используют при производстве серной кислоты и нефтепродуктов.
А на производстве используют так называемый кипящий
слой, т.е. измельчают твёрдое вещество до состояния пыли, затем через него
снизу пропускают второе вещество, чаще газообразное, когда оно проходит через
мелкораздробленный слой, то создает эффект кипения. Этот метод
используют при производстве серной кислоты и нефтепродуктов.

Можно самим смоделировать «кипящий слой». Для этого на кольцо лабораторного штатива закрепим кусочек сетчатой ткани. Насыплем на неё 1-2 столовые ложки манной крупы. А снизу будем продувать воздух с помощью резиновой груши. У нас вами тоже получается эффект кипения.
·
 Четвёртым фактором, который влияет на скорость химической реакции, является температура.
Четвёртым фактором, который влияет на скорость химической реакции, является температура.
В химическое взаимодействие вступают только активные частиц, а при повышении температуры количество этих активных частиц значительно увеличивается, т.к. нагревание сообщает частицам необходимую энергию активации. Поэтому, естественно, что чем выше температура, тем больше скорость реакции.
Я.Х. Вант-Гофф сформулировал правило: при повышении температуры на каждые 10 0С скорость химической реакции возрастает в 2-4 раза. Эта величина называется температурным коэффициентом (γ).
 Поэтому на производстве используются высокотемпературные
химические процессы: при выплавке чугуна и стали, варке стекла и мыла,
производстве бумаги и нефтепродуктов и др.
Поэтому на производстве используются высокотемпературные
химические процессы: при выплавке чугуна и стали, варке стекла и мыла,
производстве бумаги и нефтепродуктов и др.


 Попробуем это доказать с помощью лабораторного опыта.
Если, насыпать в две пробирки одинаковое количество чёрного порошка
оксида меди (II), и прилить в каждую 3-4 мл раствора серной
кислоты. Затем первую пробирку поставить в стакан с горячей водой, а
вторую нагреть на пламени спиртовки, то очевидно, что реакция во второй
пробирке пойдёт гораздо быстрее, чем в первой, ведь температура выше во
втором случае. Таким образом, мы доказали с вами, что, чем
выше температура, тем больше скорость реакции.
Попробуем это доказать с помощью лабораторного опыта.
Если, насыпать в две пробирки одинаковое количество чёрного порошка
оксида меди (II), и прилить в каждую 3-4 мл раствора серной
кислоты. Затем первую пробирку поставить в стакан с горячей водой, а
вторую нагреть на пламени спиртовки, то очевидно, что реакция во второй
пробирке пойдёт гораздо быстрее, чем в первой, ведь температура выше во
втором случае. Таким образом, мы доказали с вами, что, чем
выше температура, тем больше скорость реакции.
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
· Пятым фактором, от которого зависит скорость реакции, являются катализаторы.
Скорость химических реакций может зависеть от присутствия некоторых веществ.
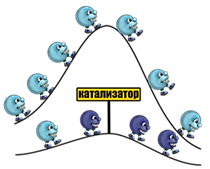 Вещества, которые ускоряют химическую реакцию, но сами
в ней не расходуются, называют катализаторами.
Вещества, которые ускоряют химическую реакцию, но сами
в ней не расходуются, называют катализаторами.
Если перемешать порошок алюминия с порошком йода, то признаков реакции наблюдаться не будет. Реакция не идет. Но стоит добавить катализатор – капельку воды – как начинается бурная реакция. Вода, в данном случае, участвует в реакции, ускоряя превращение веществ, но сама в ней не расходуется.
Следует помнить, что один катализатор может ускорять одну реакцию, но не ускорять другую. Также существуют реакции, которые протекают быстро без катализатора. Такие реакции называют некаталитическими. Например, это реакции ионного обмена в растворах.
· Шестой фактор. Кроме этого, такой фактор, как изменение давления влияет на скорость только тех реакций, в которых участвуют газообразные вещества.
При увеличении давления уменьшается объём газов, что ведёт к увеличению концентрации газов, а следовательно и увеличению скорости реакции.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.