
Класс 9 А Дата 19.12.20г.
Тема урока «Соли аммония»
Цель урока: расширение базы химических понятий, за счет включения в нее новых элементов: названия солей аммония, качественные реакции на ион аммония.
Образовательная: рассмотреть способы получения, физические и химические свойства солей аммония. Познакомить учащихся с качественной реакцией на ион аммония. Дать представление о применении солей аммония. Совершенствовать умения составлять уравнения химических реакций
Развивающая: развивать творческий интерес к предмету, навыки самостоятельной работы с учебником. Совершенствовать навыки химического эксперимента, умение обобщать и делать выводы.
Воспитательная: выработать у учащихся аккуратность при работе с химическими реактивами. Воспитывать умение работать в коллективе, бережное отношение к окружающей среде.
Планируемые результаты:
1. Предметный результат
2. Метапредметный результат
3. Личностный результат
Оборудование и реактивы: мультимедиа, штатив с пробирками, химические стаканы, стеклянная палочка; соляная кислота, водный раствор аммиака, раствор гидроксида натрия, хлорид аммония, сульфат аммония, серная кислота, нитрат серебра, хлорид бария.
Ход урока
1.Организационный момент
Проверка готовности к уроку.
2. Мотивация.
Эпиграфом сегодняшнего урока я предлагаю взять известные высказывания О.М. Нефедова и И.В. Гете:
«Можно не любить химию, но прожить без неё сегодня и завтра нельзя» (О.М. Нефёдов)
«Просто знать – еще не все, знания нужно уметь использовать» (И.В. Гете)
3. Актуализация темы урока.
На прошлом занятии мы рассматривали соединения азота со степенью окисления (-3) на примере аммиака. На данном уроке мы продолжим рассматривать соединения азота с этой степенью. Но прежде повторим пройденный материал.
Фронтальный опрос:
ИГРА “Третий лишний”.
|
BaCL2 |
HCL. |
CuCL2 |
|
H2SO4. |
NaNO3 |
NaOH |
|
NH4CL |
H2CO3, |
(NH4)2S |
Какое необычное вещество вам встретилось?
В молекуле этой соли вместо ионов металлов находится:
1) Сложный катион (NH4)+.
2) Как называется этот катион ? (Аммоний.)
3) Как могут называться эти соли? (Соли аммония.)
4) Сформулируйте тему сегодняшнего урока. (Соли аммония)
Давайте сформулируем определение солей, солей аммония. ( работа с учеб, §26 )
4. Изучение нового материала.
Соли аммония - это соединения, состоящие из катиона аммония и анионов кислотных остатков.
1. Строение солей аммония. Рассказ по слайд. (Слайд) Чтобы рассмотреть свойства солей аммония вспомним, как образуется ион аммония.
Вывод (дети): при образовании донорно-акцепторной связи– образуется ион аммония, обладающий такими же свойствами как ионы К +, Na+ при взаимодействии с ионами Cl- , SO4 2– образуются соли аммония.
2. Получение солей аммония.
Я беру две стеклянные палочки и получаю белый дым. (Опыт дым без огня.)
“Дым без огня”.
Смочить одну стеклянную палочку раствором аммиака, а другую – концентрированной соляной кислотой и приложить друг к другу – появляется густой белый дым.
Мы с вами опровергли пословицу, что дыма без огня не бывает. Но это не просто дым, это частицы твёрдого вещества в воздухе. Произошла химическая реакция.
Запись уравнения реакции.
NH3 + НCL = NH4Cl
Какими еще способами можно получить соли аммония? Из кислот и гидроксида аммония.
NH4OH + H2SO4 = (NH4)2SO4 + 2H2O
3. Физические и химические свойства солей аммония
Физические свойства: твердые кристаллические вещества, хорошо растворимые в воде. (работа с учеб, §26 )
Будут ли соли аммония проявлять характерные свойства класса солей?
Ответы учащихся.
Для того чтобы убедиться, в этом выполним лабораторные опыты. [2] Вспомним правила техники безопасности.
а) Диссоциация: NH4Cl = NH4+ + Cl-
б) Взаимодействие с кислотами:
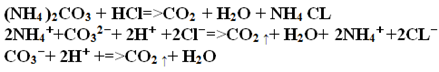
в) Взаимодействие с солями:
В пробирке налит 1 мл раствора хлорида аммония.
Добавьте к нему 1 мл раствора нитрата серебра.
Запишите наблюдения и соответствующие уравнения реакции.

г) Качественная реакция на ион аммония.
Оборудование и реактивы: пробирка, раствор хлорида аммония, раствор гидроксида натрия, лакмусовая бумажка.
1. В пробирке налит 1 мл раствора хлорида аммония.
2. Добавьте к нему 1 мл раствора гидроксида натрия.
Внесите красную лакмусовую бумагу в выделяющиеся пары.
Запишите наблюдения и соответствующие уравнения реакции
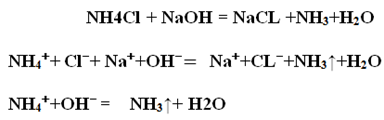
Вывод: реактивом на ион аммония (NH4+) является щелочь. Выделяется аммиак, обнаруживается по запаху (это качественная реакция на ион аммония).
д) Особые свойства солей аммония. (Слайд)
Демонстрация опыта “Вулкан”. (Слайд )
В фарфоровой ступке тщательно растирают 50 г оранжево-красных кристаллов бихромата аммония. Порошок (NH4)2Cr2O7 высыпают на большую металлическую пластинку или лист асбестового картона, придавая ему форму горки. На вершине “вулкана” гвоздем или палочкой делают лунку и вливают в нее 1–2 мл этилового спирта. Спирт поджигают спичкой, и свет в комнате гасят.
От тепла горения спирта начинает бурно разлагаться бихромат аммония. При этом из “кратера” выбрасывается сноп ярких искр и “вулканический пепел” – грязно-зеленый оксид хрома (III), объем которого во много раз превышает объем взятого бихромата аммония.
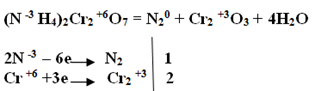
Кристаллический карбонат аммония разлагается даже без нагревания, поэтому неплотно закрытая банка с ним через несколько дней опустеет:
![]()
У солей аммония есть и свои, специфические свойства – они разлагаются при нагревании.
4. Применение солей аммония. Соли аммония – отличные азотные удобрения: это сульфат, фосфат и особенно нитрат аммония, или аммиачная селитра.)
5. Закрепление изученного.
На слайде.

2) “Да” или “нет”. (Слайд )
Утверждения.
1) Ион аммония имеет заряд -1 -
2) Соли аммония белые кристаллические вещества +
3) Все соли аммония хорошо растворимы в воде +
4) Дыма без огня не бывает -
5) Соли аммония обладают всеми свойствами солей +
6) Ион аммония имеет форму пирамиды +
7) Степень окисления азота в ионе аммония -4 -
8) Соли аммония можно определить действием щёлочи +
9) Аммиак не имеет характерного запаха _
10) Соли аммония – минеральные удобрения +
11) Нашатырный спирт – это раствор аммиака в воде +
6. Домашнее задание:
§26, задание №4, №5 и тесты на с.91
7. Рефлексия.
Удалось ли достичь поставленных целей.
Оцените Вашу работу на уроке.
Что получилось?
Что не получилось? В чём были затруднения?
Почему они возникли?
Над чем надо ещё поработать?
Где можно применить то, что узнали на уроке.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.