
Технологическая карта урока по химии 8 класс
Тема урока «Моль — единица количества вещества. Молярная масса».
Цель урока. Сформировать представления о количестве вещества как одной из основных физических величин. Показать численное равенство молярной и относительной молекулярной масс вещества. Научить вычислять количество вещества по известной массе вещества и массу вещества по известному количеству вещества.
Основные понятия.
Количество вещества, моль, число Авогадро, постоянная Авогадро, молярная масса
Планируемые результаты обучения
Предметные.
Знать число Авогадро, определения количества вещества и моля. Уметь определять число структурных единиц по данному количеству вещества и наоборот. Знать о равенстве числовых значений молярной и относительной молекулярной масс. Уметь вычислять массу данного количества вещества.
Метапредметные. Развивать умения самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учёбе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности.
Личностные. Формировать ответственное отношение к учению.
Основные виды деятельности учащихся.
Вычислять по химической формуле вещества его молярную массу. Вычислять количество вещества по известной массе и массу вещества по известному его количеству. Вычислять число молекул по заданному количеству вещества, применять при решении задач.
Демонстрации.
Образцы металлов и неметаллов количеством вещества 1 моль
Ход урока.
|
Этап
|
Деятельность учителя |
Деятельность учащихся |
УУД |
|
||||||||||||||||||
|
1.Организационный
|
Психологический настрой обучающихся на урок. Проверка готовности к уроку. |
Самоорганизация на учебную деятельность. |
|
|
||||||||||||||||||
|
II. Актуализация опорных знаний |
|
|
||||||||||||||||||||
|
Беседа. Повторение . Связь нового материала с изученным материалом темы «Типы химических реакций» |
Приложение 1. Повторение материала темы «Химические уравнения.Типы химических реакций» |
Самостоятельно работают; с последующей само- или взаимопроверкой , в случае необходимости, коррекция допущенных ошибок.
|
Л, П, К |
|
||||||||||||||||||
|
III. Мотивация (самоопределение) к учебной деятельности |
|
|||||||||||||||||||||
|
Цель: выработка на личностно значимом уровне внутренней готовности выполнения нормативных требований учебной деятельности. |
Приложение 2.
Вопрос Сколько молекул сахара содержится в 1 кг сахара? Можно ли сосчитать, сколько молекул воды помещается литровой бутылке ? А в одной капле? |
Взаимодействуют с учителем |
Л, П, К, Р |
|
||||||||||||||||||
|
IV. Актуализация и фиксирование индивидуального затруднения в пробном действии |
|
|||||||||||||||||||||
|
Цель этапа: подготовка мышления учащихся, организация осознания ими внутренней потребности к построению учебных действий и фиксирование каждым из них индивидуального затруднения в пробном действии. |
1. Для проведения химических реакций необходимо точно отмерить количества реагирующих веществ. Как отсчитать нужное число молекул? Просит выдвинуть предположение о теме предстоящего урока. |
Предполагают, о чем пойдет речь на уроке, исходя из этого, формулируют индивидуальные цели. |
П, К,Л |
|
||||||||||||||||||
|
VI Выявление места и причины затруднений |
|
|||||||||||||||||||||
|
Основная цель этапа - организовать анализ учащимися возникшей ситуации и на этой основе выявить места и причины затруднения,осознать то, в чем именно состоит недостаточность их знаний, умений или способностей. |
Мелкие предметы считают по-разному. Спички– коробками, салфетки – упаковками, яйца – десятками… Как посчитать молекулы? |
.Ребята предполагают, что молекулы необходимо отмерять порциями с определенным числом частиц в каждой. Число это должно быть очень большим, т.к. молекулы очень маленькие. |
П, К |
|
||||||||||||||||||
|
VII. Построение проекта выхода из затруднения (цель, тема, план, сроки, способ, средство) |
|
|||||||||||||||||||||
|
Цель этапа: постановка целей учебной деятельности и на этой основе – выбор способа и средств их реализации. |
Вещества вступают в реакцию в строго определённых соотношениях. Для получения сульфида железа, нужно взять столько железа и серы, чтобы на каждый атом железа приходился один атом серы. Fe + S = FeS Чтобы получить оксид фосфор (V), нужно взять столько молекул фосфора и кислорода, чтобы на четыре молекулы фосфора приходилось пять молекул кислорода. 4P + 5O2 = 2P2O5 Определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооружённым глазом. Для определения числа структурных единиц (атомов, молекул) в химии применяют особую величину – количество вещества (v – ню). Единицей количества вещества является моль. Итальянский ученый А.Авогадро предложил измерять количество вещества в молях. 1 моль – это 6·10²³частиц Приложение 3. |
Учащиеся пытаются осознать эту величину. Учащиеся вспоминают относительные атомные и молекулярные массы,записывают определения. Приходят к выводу, что необходимо связать число частиц и их массу |
П, Р, К |
|
||||||||||||||||||
|
VIII. Реализация построенного проекта |
|
|||||||||||||||||||||
|
Цель: построение учащимися нового способа действий и формирование умений его применять при решении задачи. |
1. Выслушивает ответы учащихся. 2. Молярная масса – масса 1 моль вещества. 3.Демонстрация простых и сложных веществ количеством 1моль 3.Таблица 5,6 на стр.121 учебника. 4.Схема 1
. |
Учащиеся должны: на основе выбранного метода выдвинуть и обосновать гипотезы, при построении нового знания использовать предметные действия с моделями, схемами и т.д., применить новый способ действий для решения задачи, вызвавшей затруднение, зафиксировать в обобщенном виде новый способ действий в речи и знаково, зафиксировать преодоление возникшего ранее затруднения. |
П, Р, К |
|||||||||||||||||||
|
IX. Первичное закрепление с проговариванием во внешней речи |
|
|||||||||||||||||||||
|
Цель: усвоение учащимися нового способа действия при решении типовых задач. |
1. Какое количество вещества соответствует 306 г оксида алюминия Al2О3? 2. Рассчитайте массу 4 моль азотной кислоты HNO3. 3. Сколько молекул содержится в 8 г молекулярного кислорода O2? 4. В какой массе воды содержится столько же молекул, сколько атомов в 36 г магния? Определить массу и объем для аммиака NH3 количество вещества, которого: В.1. 0,1 моль (1,7г, 2,24 л) В.2. 0,2 моль (3,4г, 4,48л) В3.Определите число атомов гелия Не в шарике объемом 11, 2 л. В4.Число молекул сахарозы С12Н22О11в сахарнице равно 6 х1023. Чему равна масса сахарозы? В5.В детской песочнице 120 г песка SiO2. Сколько молекул SiO2 в песочнице? Коррекция, координация деятельности обучающихся. |
На данном этапе учащиеся в форме коммуникации (фронтально, в парах) решают типовые задания на новый способ действий с проговариванием алгоритма решения вслух. |
П, К, Р |
|||||||||||||||||||
|
X. Самостоятельная работа с самопроверкой по эталону |
|
|||||||||||||||||||||
|
Цель: интериоризация нового способа действия и исполнительская рефлексия (коллективная и индивидуальная) достижения цели пробного учебного действия, применение нового знания в типовых заданиях. |
Учитель предлагает решить задачу,заполнив пустые клетки
Коррекция, координация деятельности обучающихся. |
Учащиеся самостоятельно выполняют задания нового типа и осуществляют их самопроверку, пошагово сравнивая с эталоном. В завершение организуется исполнительская рефлексия хода реализации построенного проекта учебных действий и контрольных процедур. Эмоциональная направленность этапа состоит в организации, по возможности, для каждого ученика ситуации успеха, мотивирующей его к включению в дальнейшую познавательную деятельность. . |
П, К, Р |
|||||||||||||||||||
|
XI. Рефлексия учебной деятельности на уроке |
|
|||||||||||||||||||||
|
Цель: самооценка учащимися результатов своей учебной деятельности, осознание метода построения и границ применения нового способа действия. |
1. Подводит итоги урока: "Какие открытия вы сделали сегодня на уроке?". 2. Дает дифференцированное домашнее задание. 1. 1)Прочитать § 36, упр.№3,4 2. 2). Творческое задание. Придумать и решить задачу по теме «Количество вещества» 3. Составить задания-загадки «Отгадай, о чем идет речь» 4. 3)задачи в табл.2 (в приложении) 3. Выставляет оценки за урок. |
Оценивают полноту полученных знаний, проводят самооценку своей работы. Записывают домашнее задание, определяют, какого уровня задание они хотят выполнить. |
Л, П, К, Р |
|||||||||||||||||||
Гара Н.Н. Химия. Уроки в 8 классе: пособие для учителя. _ М.: Просвещение, 2009
Химия. 8 класс: учебник для общеобразовательных организаций/ Г.Е Рудзитис, Ф.Г Фельдман.- 4-е изд. - М.: Просвещение, 2016.-207с.
Вариант 1
1. Перепишите приведенные ниже схемы реакций, расставьте коэффициенты и укажите, к какому типу относится каждая из реакций.
а) Р + O2 → P2O5
в) СаСО3 → СаО + С
б) Zn + HCl → ZnCl2 + H2
г) Al + S → Al2S3
Вариант 2
1. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций.
а) HgO → Hg + O2
в) CuSO4 + Fe → FeSO4 + Cu
б) N2 + H2 → NH3
г) H2O2 → H2O + O2
Вариант 3
1. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций
а) Mg + O2 → MgO
в) ВаСО3 → ВаО + СO2
б) Fe + HCl →FeCl2 + H2
г) СО + O2 → СO2
Вариант 4
1. Перепишите приведенные ниже схемы реакций, расставьте в них коэффициенты и укажите, к какому типу относится каждая из реакций.
а) СH4 → С + H2
в) CuCl2 + Mg → MgCl2 + Cu
б) NO + O2 → NO2
г) KCl3 → KCl + O2
Приложение 2
Девиз к уроку
Начинаем изучение новой темы со строк поэмы М. Алигер “Ленинские горы”
О, физика – наука из наук!
Все впереди!
Как мало за плечами!
Пусть химия нам будет вместо рук.
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
Выделите основные взаимосвязи, которые представлены в тексте.
Эти строки раскрывают связь химии с другими естественными науками, причем об этом говорил ещё М.В. Ломоносов более двух веков назад, актуальной является эта мысль и сейчас.
Приложение 3.
Постоянная Авогадро настолько велика, что с трудом поддается воображению. Например, если футбольный мяч увеличить в NА раз по объему, то в нем поместится земной шар. Если же в NА раз увеличить диаметр мяча, то в нем поместится самая большая галактика, содержащая сотни миллиардов звезд! Если вылить стакан воды в море и подождать, пока эта вода равномерно распределится по всем морям и океанам, до самого их дна, то, зачерпнув в любом месте Земного шара стакан воды, в него обязательно попадет несколько десятков молекул воды, которые были когда-то в стакане. Если же взять моль долларовых бумажек, они покроют все материки 2-километровым плотным слоем
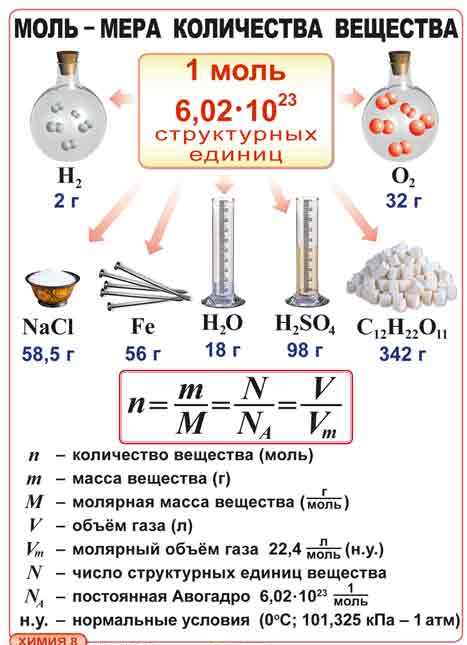
Таблица 1.
|
Вещество |
Молярная масса, г/моль, M |
Масса вещества, г, m |
Количество вещества, моль, n |
|
H2 |
|
10 |
|
|
O2 |
|
6,4 |
|
|
N2 |
|
56 |
|
Таблица 2.(дифференцированное домашнее задание)
|
Формула |
Мr |
М г/моль |
n моль |
m |
N(число частиц) |
|
1. SO2 |
32 |
||||
|
2. CH4 |
5 |
||||
|
3.NH3 |
34 |
||||
|
4.PH3 |
0,5 |
||||
|
5.HCl |
2,5 |
||||
|
6.O3 |
3*1023 |
||||
|
7. H2O |
9 |
||||
|
8. NO2 |
12*1023 |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.