
|
Раздел долгосрочного плана: 8.3В Введение в энергетику химических реакций
|
Школа: НИШ ХБН г.Атырау |
|||||||||||||||||||||||||||||||||||||||||||
|
Дата:19.02.20 |
ФИО учителя: Ким Е.Г. |
|||||||||||||||||||||||||||||||||||||||||||
|
Класс: 8f |
Количество присутствующих: |
отсутствующих: |
||||||||||||||||||||||||||||||||||||||||||
|
Тема урока |
Термохимические уравнения реакции .Вычисления по термохимическим уравнениям реакции |
|||||||||||||||||||||||||||||||||||||||||||
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) |
8.2.3.12 вычислять количество теплотыпо термохимическому уравнению |
|||||||||||||||||||||||||||||||||||||||||||
|
Цели урока |
Различать экзотермические уравнения от эндотермических Производить расчеты по термохимическим уравнениям реакций Различать термохимические уравнения от химических реакций |
|||||||||||||||||||||||||||||||||||||||||||
|
Критерии оценивания |
Знание и понимание Учащийся достиг цели обучения, если Различать экзотермические уравнения от эндотермических Производить расчеты по термохимическим уравнениям реакций |
|||||||||||||||||||||||||||||||||||||||||||
|
Применение знаний Учащийся достиг цели обучения, если Производить расчеты по термохимическим уравнениям реакций Различать термохимические уравнения от химических реакций |
||||||||||||||||||||||||||||||||||||||||||||
|
Языковые цели
|
Учащиеся могут: – приводить примеры экзотермических и эндотермических реакций из повседневной жизни; – объяснять разницу между экзотермическими и эндотермическими процессами. Набор фраз для диалога: Температура понизилась/повысилась, следовательно, это – экзо/эндотермическая реакция. Реакции, протекающие с выделением/поглощением теплоты называются экзо/эндотермическими.
При протекании любой реакции происходит ... или ... теплоты. Реакции бывают ... / с ... теплоты /, ... / с ... теплоты /. Химические уравнения, в которых указывается ... эффект, называются ... . ... химической реакции называется ... , выделяемое при образовании 1 моля продукта.
Учащиеся могут использовать: конкретно-тематические слова, связанные с изучением темы:
|
|||||||||||||||||||||||||||||||||||||||||||
|
Привитие ценностей
|
Уважение при групповой работе Открытость при оценивании работы учащихся Труд и творчество Обучение на протяжении всей жизни |
|||||||||||||||||||||||||||||||||||||||||||
|
Межпредметные связи |
межпредметная интеграция на уроке реализуется при разных видах деятельности на уроке математика при выполнении вычислений |
|||||||||||||||||||||||||||||||||||||||||||
|
Предварительныезнания
|
7.2А Реакция горения 7.2ВПростые химические реакции 7.1В Изменения агрегатного состояния веществ 7.3C Растворы и растворимость |
|||||||||||||||||||||||||||||||||||||||||||
|
Ход урока |
||||||||||||||||||||||||||||||||||||||||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке
|
Ресурсы |
||||||||||||||||||||||||||||||||||||||||||
|
Начало урока 0-2 мин
3-7 мин
8-18 мин
19-30 мин
31-37 мин |
Создание коллаборативной среды Химическая разминка . Учащиеся выполняют действия: Экзотермические реакции- приседание ;эндотермические -поворот влево, энергия выделяется- поворот вправо; энергия поглощается-потрясти кистями. 1. Взрыв смеси водорода с воздуха. Это экзотермическая реакция.(приседание) 2.Фотосинтез это эндотермическая реакция (поворот влево) 3.Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии (выделяется) поворот вправо) 4.В данной реакции C + H2O =CO + H2 - 165,3 кДж/кмоль энергия ( поглощается потрясти кистями) Стадия вызова Индивидуальная работа, переходящая в парную работу А
теперь, ребята, мы с вами немного поиграем: Задание . Вам нужно правильно определить вид термохимического уравнения) a)СаСО3 =СаО +СО2 (эндотермические) b) 4Аl+3O2 = 2Al2O3 (экзотермические) c) 2Mg+O2 = 2MgO(экзотермические) d) 2 HgO=2Hg +O2 (эндотермические) е) 6СО2 +6 H2O = C6H12O6 + 6O2 (эндотермические) f) 4NH3(г)+5О2(г)=4NO(г)+6Н2О(г) (экзотермические) Учащиеся взаимооценивают друг друга. Учитель проводит оценивание работ учащихся. Если возникают затруднения при выполнении заданий, учитель дает комментарии и объяснения. Стадия побуждения Индивидуальная работа, переходящая в групповую работу Прием «Каждый учит другого» Каждый ученик получает информацию по данной теме, самостоятельно изучает его.По истечении времени,ученик с одной пары (группы) переходит в другую.После работы в паре обмениваются мнением с классом, и их мнения записываются для дальнейшего применения при выполнении заданий. Ученик Вопросы, на которые никто не смог ответить, записываются на доске.Проводится взаимооценивание групп . По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему Задание: составить алгоритм для решения задач по термохимическим уравнениям и решить их Возможный ответ учащихся.Алгоритм решения задач по термохимическому уравнению реакции
Стадия осмысления Учащиеся выбирают задания разного уровня сложности Уровень А. Рассчитайте количество теплоты, которое образуется при сгорании 24 г
углерода. Термохимическое уравнение: Дано: Решение: Уровень В Составить термохимическое уравнение реакции горения магния, если известно, что при сгорании магния массой 2,4 г выделяется 60,12 кДж теплоты. (Ответ: 2 Mg+ O2=2MgO +1202,4 кДж) Уровень С Для сварки рельсов по методу алюминотермии используют смесь алюминия и оксида железа Fe3O4.Составьте термохимическое уравнение реакции, если при образовании железа массой 1 кг выделяется 6340 кДж тепла. ( 8Al+3Fe3O4=4Al 2O3 +9 Fe +3195 ,36кДж) Учащиеся, которые решали уровень А,В,С объединяются для выступления Обсуждение решений заданий, взаимооценивание групп После выполнения заданий проводится оценивание групп по критериям оценивания, разъяснение заданий, которые вызвали затруднения у учащихся.Если останется время можно просмотреть видеофрагмент
|
презентация
Прило жение 1 смайлики
http://himekoscho.ucoz.ru/load/termokhimicheskie_uravnenija/27-1-0-130 ноутбуки
Рабочие листы
Приложение 2
https://www.youtube.com/watch?v=XFDv8WwNuM0
|
||||||||||||||||||||||||||||||||||||||||||
|
Конец урока 38-40 мин
|
В конце урока учащиеся проводят рефлексию 1.Что нового изучили? 2.Какова была цель урока? Достигли ли ее? 3.Какие возникали сложности при решении задач? 4.Что необходимо знать для успешного решения задач? 5.На что необходимо обратить внимание при решении задач? В завершении урока учитель проводит рефлексию. Ученик выбирает и проговаривает свое состояние в конце урока – "я” –
как я себя чувствовал в процессе урока, доволен ли я своей
работой______________________________________________ Домашнее задание Просмотреть учебник Бектемирова Т.В.,с.96-97 А уровень ). Согласно термохимическому уравнению реакции СН4(г)+2О2(г)=СО2(г)+2Н2О(г)+802кДж количество теплоты, выделившейся при сжигании24г метана В уровень Составить алгоритм решения к задаче В результате реакции, термохимическое уравнение которой 4NH3(г)+5О2(г)=4NO(г)+6Н2О(г)+902 кДж, выделилось 1127, кДж теплоты. Вычислите Объем (н.у.) образовавшегося при этом оксида азота (II) С уровень Составить задачу и решить ее
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники безопасности |
||||||||||||||||||||||||||||||||||||||||||
|
Все учащиеся смогут: составить алгоритм решения задачи Большинство учащихся:производит вычисления по термохимическим уравнениям Некоторые учащиеся:объясняют как можно вычисления по термохимическим уравнениям на большинстве примерах
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными? Все ли учащиеся достигли ЦО? Если нет, то почему? Правильно ли проведена дифференциация на уроке? Выдержаны ли были временные этапы урока? Какие отступления были от плана урока и почему? |
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. |
|||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||
Задание . Определить вид термохимического уравнения)
a)СаСО3 =СаО +СО2
b) 4Аl+3O2 = 2Al2O3
c) 2Mg+O2 = 2MgO
d) 2 HgO=2Hg +O2
е) 6СО2 +6 H2O = C6H12O6 + 6O2
f) 4NH3(г)+5О2(г)=4NO(г)+6Н2О(г)
Задание . Определить вид термохимического уравнения)
a)СаСО3 =СаО +СО2
b) 4Аl+3O2 = 2Al2O3
c) 2Mg+O2 = 2MgO
d) 2 HgO=2Hg +O2
е) 6СО2 +6 H2O = C6H12O6 + 6O2
f) 4NH3(г)+5О2(г)=4NO(г)+6Н2О(г)
Задание . Определить вид термохимического уравнения)
a)СаСО3 =СаО +СО2
b) 4Аl+3O2 = 2Al2O3
c) 2Mg+O2 = 2MgO
d) 2 HgO=2Hg +O2
е) 6СО2 +6 H2O = C6H12O6 + 6O2
f) 4NH3(г)+5О2(г)=4NO(г)+6Н2О(г)
Алгоритм решения задач по термохимическому уравнению реакции
Приложение 2
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете что, оценивание не достаточно (по желанию)
|
Группа № |
Группа№ |
Группа№ |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно) |
|
|
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете что, оценивание не достаточно (по желанию)
|
Группа № |
Группа№ |
Группа№ |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно) |
|
|
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете что, оценивание не достаточно (по желанию)
|
Группа № |
Группа№ |
Группа№ |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно) |
|
|
Расчёты по ТХУ
Решение задач у доски.
При определении выделившейся или поглощенной энергии в результате химической реакции пользуются правилом: количество теплоты прямо пропорционально количеству веществ, вступивших в реакцию и образовавшихся веществ в результате нее.
Задача 1.
Используя термохимическое уравнение реакции 2Н2О(ж) = 2Н2(г) + О2(г) – 572кДж, определите какое количество теплоты надо затратить на разложение 72г воды.
Дано:
m(H2O)=72г
Q1-?
Решение:
1. Определяем количество вещества воды
n=m/M,
M(H2O)=1∙2+16=18(г/моль); n(H2O)=72г:18г/моль=4 моль
2. Запишем термохимическое уравнение реакции, составив пропорцию определяем количество теплоты.
2Н2О(ж) = 2Н2(г) + О2(г) – 572кДж
2 моль 571 кДж
4 моль х кДж
Х= 4 моль * 571 кДж /2 моль
Х = 1144 кДж
Ответ: 1144кДж
Задача 2.
Определите тепловой эффект реакции 2SO2(г) + O2(г) = 2SO3(г) + Q, если прореагировал оксид серы (IV) объемом 67,2л (н.у.), и при этом выделилось 294 кДж теплоты.
Дано:
Решение.
Q1=294 кДж
V(SO2)(н.у.)=67,2л
Q - ?
1. Запишем термохимическое уравнение реакции. Над формулами веществ напишем данные задачи, под формулами – количественные отношения.
67,2л 294 кДж
2SO2(г) + O2(г) = 2SO3(г) + Q
2 моль
2. Какое количество оксида серы (IV) занимает объем 67,2л? n=V/Vm
n=67,2л:22,4л/моль= 3 моль.
3. Определяем тепловой эффект химической реакции.
3 моль 294 кДж 3моль:2моль=294кДж:Q
2SO2(г) + O2(г) = 2SO3(г) + Q Q=2моль∙294кДж:3моль=196кДж
2 моль
Ответ: Q=196кДж
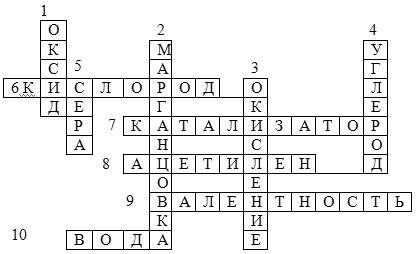
Игровой материалв оставшееся время учащиеся разгадывают кроссворд по теме: «Кислород».
Кроссворд ( работа с классом )
Вопросы:
1. Сложное вещество, состоящее из
двух элементов, один из которых кислород
2. Вещество, при разложении которого в
лаборатории получают кислород ( бытовое название )
3. Реакция кислорода с другими веществами
4. Химический элемент, образующий газообразный оксид
5. Вещество жёлтого цвета, горящее в
кислороде синим пламенем
6. Самый распространённый на Земле элемент
7. Вещество, увеличивающее скорость химической реакции
8. Вещество, применяющееся с кислородом для
сварки и резки металлов
9. Свойство атомов химических элементов
присоединять определённое число атомов других
химических элементов
10. Оксид водорода
|
Раздел долгосрочного плана: |
Школа: НИШ ХБН г.Атырау |
|||||||
|
Дата: |
ФИО учителя: Ким Е.Г. |
|||||||
|
Класс: 8е |
Количество присутствующих: |
отсутствующих: |
||||||
|
Тема урока |
Термохимические уравнения реакции Вычисления по термохимическим уравнениям реакции |
|||||||
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) |
8.2.3.12 вычислять количество теплотыпо термохимическому уравнению |
|||||||
|
Цели урока |
Продолжить формировать понятие о тепловом эффекте реакции Уметь составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции обмениваться знаниями между членами группы для принятия эффективных решений. |
|||||||
|
ЦПР |
Развитие коммуникативных навыков исследовательской деятельности у учащихся через приемы стратегии критического мышления |
|||||||
|
Критерии оценивания
|
Навыки Знание, понимание, применение, критическое мышление Учащийся достиг цели обучения, если: Понимает и применяет знания при вычислениях по химическим уравнениям |
|||||||
|
Языковые цели
|
Ученики могут: составить алгоритм решения задачи и решить ее Предметная лексика и терминология: топливо, энергия, процесс горения, теплота, энергия, экзотермический, эндотермический, выделение энергии, поглощение энергии Серия полезных фраз для диалога/письма Температура понизилась/повысилась, следовательно, это – экзо/эндотермическая реакция. Реакции, протекающие с выделением/поглощением теплоты, называются экзо/эндотермическими. |
|||||||
|
Привитие ценностей
|
Уважение при групповой работе Открытость при оценивании работы учащихся Труд и творчество Обучение на протяжении всей жизни |
|||||||
|
Межпредметные связи |
межпредметная интеграция на уроке реализуется при разных видах деятельности на уроке из курса естествознания, физики, математики |
|||||||
|
Предварительныезнания
|
7.2А Реакция горения 7.2ВПростые химические реакции 7.1В Изменения агрегатного состояния веществ 7.3C Растворы и растворимость |
|||||||
|
Ход урока |
||||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке
|
Ресурсы |
||||||
|
Начало урока 0-3мин
4-7 мин
|
Создание коллаборативной среды Учитель : У
нас сегодня необычный урок-урок праздник!Ну а какой же праздник без гостей? С целью создания благоприятной работы на уроке и проверки знаний учащихся по изученному материалу и подготовке к объяснению нового материала учитель проводит разминку ,учащиеся выполняют действия: Экзотермические реакции- приседание ;эндотермические -поворот влево, энергия выделяется- поворот вправо; энергия поглощается-потрясти кистями. Задание «Пригласи меня». 1. Взрыв смеси водорода с воздуха. Это экзотермическая реакция.(приседание) 2. Фотосинтез это эндотермическая реакция (поворот влево) 3. Когда в результате химической реакции при образовании новых связей выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии (выделяется) поворот вправо) 4.В данной реакции C + H2O =CO + H2 - 165,3 кДж/кмоль энергия ( поглощается потрясти кистями)
Стадия вызова Индивидуальная работа, преходящая в парную работу А
теперь, ребята, мы с вами немного поиграем: Задание . Вам нужно правильно определить вид термохимического уравнения) a)СаСО3 =СаО +СО2 (эндотермические) b) 4Аl+3O2 = 2Al2O3 (экзотермические) c) 2Mg+O2 = 2MgO(экзотермические) d) 2 HgO=2Hg +O2 (эндотермические) е) 6СО2 +6 H2O = C6H12O6 + 6O2 (эндотермическая) Учащиеся взаимооценивают друг друга. Если возникают затруднения при выполнении заданий, учитель дает комментарии и объяснения.
Стадия побуждения Стадия осмысления С целью создания благоприятной среды и мотивации на уроке учащимся предлагается просмотреть видео фрагмент. Учащимся предлагается ответить на вопросы: 1.О чем было данное видео? 2.Какие свойства вещества были показаны в видеофрагменте? Учитель проводит беседу с учащимися. После совместного обсуждения ответов учащихся учитель совместно с учащимися определяет тему, цели урока и цели обучения
Учащиеся образуют группу по вкусовым предпочтениям
|
презентация
https://twig-bilim.kz/ru/film/how-do-fireworks-work (о фейерверках)
киндерсюрпризы приложение1
презентация
Киндерсюр призы
https://twig-bilim.kz/ru/film/how-do-fireworks-work(о фейерверках)
|
||||||
|
Середина урока 8-18мин
19--37 мин
|
Стадия осмысления Индивидуальная работа, переходящая в групповую работу Прием «Каждый учит другого» Каждый ученик получает информацию по данной теме, самостоятельно изучает его.По истечении времени,ученик с одной пары (группы) переходит в другую.После работы в паре обмениваются мнением с классом, и их мнения записываются для дальнейшего применения при выполнении заданий. Ученик Вопросы, на которые никто не смог ответить, записываются на доске. Проводится взаимооценивание групп . По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему Задание: составить алгоритм для решения задач по термохимическим уравнениям и решить их Возможный ответ учащихся.Алгоритм решения задач по термохимическому уравнению реакции
Учитель:
Ребята на наш праздник я приглашала королеву Энергию – повелительницу
химических реакций. Но она не смогла прийти, а прислала подарок с сюрпризом.
Чтобы узнать какой сюрприз она прислала мы должны выполнить её просьбу. Учащиеся выбирают задания разного уровня сложности Уровень
А. Рассчитайте
количество теплоты, которое образуется при сгорании 24 г углерода.
Термохимическое уравнение: Дано:
Решение: Уровень В Составить термохимическое уравнение реакции горения магния, если известно, что при сгорании магния массой 2,4 г выделяется 60,12 кДж теплоты. Уровень С Для сварки рельсов по методу алюминотермии используют смесь алюминия и оксида железа Fe3O4.Составьте термохимическое уравнение реакции, если при образовании железа массой 1 кг выделяется 6340 кДж тепла.
Решение задач
После проводится самооценивание, взаимооценивание и оценивание работ учителем. Просмотр видео по вопросам, возникшим при выполненни заданий
|
Ноутбуки https://www.youtube.com/watch?v=XFDv8WwNuM0 http://himekoscho.ucoz.ru/load/termokhimicheskie_uravnenija/27-1-0-130
Приложение
Презентация Приложение 2 Приложение 3
Приложение 3
|
||||||
|
Конец урока 38-40 мин
|
В конце урока учащиеся проводят рефлексию 1.Что нового изучили? 2.Какова была цель урока? Достигли ли ее? 3.Какие возникали сложности при решении задач? 4.Что необходимо знать для успешного решения задач? 5.На что необходимо обратить внимание при решении задач? В завершении урока учитель проводит рефлексию. Ученик выбирает и проговаривает свое состояние в конце урока – "я” –
как я себя чувствовал в процессе урока, доволен ли я своей работой______________________________________________
Домашнее задание Составить задачу и решить ее
|
стикеры |
||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и
соблюдение техники безопасности |
||||||
|
Все учащиеся смогут: составить алгоритм решения задачи Большинство учащихся:производит вычисления по термохимическим уравнениям Некоторые учащиеся:объясняют как можно вычисления по термохимическим уравнениям на большинстве примерах |
Используйте данный раздел для записи методов, которые Вы будете использовать для оценивания того, чему учащиеся научились во время урока. |
Здоровьесберегающие технологии. Используемые физминутки и активные виды деятельности. Пункты, применяемые из Правил техникибезопасности на данном уроке.
|
||||||
|
Рефлексия по уроку
Были ли цели урока/цели обучения реалистичными? Все ли учащиеся достигли ЦО? Если нет, то почему? Правильно ли проведена дифференциация на уроке? Выдержаны ли были временные этапы урока? Какие отступления были от плана урока и почему? |
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. |
|||||||
|
|
||||||||
|
Общая оценка
Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)? 1:
2:
Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)? 1:
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
|
||||||||
Приложение 1
Задание . Вам нужно правильно определить вид термохимического уравнения)
a)СаСО3 =СаО +СО2
b) 4Аl+3O2 = 2Al2O3
c) 2Mg+O2 = 2MgO
d) 2 HgO=2Hg +O2
е) 6СО2 +6 H2O = C6H12O6 + 6O2
Приложение 1
Алгоритм решения задач по термохимическому уравнению реакции
Приложение 2
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете что, оценивание не достаточно (по желанию)
|
Группа №1 |
Группа№2 |
Группа№3 |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно)
|
|
|
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете, что оценивание не достаточно (по желанию)
|
Группа №2 |
Группа№1 |
Группа№3 |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно)
|
|
|
Критерии взаимооценивания групп
Поставить знак «+», если данный критерий достигнут или знак «-«, если критерий не был достигнут.Предложите свой критерий , если считаете, что оценивание не достаточно (по желанию)
|
Группа №3 |
Группа№1 |
Группа№2 |
|
Правильно составлен алгоритм решения задачи |
|
|
|
Объяснение понятно |
|
|
|
Ораторское искусство |
|
|
|
Участие всех членов группы |
|
|
|
Задача решена правильно |
|
|
|
Ваш критерий (обязательно)
|
|
|
Приложение 3
Лист взаимооценивания партнера А
Тема: Решение задач по термохимическим уравнениям реакцийКласс___________________
Фамилия оцениваемого ученика__________________
Оценивается учеником ___
|
Критерии оценивания Ученик достиг цели, если: |
«Достиг « или «Стремится» |
|
Навыки Знание, понимание, применение |
|
|
Составляет уравнение реакции |
|
|
Применяет формулы для расчета |
|
|
Правильно решает задачу |
|
|
Записывает ответ задачи |
|
Лист взаимооценивания партнера В
Тема:Решение задач по уравнениям реакций Класс___________________
Фамилия оцениваемого ученика__________________
Оценивается учеником ___
|
Критерии оценивания Ученик достиг цели, если: |
«Достиг « или «Стремится» |
|
Навыки Знание, понимание, применение |
|
|
Составляет уравнение реакции |
|
|
Применяет формулы для расчета |
|
|
Правильно решает задачу |
|
|
Записывает ответ задачи |
|
Составьте алгоритм решения задачи на вычислениеколичества теплоты по термохимическому уравнению, затем по известному количеству вещества найти тепловой эффект.
(Г) Предложите учащимся в парах (или в группах) решить задачи на вычисление количества теплоты по известной массе, объему, количеству реагента.
Видео о экзо=эндо
https://twig-bilim.kz/ru/film/energy-change-of-reactions
https://twig-bilim.kz/ru/film/how-do-fireworks-work (о фейерверках)
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.