
Урок химии по теме "Алюминий". 9-й класс
Цель урока: формирование системы знаний о строении, свойствах алюминия и его соединений.
Задачи: Обучающие: познакомить учащихся с историей открытия, изучения свойств и применении алюминия; познакомить учащихся со строением и свойствами алюминия и его соединений. Развивающие: развивать умения обобщать, сравнивать, делать выводы о наличии взаимосвязей между составом и свойствами веществ; развивать мотивацию изучения предмета при обращении к жизненному опыту школьников; развивать речь, творческие и интеллектуальные способности учащихся, самостоятельность. Воспитательные: развивать познавательный интерес к предмету;вырабатывать культуру умственного труда ответственность и естественно-материалистическое мировоззрение.
ХОД УРОКА
I. Организационный момент
Металлов много есть, но дело не в количестве:
В команде работящей металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
II. Мотивация и целеполагание
Сегодня познакомимся с хорошо известным вам металлом. Послушаем сообщение и сделаем вывод, о каком металле идет речь.
Этот элемент сразу после его открытия привлек химиков своей красотой и легкостью. Внешне походит на серебро, примерно в три раза легче железа и меди. Он очень пластичен: его можно прокатать в тонкую фольгу, сделать тончайшие украшения, придать нужную форму . Вот только прочность чистого металла невелика, но в виде сплавов с другими металлами он заметно «крепчает». Уже созданы сплавы данного элемента с прочностью в 10 раз выше, чем у стали.
Первоначально из-за несовершенного способа получения был необычайно дорог – почти в 10 раз дороже золота. Первые украшения и изделия из него были доступны только очень богатым людям. Император Наполеон III заменил серебряную посуду в своем дворце на более дорогую и редкостную, изготовленную из данного металла. Так, не ведая того, французский император заглянул в XX в., когда посуда из этого металла стала обычной в любом доме. В знак признания выдающихся заслуг Д.И.Менделеева в Великобритании ему был преподнесен подарок – весы, одна чаша которых была сделана из золота, а другая – из этого химического элемента.
На балах знатные дамы во времена Наполеона III нередко щеголяли ювелирными украшениями, изготовленными из этого элемента. Я думаю, вы догадались, что это за элемент? (Алюминий)
III. Актуализация знаний
Вспомним, где располагаются металлы в Периодической системе? все они располагаются в левой нижней части ПС.
– Какие физические свойства металлов вам известны? агрегатное состояние металлов, блеск, пластичность, хорошую электро-, теплопроводность
Ознакомимся с планом изучения металла алюминия.
IV. Изучение нового материала
Алюминий по распространенности в природе среди всех элементов занимает 3 место. На его долю приходится 8,13% от массы земной коры.
В природе встречается только в виде соединений.
В основном он сосредоточен в минералах, называемых алюмосиликатами . К их числу относятся как обыкновенные глины и слюда, так и замечательные драгоценные камни, такие как гранат, берилл, топаз Важнейшими минералами алюминия, имеющими промышленное значение являются бокситы (Al2O3 . H2O), криолит (Na3AlF6) и др.
Как вы думаете, какой алюминий металл: активный или неактивный? из своего жизненного опыта ребята отвечают, что это неактивный металл (в посуде из алюминия готовят пищу, алюминиевые провода не реагируют с водой), другие делают предположение об активности алюминия, так как он находится в электрохимическом ряду напряжения металлов сразу после активных металлов.
-Чтобы правильно ответить на вопрос, опишите свойства алюминия. Выполните лабораторный опыт.
ЛО: Рассмотрите образцы алюминиевой фольги и проволоки. Несколько раз согните и разогните проволоку. О каком свойстве алюминия позволяют судить эти действия? Поцарапайте поверхностную оксидную пленку на проволоке. Что вы наблюдаете?
Опишите физические свойства алюминия, используя наблюдения, справочник по плану.
Физические свойства: блестящий металл серебристого цвета, легкий, = 2700 кг/м3, tпл = 660°C , высокопластичный, характеризуется высокой электро- и теплопроводностью.
На поверхности алюминия тонкая и прочная, но отслаивающаяся при механическом воздействии (сгибании-разгибании) пленка. Ее толщина всего 0,00001 мм, но она надежно защищает металл от атмосферных воздействий, обеспечивая высокую коррозионную устойчивость.
Можно уже сделать вывод об активности алюминия? (Нет). Рассмотрим химические свойства алюминия, так как знание только физических свойств не позволяет судить об активности алюминия.
Химические свойства алюминия 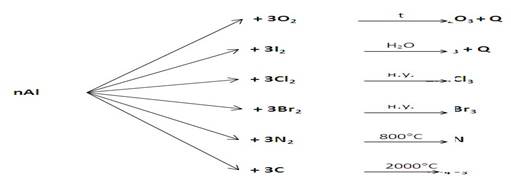
Взаимодействует с простыми веществами: кислородом, галогенами, азотом, углеродом
Сущность процессов выражается уравнениями (записи в тетрадь):
Взаимодействует со сложными веществами (записи в тетради):
1. Взаимодействие с водой. Взаимодействие алюминия с водой. Сущность процесса выражается уравнением (записи в тетрадь): 2Al + 6H2O =2Al(OH)3 + 3H2
2. Взаимодействие с кислотами. Алюминий реагирует с соляной и разбавленной серной кислотами
2Al + 3H2SO4 =2Al2(SO4)3 + 3H2 Но не взаимодействует при нормальных условиях с очень разбавленными и концентрированными растворами азотной кислоты (пассивируется).
3. После удаления оксидной пленки алюминий активно взаимодействует со щелочами, образуя комплексные соединения (гексагидроксоалюминаты).
Сущность процесса взаимодействия алюминия со щелочью можно выразить следующим уравнением реакции: 2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2
гексагидроксоалюминат натрия
2Al0 + 6OH- + 6H2O = 2Na3[Al(OH)6]3- + 3H2
4. Взаимодействие с оксидами металлов – алюмотермия (алюминотермия)
Вследствие высокого сродства алюминия к кислороду этот металл способен восстанавливать многие другие металлы (вольфрам, ванадий): Cr2O3 + 2Al = 2Cr + Al2O3
Обобщение по химическим свойствам Алюминий является активным металлом, реагирует с простыми веществами-неметаллами, восстанавливает металлы до свободного состояния, стоящие в электрохимическом ряду напряжения справа от него. Как амфотерный элемент реагирует и с кислотами и со щелочами. Однако при комнатной температуре на воздухе алюминий не изменяется, так как покрыт защитной оксидной пленкой.
Важнейшие соединения алюминия
Оксид алюминия В природе существует несколько различающихся по строению модификаций оксида алюминия. Наиболее устойчива модификация, называемая корундом. Минерал корунд характеризуется значительной твердостью. Его мелкокристаллические непрозрачные разновидности серовато-черного цвета называют наждаком и применяют в качестве абразивного материала.Корунд удивительно многолик. В коллекции минералогического музея Санкт-Петербургского горного института хранятся корунды более 40 оттенков: красных, синих, зеленых, оранжевых, желтых цветов.Оксид алюминия является основной составной частью глинистых минералов: глин, нефелина, бокситов.Оксид алюминия нерастворим в воде, амфотерен. Он сплавляется с твердыми KOH и NaOH, взаимодействует с кислотами и щелочами.
Учащиеся совместно с учителем составляют уравнения реакций, отражающие химические свойства оксида алюминия. Al2O3 + 6HCl = 2AlCl3 + 3H2O, Al2O3 + 2NaOH = 2NaAlO2 + H2O
Гидроксид алюминия – полимерное соединение, имеющее слоистое строение.
ЛО: Амфотерность гидроксида алюминия.
Получите гидроксид алюминия, добавляя к раствору хлорида алюминия по каплям раствор гидроксида аммония и разделите его на две части. К первой прилейте раствор соляной кислоты, ко второй – раствор гидроксида натрия. Что наблюдаете? О каком свойстве гидроксида алюминия это свидетельствует? Запишите уравнения соответствующих реакций в молекулярном и ионном виде.
Амфотерные свойства гидроксида алюминия
-Где применяется алюминий? в быту (посуда), в строительстве, в качестве упаковочного материала (фольга), вспоминают о том, что «алюминий» – крылатый металл и т.д.
Вывод (по цепочке каждый ученик высказывает одно предложение с информацией об алюминии, условие – не повторяться):
1. Алюминий занимает третье место по распространенности в земной коре.
2. Имеет малую плотность.
3. Обладает высокой электропроводностью и теплопроводностью.
4. Обладает высокой коррозионной стойкостью.
5. Сплавы на основе алюминия обладают прочностью.
6. Находит широкое практическое применение.
V. Закрепление изученного материала
Вопросы: Какое место по распространенности в земной коре занимает алюминий? (Третье).
Встречается ли алюминий в природе в свободном виде? (Нет).
Что означает амфотерность алюминия и его соединений? (Обладает двойственными свойствами, реагирует как с кислотами, так и со щелочами).
Назовите минерал состава Al2O3, обладающий очень высокой прочностью и твердостью. (Корунд).
Назовите способ получения металлов из оксидов с помощью алюминия. (Алюминотермия).
Чем является алюминий в химических реакциях? (Восстановитель).
В качестве закрепления предлагается тест, выполненный на основе конструктора тестов
А.А. Баженова, позволяет создавать как проверочные тесты, так и обучающе-контролирующие ресурсы, а также использовать при подготовке к ГИА. (Приложение 3)
1.
Электронная формула
алюминия:
1s2s 2p 3s 3p
2. Алюминий является ___ элементом
3.
Положение в
периодической системе:
порядковый номер ________, период ___группа ________,
подгруппа _____________
4. Относительная атомная масса ____________
5. Число энергетических уровней в атоме _______
6.
Заряд ядра
атома ______, число протонов ______, число нейтронов _____,
общее число электронов _____
7. Валентность _____
8. Степени окисления _________
9. Алюминий металл неметалл (нужное подчеркнуть)
10. Формула оксида и его характер _________________________________
11. Формула гидроксида и его характер _____________________________
VI. Подведение итогов урока
VII. Домашнее задание. §13. В качестве домашнего задания также предлагается выполнить творческие задания: подготовить небольшие доклады, презентации о применении алюминия. (Алюминий – тара и упаковка, алюминий в фармацевтике, транспорте, электрике и машиностроении, строительстве).
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.