
Урок химии 9 класс по теме «Аммиак и его свойства. Соли аммония»
Цель: изучить строение молекулы и свойства аммиака.
Задачи:
- раскрыть сущность образования химической связи в молекуле аммиака и иона аммония;
- рассмотреть особенности химических реакций, протекающие с аммиаком, способы получения аммиака.
- объяснить физиологическое воздействие аммиака на организм человека, рассмотреть практическое использование аммиака;
- продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы.
Ход урока.
I. Организационный момент.
II. Сообщение темы урока.
- Вещество, о котором пойдет речь, имеет древнюю историю.
Демонстрация опыта.
В химическую колбу, в которой находится немного раствора аммиака приливаем HCIконц..
- Вас взволновало то, что вы сейчас увидели, как густой дым наполнил колбу и начал выливаться на стол?
А представьте, как были взволнованы алхимики, когда имели дело с этим веществом!
Алхимики всегда с изумлением и мистическим ужасом наблюдали образование белого дыма при смешении этих двух газов. Они считали, что в воздухе встречаются два «духа», сражение которых заканчивается пролитием их «крови» – образованием дыма и белого налета на окружающих предметах.
Посредине ливийской пустыни стоял храм, посвященный богу
Амону Ра. В древности арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали «аммониаком», а потом сократили название до «аммиак».
Аммиак NH3 – это самое важное из водородных соединений азота. В чистом виде аммиак впервые был собран в конце XVIII в. англичанином Дж. Пристли. Однако несмотря на то, что ученый смог описать свойства аммиака, ему не удалось определить состав соединения из-за несовершенства существовавших в то время экспериментальных методик. Заслуга в этом принадлежит К. Л. Бертолле. Он разложил аммиак действием электрической искры и получил точные данные о его количественном составе.[1]
Далее проводится беседа о распространении данного вещества в окружающем мире.
Вопросы для обсуждения:
В средние века этот газ называли почему – то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт». [3]
III.Объяснение нового материала.
ЯДОВИТ. [4]
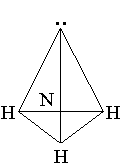
Молекула аммиака NH3 имеет пирамидальное строение. Атом азота N находится в центре незавершенного тетраэдра с тремя атомами водорода Н в вершинах, а к четвертой вершине обращено электронное облако с парой электронов, не участвующих в образовании химических связей.
В подходящих условиях эта «неподеленная» пара электронов может служить для присоединения катиона водорода в реакциях аммиака с кислотами, либо для взаимодействия с водой. [1]
Вот как это происходит.
Формируется учебная проблема.
Ребята приведите примеры веществ, имеющие основный характер.
- Почему аммиак в водном растворе проявляет основные свойства?
(выслушиваются предположения детей)
Аммиак очень хорошо растворим в воде: 1 объем воды растворяет при комнатной температуре около 700 объемом аммиака. И этот процесс – не простое растворение. Аммиак с водой объединяется в слабое основание гидрат аммиака NH3 ● H2O. Это происходит за счет того, что между атомом азота, обладающим неподеленной электронной парой, и атомами водорода молекулы воды возникает так называемая водородная связь. [2]
Что такое водородная связь?
Это дополнительная связь между полярными молекулами, содержащими атом водорода. Если партнеры по химической связи в значительной степени переместили электронное облако к себе, то водород превращается в практически «голый» протон. И этот протон способен сильно притягиваться к богатым электронами электроотрицательным «соседям». Такие партнеры водорода, которые почти полностью лишают его электронного окружения – это элементы кислород, фтор или азот.
Вот почему химики говорят, что в воде, фтороводороде и аммиаке, а также в их водных растворах существует водородная связь.
Правда, водородная связь не очень прочна. Именно поэтому водные растворы аммиака всегда пахнут аммиаком: он постоянно выделяется из них в атмосферу. [1]
Вопрос для обсуждения:
Встречаем ли мы в быту водный раствор аммиака?
(выслушиваются ответы детей)
Водные растворы аммиака – вещь в хозяйстве очень нужная: с их помощью отмывают и отстирывают застарелую грязь, выводят жирные пятна на стекле и фарфоре, приводят в порядок золотые и серебряные ювелирные изделия, а иногда добавляют в жидкость для мытья оконных стекол.
Нашатырный спирт, который продается в аптеках, - это 5-10%-ный раствор аммиака в воде. В технике используется и более крепкий раствор аммиака (его максимальная концентрация составляет 25%). Такой раствор называется аммиачной водой.
Вопрос для обсуждения:
В чем заключается физиологическое действие аммиака?
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — при укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с).
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления. При укусах насекомых — в виде примочек. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Гидрат аммиака NH3 ● H2O в водном растворе, как и полагается слабому основанию, частично диссоциирует с образованием катионов аммония и гидроксид – ионов:
NH3 + H2O ↔ NH3 ● H2O ↔ NH4+ + OH-
В результате среда становится щелочной. Это будет заметно по малиновой окраски индикатора фенолфталеина в растворе нашатырного спирта.
Демонстрация опыта.
Добавить фенолфталеин в раствор нашатырного спирта.
А теперь попробуйте объяснить, почему в средние века этот газ называли «щелочной воздух», а его раствор и поныне называется «нашатырный спирт»?
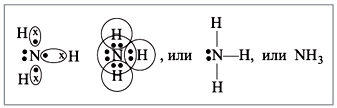
Кроме гидроксид – иона, в реакции диссоциации, которую мы записали, появляется кое-что совсем новое – сложный катион. Это катион аммония NH4+.
Катион аммония NH4+ - частица совершенно симметричная и имеет форму тетраэдра, в центре которого расположен атом азота, а по вершинам четыре атома водорода.
H +
N•• + H+ → N [NH4]+
H H H H H H
ИОН АММОНИЯ
В ходе нашего эксперимента вначале урока мы видели, как появляется «белый дым», который выливался из колбы. Это мельчайшие кристаллики соли NH4CI – хлорида аммония.
Это протекает реакция: NH3 + НCI → NH4CI , или в ином виде
NH3 + Н+ = NH4+
Ничего удивительного, что в результате такого взаимодействия получается новый сложный катион. У молекулы аммиака, как уже было сказано, есть неподеленная пара электронов. А у катиона водорода нет вовсе, зато есть пустая атомная орбиталь, которая ждет не дождется дорогих гостей – чужую пару электронов. Поскольку катион водорода – частица с положительным зарядом, электроны притягивают ее очень крепко. Такой способ образования химической связи, когда один атом предоставляет электронную пару, а второй свободную орбиталь, химики назвали донорно-акцепторным механизмом. Здесь атом азота молекулы аммиака выступает в роли донора, отдающего свои электроны, а катион водорода – в роли акцептора. Его дело предоставить электронам азота удобную «квартиру» - атомную орбиталь. [1]
Вывод:
- атом азота образует с атомами водорода три ковалентных полярные связи (т. к. Э. О. азота больше, чем у водорода) за счет своих трех неспаренных электронов.
- неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно – акцепторному с атомами, имеющими вакантную орбиталь.
(Возникает учебная проблема: какие химические свойства окислительные или восстановительные – проявляет аммиак в химических реакциях?)
В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. В аммиаке азот имеет самую низку степень окисления (-3). Поэтому аммиак обладает только восстановительными свойствами.
![]() С кислотами соли
С кислотами соли
![]() С
водой основание
С
водой основание
Добрый старый аммиак,
Он богач, и он добряк,
Богат неподеленными своими электронами,
Но только, вот беда, ему
В растворе скучно одному.
Он погулять готов всегда:
Там кислота, а тут вода…
Потом, обобранный до нитки,
Он плачет: «Где мои пожитки?
Какое это беззаконие:
Стал катионом я аммония!».
Составляются уравнения реакций по схемам
NH3 + H3PO4 → …
NH3 + H2SO4 → …
NH3 + H2O → …
Все аммонийные соли при нагревании разлагаются либо с выделением аммиака, либо с выделением продуктов его окисления (если кислота – окислитель). Например:
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH3 + NH4H SO4
NH4CI → NH3 +HCI
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O [6]
1.
![]() Аммиак
азот + водород t◦
Аммиак
азот + водород t◦
2NH3 ↔ N2 + 3H2
(без kat) азот + вода
2.
![]() Аммиак + кислород
Аммиак + кислород
(kat) оксид азота (II) + вода
Если пропускать ток NH3 по трубке вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно легко зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется вода и свободный азот.
4NH3 +3O2 → 2N2 + 6H2O
При других условиях (kat - Pt) аммиак может окисляться до оксида азота (II) NO.
3. При замещении в молекулах аммиака только одного атома водорода металлами образуются амиды металлов. Так, пропуская аммиак над расплавленным натрием, можно получить амид натрия NaNH2 в виде бесцветных кристаллов:
2NH3 + 2Na → 2 NaNH2 + H2
4. Аммиак – сильный восстановитель. При нагревании он восстанавливает тяжелые металлы из их оксидов, а сам окисляется до свободного азота:
3CuO + 2NH3 → 3Cu + N2 + 3H2O [2]
IV. Получение аммиака.
а) Демонстрация опыта. Получение аммиака взаимодействием хлорида аммония с гидроксидом кальция.
В фарфоровой ступке тщательно перемешайте 5 мас. ч. хлорида аммония и 8 мас. ч. гидроксида кальция. Поставьте рядом три стакана: в один насыпьте хлорид аммония, во второй – смесь хлорида аммония с гидроксидом кальция, в третий гидроксид кальция. В стаканы на стеклянных палочках повесьте смоченные раствором фенолфталеина полоски фильтровальной бумаги.
Обратите внимание! В первом и третьем стакане полоски остаются без изменения, а во втором полоска остается розовой от выделяющегося аммиака.
В лаборатории аммиак обычно получают, нагревая хлорид аммония NH4CI с гашеной известью Са(ОН)2. Реакция выражается уравнением
2 NH4CI + Ca(OH)2 → CaCI2 + 2H2O + 2 NH3↑
Поскольку этот газ легче воздуха (масса 1 л аммиака при нормальных условиях равна 0,77 г), то его можно собрать в перевернутые вверх дном сосуды.
Эта реакция подтверждает, что нельзя одновременно известковать почву и вносить азотные удобрения, так как азот удобрения улетучиваются в виде аммиака. [7]
б) Основным промышленным способом получения аммиака является его синтез из азота и водорода. Реакция экзотермическая, обратимая и протекает в присутствии катализатора:
kat, t◦, P
N2 + 3H2 ↔ 2NH3 + 46 кДж/моль
V. Закрепление.
Предлагается выполнить тестовое задание.
1-3. Степень окисления азота
1. Увеличивается 2. Уменьшается 3. Одинакова
в наборе соединений
а) NH3, Na3N, NH4CI б) NH3, NO, HNO3
в) KNO2, N2O, NaNO3 г) N2O3, N2, Mg3N2
4-7. В веществе
1. NH3 2. NH3 ● H2O 3. NH4Br 4. N2
присутствуют химические связи
а) ионные б) водородные в) ковалентные полярные г) ковалентные неполярные
8. В лаборатории аммиак получают при нагревании (выберите два правильных ответа)
а) NH4CI б) NH3 ● H2Oконц. в) N2 и H2 (катализатор)
г) (NH4)2SO4 и Ca(OH)2
9. Аммиак реагирует (по отдельности) с набором веществ
а) NH4CI, H2SO4 б) HNO3, Fe(OH)2 в) HCI, Mg(OH)2 г) Н2О, Н2SO4
10. Из 7,3 г хлороводорода и 7,3 аммиака получился продукт массой (в граммах), равной
а) 23 б) 16,8 в) 14,6 г) 10,7
11. Гидрат аммиака диссоциирует в растворе с образованием ионов
а) N3- б) Н+ в) ОН- г) NH4+
12. При образовании связи между молекулой аммиака и катионом водорода атомы азота и водорода по отношению к электронной паре являются
а) азот – донором б) водород – акцептором
в) азот – акцептором г) водород – донором
13. Геометрическая форма катиона аммония – это
а) треугольник б) квадрат в) тетраэдр г) октаэдр
14. Соль аммония можно получить взаимодействием
а) NH3 и H2O б) NH3 и HBr
в) NH3 и Na г) NH3 ● H2O [5]
Закрепить знания о свойствах солей аммония. I. Выполните один из вариантов.
Вариант I
Напишите полные и сокращенные ионные уравнения реакций, происходящих между веществами, формулы которых приведены ниже:
a) NH4C1 и AgNO3; б) (NH4)2CO3 и НС1
Вариант II
Допишите уравнения реакций в полной и сокращенной ионных формах:
а) (NH4)2SO4 + ? ®NH4C1 + BaSO4|;
б) (NH4)2S + H2SO4 ( конц) ®? + ?
Вариант III
Напишите полные и сокращенные ионные уравнения реакций, происходящих между следующими парами веществ: а), соль аммония и другая соль;б) соль аммония и щелочь;
в) соль аммония и кислота.
В завершении урока необходимо остановиться на применении аммиака и его солей в народном хозяйстве. Можно предложить учащимся самостоятельное домашнее задание и составить схему или таблицу. Задание должно обязательно включать установление причинно – следственной зависимости «свойства вещества – применение вещества». В ходе проверки результатов работы появится возможность расширить и обобщить полученные школьниками знания.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.