
Урок химии 9 класс. Тема. Кремний.
Цель. Обеспечить в ходе урока усвоение учащимися знаний о кремнии как ХЭ и простом веществе, а также применение знаний учащимися по характеристике химического элемента по плану.
Ход урока. Организационный момент.
|
Давайте вспомним: 1. Каков состав атома? ( Атом состоит из положительно-заряженного ядра (протоны и нейтроны) и отрицательно заряженных электронов) 2. Какую характеристику можно дать ХЭ на основании его положения в ПСХЭ? (Химический знак, название, порядковый номер, № периода, № группы, относительная атомная масса) |
3. Что такое аллотропия? (Аллотропия – это явление существования ХЭ в виде двух или нескольких простых веществ, различных по строению и свойствам. Эти простые вещества, различны по строению и свойствам, называются аллотропными модификациями.) Приведите примеры.
Тема нашего урока «Кремний». Кремний – это элемент жизни, как сказал академик Вернадский. Кремний, благодаря своим химическим свойствам, создаёт электрически заряженные системы. Они обладают свойством «приклеивать» на себя вирусы, близнетворные микроорганизмы, т.е. под действием электрического притяжения все вирусы нейтрализуются. Отсюда можно сделать вывод, что все болезни возбудителей не смогли бы проявиться в организме человека, если бы люди имели в организме достаточно кремния. Итак, кремний жизненно важный элемент, приступим к его изучению.
Кремний – химический элемент.
1) Положение кремния в ПСХЭ.
1. Химический знак – Si
2. Порядковый номер – 14
3. Атомная масса – 28,086
4. Кремний находится в IV группе, гл. подгруппе, 3 малый период.
2) В природе кремний представлен тремя стабильными изотопами:
28Si (92,28%); 29Si (4,68%); 30Si (3,05%)
3) Рассмотрим строение атома:
1. Число протонов, электронов, нейтронов:
14р+; 14ē; 14 ń0.
2. Электронная формула:
1s2 2s2 2p6 3s2 3p2
3. Электронно-графическая формула:
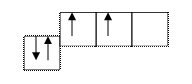
3s 3p
4) Семейство - р-элемент
5) Важнейшие степени окисления: -4; 0; +4.
6) Характер элемента - неметалл
7) Соединения ХЭ
1. Высший оксид - оксид кремния (IV) SiO2
2. Высший гидроксид – кремниевая кислота H2SiO3
3. Летучее водородное соединение – силан SiH4
А теперь мы рассмотрим нахождение кремния в природе.
Кремний – это один из распространенных в земле элементов (25% массы). Главная часть находится в соединениях кремния с кислородом и др. металлами – силикатных породах.
Соединения, в состав которых входит оксид алюминия, называются алюмосиликатами. Таковы белая глина, слюда, полевой шпат. Значительная часть кремния представлена оксидом кремния (IV) – кремнезема. Окрашивание оксида кремния (IV) различными примесями образует драгоценные и полудрагоценные камни, например, изумруд, топаз, аквамарин и др.
Вообще в чистом виде кремний был выделен в 1811 году французским учёным Жозефом Луи Гей–Люссаком и Луи Жаком Тенаром. Название кремний произошло от латинского «silex» - кремень, но в 1834 году русский химик Герман Иванович Гесс ввел другое название – кремний.
Рассмотрим кремний как простое вещество.
1) Химическая формула – Si
2) Молекулярная масса – 28,086
3) Тип хим. связи -ковалентная неполярная
4) Тип структуры кристаллической решётки- атомная
Кремний может находиться в 2х аллотропных модификациях:
Аллотропные модификации
|
Аморфный кремний |
Кристаллический кремний |
|
Представляет собой бурый порошок, с температурой плавления 1420 °С. |
Твёрдое вещество, темно-серого цвета со слабым металлическим блеском, обладает тепло- и электро- проводимостью. |
Наконец мы добрались до химических свойств. Химические свойства кремния мы рассмотрим по следующей схеме:
![]() Ме
Ме
![]()
![]() СВ Si
ПВ
СВ Si
ПВ
![]() неМе
неМе
Проявляет восстановительные свойства:
а) с галогенами:
Si +2F2 = SiF4
Si + 2Cl2 = SiCl4
Si + 2Br2 = SiBr4
б) с кислородом (при t°)
Si + O2 = SiO2
2. Взаимодействует со сложными веществами
а) кислотами:3Si+12HF+4HNO3 = 3SiF4+4NO+8H2O
б) щелочами:Si+2NaOH+H2O = Na2SiO3+2H2
Проявляет окислительные свойства:а) с металлами: Si+2Mg = Mg2Si
Кремний применяется во многих отраслях промышленности:
- при производстве жаропрочных и кислотоупорных сталей – электротехнике - солнечных батареях.
Поговорим о получении кремния. Кремний получают как в промышленности, так и лаборатории.
-в промышленности
В электрических печах при высокой температуре происходит восстановление кремния из его оксида коксом (углём):SiO2+2C = Si+2CO
-в лабораторииВ качестве восстановителей используют магний или алюминий:
SiO2+2Mg = Si+2MgO
3SiO2+4Al = 3Si+2Al2O3
Домашнее задание. Параграф 31, упр.4
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.