
УРОК-презентация
Окислительно – восстановительные реакции
Образовательные задачи.
Закрепить знания учащихся о типах кристаллических решеток; показать причины, обусловливающие специфику химических процессов окисления и восстановления; научить учащихся применять понятия «степень окисления» для составления несложных ранее изученных окислительно – восстановительных реакций.
Оборудование:
Оксид меди (II), уголь, магний, известковая вода, серная кислота (1\5), кинофрагмент «Окислительно – восстановительные реакции».
Урок
начинается с вопроса: по каким признакам вещества нафталин, алмаз, лед, хлорид цезия, карбид кремния можно отнести к веществам с молекулярной, атомной или ионной кристаллическими решетками?
Далее предлагают учащимся выяснить сходства и отличия между ионной и атомной кристаллическими решетками, между атомной и молекулярной кристаллическими решетками .
Затем переходят к применению понятия « степень окисления». Выясняют, в каких случаях химические элементы проявляют положительную, отрицательную и нулевую степень окисления.
Учащиеся выполняют задания:
Определить последовательность действий при составлении уравнений окислительно – восстановительных реакций и объяснить их сущность на примере воздействия натрия с хлором.
2Na0 + Cl20=2Na+Cl-
Восстановитель Окислитель
![]()
![]() Na0-ē→Na+ 2 Процесс
окисления
Na0-ē→Na+ 2 Процесс
окисления
2Cl0+2ē→2Cl- 1 Процесс восстановления
Обращают внимание на изменение степеней окисления в процессе окисления-восстановления.

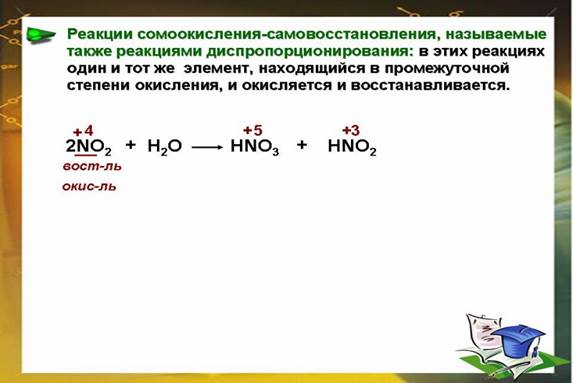
.
Демонстрируют опыт горения магния и реакции оксида магния с водой и серной кислотой. Учащиеся записывают уравнение реакций, определяют степени окисления элементов в веществах. Подчеркивают, что только в уравнении реакции окисления магния произошло изменение степеней окисления. Рассматривают сущность окислительно-восстановительного процесса и результат записывают в обобщающую схему:
2Mg0 + O20=2Mg+2O-2
Восстановитель Окислитель
![]()
![]() Mg0-2ē→Mg+2 2 Процесс окисления
Mg0-2ē→Mg+2 2 Процесс окисления
2O0+2*2ē→2O-2 1 Процесс восстановления
Демонстрируют опыт восстановления меди из оксида меди (II) углеродом и взаимодействие одного из продуктов реакции с известковой водой. Учащиеся самостоятельно разбираются в данных химических процессах, определяют тип химических реакций, объясняют окислительно-восстановительную сущность одного из них.




Памятка по составлению уравнений окислительно-восстановительных реакций:
Результат записывают в обобщенную схему:
2CuO + C = 2Cu + CO2
Окислитель Восстановитель
![]()
![]() C0
-4ē →C+4 1 Процесс
окисления
C0
-4ē →C+4 1 Процесс
окисления
Cu+2+2ē→Cu0 2 Процесс восстановления
Вопрос: почему составляют электронные уравнения? Предполагается ответ: электронные уравнения позволяют определить коэффициенты перед восстановителем, окислителем и продуктами их взаимодейтвия.

Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.