
Публикация является частью публикации:
8 клас 2017р.
Інтегрований урок з хімії та основ здоров'я
Тема. Фізичні й хімічні властивості середніх солей. Здорове харчування. Обмін мінеральних солей.
Мета:
· навчальна:
ü повторити особливості основних класів неорганічних речовин: визначення, класифікацію, властивості;
ü формувати навички використання номенклатури на прикладі складання назв оксидів, кислот, основ, солей та їхніх формул;
ü розширити й систематизувати знання учнів про хімічні властивості неорганічних сполук на прикладі середніх солей;
ü показати значення солей та їх вплив на здоров'я людини;
ü сприяти формуванню в учнів наукового світогляду;
ü формувати навички самоконтролю, вміння критично оцінювати свої знання;
ü ознайомити учнів із солями, які використовуються в медицині;
· розвивальна:
ü розвивати навички спостерігати, робити висновки;
ü вміння застосовувати теоретичні знання на практиці;
ü навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей;
ü увагу та швидкість мислення, культуру мовлення, уміння спостерігати, узагальнювати, робити висновки;
ü пізнавальний інтерес до вивчення предметів з хімії та основ здоров'я;
· виховна:
ü виховувати моральні якості учнів – етичних норм, гуманізму, колективізму, активної позиції в навчанні й житті, почуття товариськості, вимогливості до себе та своїх товаришів, естетичні смаки учнів.
Тип уроку: інтегрований.
Форми роботи: робота в парах (один – удвох – усі разом), самостійна, демонстрація експериментів, творча робота, розповідь учителя.
Обладнання: таблиці «Періодична система хімічних елементів Д.І.Менделєєва», «Таблиця розчинності кислот, основ і солей у воді», «Електрохімічний ряд напруг металів»; роздавальний матеріал;
презентація до уроку «Фізичні й хімічні властивості середніх солей. Здорове харчування. Обмін мінеральних солей», творчий проект учнів «Хімія та здоров'я», ноутбук, інтерактивна дошка, диск із записом демонстраційних відеодослідів.
Очікуванні результати:
після цього уроку учні зможуть:
Ø характеризувати фізичні й хімічні властивості солей;
Ø складати рівняння реакцій на прикладі хімічних властивостей середніх солей;
Ø працювати в малих групах, надавати результати колективної діяльності;
Ø одержувати інформацію з навчальних посібників, електронних носіїв, аналізувати її, давати власну оцінку й аргументувати свою думку.
Структура уроку:
І. Організаційний етап. Створення позитивного емоційного настрою.
Розминка. Логічна вправа «Постав на місце»
ІІ. Актуалізація опорних знань і мотивація навчальної діяльності.
Казка про дружну сім'ю
ІІІ. Повідомлення теми, мети й очікуваних результатів уроку.
ІV. Вивчення нового матеріалу.
Вправа «Калейдоскоп солей»
Фізичні властивості солей
Хімічні властивості солей «Світ подорожей»
Презентація учнями творчого проекту «Хімія та здоров'я»
 V. Узагальнення
знань.
V. Узагальнення
знань.
Вправа «Мікрофон»
Домашнє завдання (диференційоване)
Тестові завдання
VІ. Підбиття підсумків уроку.
Рефлексія
Оцінювання знань учнів
Інтерактивна вправа «Очікування»
Хід уроку:
І. Організаційний етап. Створення позитивного емоційного настрою.
 Розминка
Розминка
Логічна вправа «Постав на місце»
Складіть девіз уроку із розсипаних слів: вчити, добре, знати, хто, все, хоче, того.
(Відповідь: добре того вчити, хто хоче все знати).
ІІ. Актуалізація опорних знань і мотивація навчальної діяльності.
Учитель. Сьогодні в нас не звичайний урок, а інтегрований – хімія + основи здоров'я. Ці науки завжди йдуть разом – доповнюючи одна одну. Ми сподіваємося на плідну роботу та співпрацю.
1. П’ять учнів на картках самостійно опрацьовують завдання.
Скласти формули вказаних солей. Записати їх у табличку
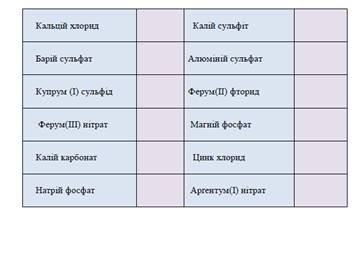
А для всього класу учитель зачитує казку «Про дружну сім'ю». Учні уважно слухають і виписують усі хімічні речовини, які почують у казці, а до дошки виходить один з учнів.
Отже уважно слухаємо…
«Казка про дружну сім'ю»
В одному великому будинку жили брат і сестра. Брата звали хлороводень, а сестру – хлоридна кислота.
Хлороводень мав різкий характер: коли потрапляв під дощ, то складалося враження, що він «димить» від люті. Хлоридна кислота – спокійнішої вдачі, але вона також не любить дощової погоди. З’явилися вони на світ у хімічній лабораторії, завдяки зустрічі простого спокійного хлопця – натрій хлориду й вельможної сульфатної кислоти, яка вступає в реакцію із солями, за такої взаємодії виділяється вуглекислий газ або випадає осад.
Брат і сестра заснували фірму «Дивовижна хімія». Працювали дружно. Хлоридна кислота добувала солі, працювала в галузі медицини й харчової промисловості. Вона мала дуже багато друзів: цинк, купрум(ІІ) оксид, алюміній гідроксид, арґентум нітрат, амоніак, які сподівалися на прихильність із її боку й хотіли б з нею одружитися, але вона не знала, кому ж надати перевагу, бо вони всі досить важливі для неї.
У фірмі працювали досвідчені й відповідальні працівники, які сприяли її процвітанню.
Натрій хлорид – відповідав за виготовлення приправ до їжі, за сировину для одержання їдкого натру, хлору, соляної кислоти, питної соди (хіміки називали її інакше: натрій гідроген карбонат, розчин якої використовують у медицині, для зниження кислотності шлункового соку, для полоскання горла при ангіні), мила й допомагав консервувати харчові продукти. Нестача звичайної кухонної солі в крові людини згубно впливає на її здоров'я.
Калій хлорид – керував цехом, що виготовляв калійні добрива.
Цинк хлорид – просочував деревину, щоб запобігти її руйнуванню.
Барій хлорид – досить суворий інженер. Його цех відповідав за виготовлення отруйних речовин, які застосовують для боротьби зі шкідниками сільського господарства.
Кальцій хлорид – керував цехом медицини.
Арґентум хлорид – був начальником цеху проявки фотографії.
Меркурій(ІІ) хлорид – протравлював насіння, дублив шкіру.
Хлоридна кислота – акціонер фірми «Анатомія людини» і входить до складу шлункового соку людей і тварин. Вона необхідна для процесу травлення.
Брат і сестра стали досить популярними в хімії, біології, медицині.
Їхні батьки можуть ними пишатися, а друзі залишилися друзями.
Ну, а тепер прокласифікуйте ці речовини.
 Оксиди
Оксиди
H2O, СО2, CuO.
Кислоти
HCl, H2SO4.
Основи
Al(OH)3, NaOH.
Солі
NaCl, NaHCO3, KCl, ZnCl2, AgNO3, BaCl2,CaCl2, AgCl, HgCl2, Na2CO3.
Cl2, Zn, NH3 – ці речовини не належать до жодного класу, бо це газоподібні речовини й метал.
Дайте визначення солей.
Солі – це складні речовини, що складаються з атомів металічних елементів і кислотних залишків.
Які з наведених солей є розчинними (кислу сіль не враховуємо)?
NaCl, KCl, ZnCl2, AgNO3, BaCl2,CaCl2, HgCl2, Na2CO3.
Дайте визначення кислот.
Кислоти – це складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
Дайте визначення основ.
Основи – це складні речовини, що складаються з атома металічного елемента і однієї або декількох гідроксильних груп ОH.
Дайте визначення оксидів.
Оксиди – це бінарні сполуки…
Основні оксиди – це …
(Основні (метал)– це оксиди, які реагують із кислотами з утворенням солі та води. Їм відповідають основи)
Кислотні оксиди – це …
(Кислотні (неметал) – це оксиди, які реагують з основами з утворенням солі та води. Їм відповідають кислоти)
ІІІ. Повідомлення теми, мети й результатів уроку.
Учні читають тему, записану на дошці, цілі й очікувані результати уроку.
Тема. Фізичні й хімічні властивості середніх солей. Здорове харчування. Обмін мінеральних солей.

![]()

ІV. Вивчення нового матеріалу.
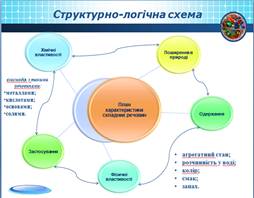 Учитель. Вивчаючи
оксиди, кислоти й основи, ми користувалися планом характеристики складних речовин:
Учитель. Вивчаючи
оксиди, кислоти й основи, ми користувалися планом характеристики складних речовин:
1. Фізичні властивості.
2. Хімічні властивості.
3. Поширення у природі.
4. Практичне значення.
5. Одержання.
Скористаємося цим планом і для вивчення солей.
На екрані структурно-логічна схема «План характеристики складних речовин»
Учитель. Пропоную гру «Калейдоскоп солей»

Із запропонованих частинок складіть формули солей. Називаємо по черзі
«Фізичні властивості солей».
 Висновок. Солі
мають немолекулярну будову, тому всі солі - за звичайних умов – це кристалічні
речовини з високими температурами плавлення. Солі можуть мати різний колір.
Багато солей є безбарвними речовинами, але деякі мають характерний колір.
Висновок. Солі
мають немолекулярну будову, тому всі солі - за звичайних умов – це кристалічні
речовини з високими температурами плавлення. Солі можуть мати різний колір.
Багато солей є безбарвними речовинами, але деякі мають характерний колір.
Наприклад,
калій перманганат – фіолетовий,
натрій хлорид – білий,
аргентум ортофосфат – жовтий,
кальцій карбонат – білий,
ферум(ІІ) сульфат має зелений колір, ферум(ІІІ) хлорид – коричнево-червоний, а калій хромат – яскраво-жовтий.
 Розчинність їх у
воді різна. Можна скористатися таблицею розчинності, якою ви вже умієте
користуватися і знаєте, що вона розташована у підручнику на стор.206
Розчинність їх у
воді різна. Можна скористатися таблицею розчинності, якою ви вже умієте
користуватися і знаєте, що вона розташована у підручнику на стор.206
Частина солей розчиняється у воді, деякі є малорозчинними, а інші – нерозчинні
Робота з підручником стор. 50-51 «Фізичні властивості солей»
Хімічні властивості солей «Світ подорожей»
Подорож - це завжди захоплююча подія,це нові знання,нові враження. Чи готові ви до цього?
І так країна «Солі» межує і встановила економічні стосунки з країнами «Оксиди», «Основи», «Кислоти», «Метали». Пропоную розпочати подорож.
Спробуємо
прогнозувати властивості солей. 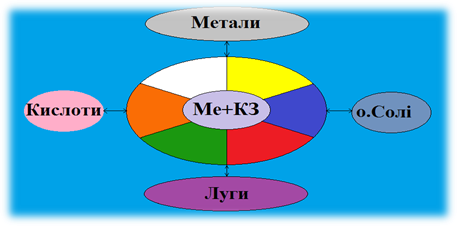
Проблемне питання
Солі взаємодіють з кислотами, основами, солями.
Учитель. Чи завжди можливі ці реакції? (Ні)
(Відповідь. Щоби відповісти на це питання, згадайте, у яких випадках реакція перебігає необоротно:
· якщо утворюється нерозчинна речовина;
· якщо виділяється газоподібна речовина;
· якщо утворюється вода.)
- Які стосунки у країни «Солі» з країною «Метали»?
- Що відбувається з солями при нагріванні?

Відповіді на ці проблемні питання ви зможете дати, коли ми переглянемо відеодосліди «Хімічні властивості середніх солей». (Робота в зошитах). Метою подорожі є дослідження і вивчення хімічних властивостей солей засобами хімічного експерименту, вміння його теоретично обґрунтувати, зробити висновки і узагальнення.
Демонстрація хімічних властивостей солей.
І. Взаємодія з металами.
Якщо сіль розчинна у воді, то атом металічного елемента в ній може бути витиснутий атомом більш активного елемента.
Якщо занурити в розчин купрум(ІІ) сульфату залізну пластинку, через якийсь час на ній виділиться мідь у вигляді червоного нальоту (учитель демонструє дослід):
Запишемо рівняння реакції
СuSО4 + Fe = FeSO4 + Сu↓
Залізо розташоване в ряду активності лівіше за мідь, тому атоми Феруму можуть витиснути атоми Купруму із солі. Але якщо в розчин купрум(ІІ) сульфату занурити срібну пластинку, то ніякої реакції відбуватися не буде:
![]() СuSО4 + Ag =
СuSО4 + Ag =
Висновок: Не всі метали реагують із солями, а лише ті, які у витискувальному ряду розташовані лівіше від того металу, який входить до складу солі. У водному розчині відбувається реакція заміщення: активніший метал витісняє менш активний з розчину його солі, внаслідок утворюється нова сіль і новий метал.
Пам'ятайте! Для таких реакцій не можна брати дуже активні метали: Lі,Na,К, Са, Ва, які реагують за звичайних умов з водою.
II. Взаємодія з лугами.
Наступна країна, яка встановлює економічні зв'язки з країною «Солі» - це луги. Ці реакції ми розглядали, вивчаючи властивості лугів.
Учитель демонструє взаємодію розчину купрум(ІІ) сульфату з розчином натрій гідроксиду.
СuSО4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
Яка речовина при цьому утворилася? (Нерозчинна основа)
Випав синій осад купрум(ІІ) гідроксиду.
Висновок: Розчинні солі здатні взаємодіяти з розчинними основами – лугами (сильні основи). Між ними відбувається реакція обміну, отже в продуктах реакції також будуть сіль та основа. Щоб взаємодія між сіллю та лугом відбулась, один із продуктів повинен випадати в осад (розчинність речовин можна з’ясувати за допомогою таблиці «Розчинність солей, кислот, основ у воді»).
Пам'ятайте! Реактиви необхідно підбирати так, щоб в результаті реакції випав осад, тоді реакції проходять до кінця.
ІІІ. Взаємодія з кислотами.
Встановлюємо економічні зв’язки з країною «Кислоти».
У реакцію із солями можуть вступати також кислоти. Причому солі можуть взаємодіяти як розчинні, так і нерозчинні у воді. Між ними також відбувається реакція обміну, отже в продуктах реакції будуть сіль та кислота.
Реакції між сіллю та кислотою відбуваються у декількох випадках: а) сіль, що утворилася, випадає в осад (до цього випадку також можна віднести утворення нерозчинної силікатної кислоти); б) кислота, що утворюється, є леткою (сульфідна кислота) або нестійкою і розкладається в момент утворення (карбонатна або сульфітна кислота).
Учитель демонструє взаємодію розчину барій хлориду з сульфатною кислотою. Випадає білий осад барій сульфату.
Учитель демонструє взаємодію кальцій карбонату (вапняк, крейда, мармур) з хлоридною кислотою. Рідина ніби закипає: карбонатна кислота, що утворюється, моментально розкладається і виділяється багато вуглекислого газу.
а) ВаС12 + Н2SO4 = ВаSO4↓+2НС1
б) СаСОз + 2НС1 = СаС12 + СO2 ↑+ Н2O
IV.Взаємодія з солями.
Слідуюча зупинка « Солі». Чи можлива взаємодія солей з солями?
ВаС12 + Nа2SO4 = ВаSO4↓+2NaCl
- До якого типу належить ця реакція?
- Що утворюється в результаті даної реакції?
- Чи завжди можливі реакції між солями?
Висновок: Реакції між солями відбуваються лише в тому випадку, коли в результаті реакції утворюється осад.
V. Термічний розклад солей.
(NH4)2Cr2O7 = N2+4 H2O+Cr2O3 ( «Хімічний вулкан»)
Учитель. Скажіть, будь ласка, чи не змогли би ви прокоментувати такий підвищений інтерес до класу «Солі». Чим викликана необхідність вивчати склад, назви, а тепер ще й бажання вивчити фізичні та хімічні властивості солей, значення солей та їх вплив на здоров'я людини?
Такий інтерес до класу солей, викликаний широким застосуванням солей в народному господарстві, в побуті, в медицині тощо. В народі говорять «Служіння проблемам практики - мета науки». Група учнів із вашого класу працювала над проектом «Хімія та здоров'я» з теми «Здорове харчування. Обмін мінеральних солей».
Здорове харчування. Обмін мінеральних солей
 Мінеральні солі
потрібні нашому організму так само, як і білки, вуглеводи, жири та вода. Майже
вся періодична система Менделєєва представлена в клітинах нашого організму,
проте роль і значення деяких елементів в обміні речовин досі ще повністю не
вивчені. Що стосується мінеральних солей і води, то відомо, що вони є важливими
учасниками процесу обміну речовин у клітині. Вони входять до складу клітини,
без них порушується обмін речовин. І тому що в нашому організмі немає великих
запасів солей, необхідно забезпечити їх регулярне надходження. У цьому нам
допомагають і харчові продукти, що містять великий набір мінеральних речовин.
Мінеральні солі
потрібні нашому організму так само, як і білки, вуглеводи, жири та вода. Майже
вся періодична система Менделєєва представлена в клітинах нашого організму,
проте роль і значення деяких елементів в обміні речовин досі ще повністю не
вивчені. Що стосується мінеральних солей і води, то відомо, що вони є важливими
учасниками процесу обміну речовин у клітині. Вони входять до складу клітини,
без них порушується обмін речовин. І тому що в нашому організмі немає великих
запасів солей, необхідно забезпечити їх регулярне надходження. У цьому нам
допомагають і харчові продукти, що містять великий набір мінеральних речовин.
Захист проекту «Хімія та здоров'я»
V. Поурочний контроль.
Вправа «Мікрофон». Учні по черзі формулюють висновки:
- Солі належать до поширених у природі складних неорганічних речовин, серед яких найбільше хлоридів, силікатів, карбонатів, сульфатів, ортофосфатів.
- Частина солей використовується відразу після видобутку, а частина піддається хімічній переробці з метою добування нових речовин.
- Солі знаходять найрізноманітніше застосування у хімічній промисловості та багатьох інших галузях народного господарства, а також у побуті.
- Україна багата покладами солей.
Домашнє завдання.
Вивчити §19-20. Хімічні шашки (диференційоване завдання). Правила гри такі ж, як і в звичайних шашках, але на шашках написані формули простих і складних речовин. Перед тим, як зробити відповідний хід, необхідно записати рівняння можливих хімічних реакцій між речовинами, які написані на шашках.
Середній рівень. Написати 4,5,6 рівнянь хімічних реакцій з утворенням любих класів неорганічних сполук.
Достатній і високий рівень. Написати від 7 до 12 рівнянь хімічних реакцій. Обов'язкова умова: в результаті реакції утворюється сіль.
КОН, Н2O, СO2, O2, К, Nа2O, Мg, ZпО, СаО, S, Н2, Н2S04, ВаС12, НС1, Са, Н3РO4, N2, Р2O5, Са(OН)2, К2O, HNO3,СuO, МgO, А12O3
Виконання тестових завдань. (Самоперевірка, самоконтроль).
1. Виберіть формулу солі:
А. СаСО3; Б. НСL; В. SO3; Г. ВаО.
2. Вкажіть назву солі, що відповідає формулі МgSO4:
А. Магній сульфіт; Б. магній хлорид; В. магній сульфат; Г. магній сульфід.
3. Виберіть формулу солі, що відповідає назві Натрій хлорид:
А. NаСL; Б. КСL; В. HCL; Г. NaF.
4. Виберіть формулу розчинної солі:
А. СаСО3; Б. КСL; В. СuS; Г. ВаСО3
5. Виберіть формулу нерозчинної солі:
А. СаСО3; Б.КСL; В.СuSО4; Г.ВаСL2
6. Виберіть солі сульфати:
А.СаСО3; Б. К2SO4; В.СuS; Г.NaNO3
7. Установіть відповідність між формулами речовин та класом сполук:
А.СаСО3; 1. Оксиди
Б.НСL; 2. Кислоти
В.СuО; 3. Солі
8. Установіть відповідність між формулами речовин та їх назвами
А.СuСО3; 1. Калій хлорид
Б.KСL; 2. Алюміній сульфід
В.AL2S3; 3. Купрум (ІІ) карбонат
Г.ВаСL2 4. Барій хлорид
5. Алюміній сульфат.
VІ. Підбиття підсумків уроку.
Рефлексія
Пропоную невеликий відпочинок. Вам доводилося читати книги різними мовами. Хімічна мова – це мова хімічних формул і символів. Тому я даю вам жартівливе завдання: перекласти рідною мовою такі вирази:
1. Не все те Аурум, що блищить. (Не все те золото, що блищить)
2. Ферумний характер. (Залізний характер)
3. За купрумний гріш подавився. (За мідний гріш подавився)
4. Перший день гість – Аурум, другий – Аргентум, а третій – Купрум, бери сумку та їдь. (Перший день гість – золото, другий – срібло, а третій – мідь, бери сумку та їдь)
5. Білий як кальцій карбонат. (Білий як крейда)
6. Слово – Аргентум, а мовчання – Аурум. (Слово – срібло, а мовчання - золото)
7. Щоби друга пізнати, потрібно з ним пуд натрій хлориду з’їсти. (Щоби друга пізнати, потрібно з ним пуд солі з’їсти)
Оцінювання знань учнів
Інтерактивна вправа «Очікування»
Підводиться підсумок стосовно того, чи реалізувалися бажання учнів вивчити чи почути щось нове на уроці,чи виправдались їх сподівання, чи комфортно почували себе під час роботи на уроці.
Вчитель: «Дякую всім учасникам інтегрованого уроку. Ви всі були активними мандрівниками і компетентними дослідниками, толерантними співбесідниками. Сподіваюся, що знання, вміння, отримані сьогодні, знадобляться вам в житті. І на завершення хочу звернутися до вас словами російського письменника М. Горького: «…якомога уважніше вивчайте хімію, хімію! Це дивна наука, знайте!...ЇЇ пронизливий сміливий погляд проникає й у пітьму земної кори, і в невідомі частинки вашого серця, і в таємниці будови каменю, і в безмовне життя дерев. Вона дивиться всюди і, скрізь відкриваючи гармонію, завзято шукає початок життя». То ж успіхів вам у вивченні цієї чарівної та дивовижної науки!
«Слідство ведуть хіміки»
Після уведення у комп’ютер результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити варіанти, якщо частина інформації збереглася.
… + Рb(NO3)2 = А1(NO3)3+ … ↓
Zn + …. = Zn(NO3)2 + Рb↓
А1 + СuSО4 = … + Сu↓
FеС12+Сu =
АlСІ3 + 3NaОН = А1(ОН)3↓+ 3NаСl
К2SO4 + Ва(ОН)2 = … + … ↓
Са3(РO4)2 + … = СаSO4↓+ …
… = K 2MnO4 +MnO2+ O2
CaCO3 = … + …
Відповідь:
2А1 + 3Рb(NO3)2 = 2А1(NO3)3+ 3Рb↓
Zn + Рb(NO3)2= Zn(NO3)2 + Рb↓
2А1 + 3СuSО4 = А12(SO4)3 + 3Сu↓
![]() FеС12+Сu =
FеС12+Сu =
АlСІ3 + 3NaОН = А1(ОН)3↓+ 3NаСl
К2SO4 + Ва(ОН)2 = 2КОН + ВаSO4↓
Са3(РO4)2 + 3Н2SO4 =3 СаSO4↓+ 2Н3РO4
2KMnO4= K 2MnO4 +MnO2+ O2
CaCO3=CaO+CO2
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.