
Дата: ______________
|
8 -39 |
Водород – простое вещество. |
|
ТЕМА |
|
|
ЦЕЛЬ |
Знать распространение водорода в природе и получение, уметь записывать химические уравнения получения водорода |
|
СОДЕРЖАНИЕ |
Распространение, получение водорода |
|
ТЕРМИНЫ |
Гремучий газ |
|
ОБОРУДОВАНИЕ |
Таблица Д.И.Менделеева |
|
ДОМ ЗАДАНИЕ |
§30 пересказ №10-№11 стр.84 |
ПЛАН УРОКА.
Опрос домашнего задания
Водород – 1-й элемент Периодической таблицы (заряд ядра 1), химический знак – Н, относительная атомная масса (атомный вес) 1,008 (округленно 1). Валентность водорода в соединениях равна единице, наиболее распространенная степень окисления +1. Молекула водорода Н2, молекулярная масса (молекулярный вес) 2,016 (округленно 2 а.е.м). Молярная масса 2 г/моль.
Если кислород является самым распространенным элементом в земной коре, то водород – самый распространенный элемент во Вселенной. Водород составляет около 70 % массы Солнца и звезд. Поскольку водород – наиболее легкий из всех элементов, то такая внушительная масса требует огромного количества атомов этого элемента. Из каждых 100 атомов, встречающихся во Вселенной, 90 – атомы водорода.
Вероятно, когда-то водород входил и в атмосферу Земли. Но из-за своей легкости он способен покидать атмосферу, поэтому доля водорода в воздухе ничтожно мала. В связанном виде водород составляет 0,76 % массы Земли. Наиболее важным соединением водорода, встречающимся в природе, является вода.
В земных условиях водород встречается преимущественно в связанном состоянии. Многие его соединения нам уже известны: Н2О, HCl, HF и т.д. В этих соединениях водород имеет степень окисления +1, поскольку его электроотрицательность (2,1) меньше, чем электроотрицательность кислорода (3,5), хлора (3,16) и фтора (4,0).
Когда водород уже находится в степени окисления +1, он может отбирать электрон у многих элементов – особенно металлов, которые склонны отдавать электроны. Поэтому способы получения водорода часто основаны на реакции какого-либо металла с одним из соединений водорода, например:
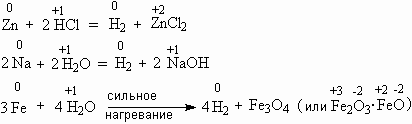 < center>
< center>
Реакцию между цинком и водным раствором хлористого водорода (соляной кислотой) наиболее часто используют для получения водорода в лаборатории.
А реакция между железом и водяным паром при нагревании имеет историческое значение – когда-то её использовали для наполнения водородом воздушных шаров. Интересные подробности об этом вы можете узнать из трактата начала XIX века, который называется "О разложении воды в весьма огромном снаряде посредством раскаленного железа. Сочинение Якова Захарова".
** Вместо цинка в реакции с HCl можно использовать другие металлы (хотя и не любые) – например, железо, олово, магний. Поэтому получающийся при этом легкий газ когда-то называли "горючим воздухом из металлов". Упоминание о таком "воздухе" есть в сочинениях знаменитого алхимика Иоганна Парацельса, жившего в XVI веке.
Англичанин Роберт Бойль, наблюдавший выделение газа при растворении железных опилок в соляной кислоте, дал ему в 1671 году еще более поэтичное название – летучая сера Марса. "Летучей серой" Бойль назвал этот газ потому, что наблюдал его горение, а "серой Марса" – потому, что считал его выходящим из железа, символом которого был Марс – бог войны.
Вероятно, многие исследователи еще до XVIII века имели дело с этим элементом, но просто не догадывались о том, что полученный ими газ имеет какое-то отношение к воде. Первым это выяснил английский физик и химик Г. Кавендиш, который в 1766 году всесторонне исследовал "горючий воздух" и убедился в том, что это вовсе не воздух, а совершенно особый газ.
Кавендиш взвесил этот газ, что потребовало большого искусства и определил – во сколько раз он легче воздуха. Именно Кавендиш, сжигая полученный газ в кислороде, нашел объемы, в которых эти газы реагируют между собой и доказал, что в результате такого сжигания получается вода.
Современное имя водороду дал знаменитый французский химик Лавуазье, придумав латинское название "hydrogen" из слов "hydro" (вода) и "genes" (рождающий).
Движущей силой подобных реакций получения водорода является не только стремление металлов отдать электрон атому Н в степени окисления +1, но и большой энергетический выигрыш при связывании образующихся при этом нейтральных атомов водорода в молекулу Н2. Поэтому в реакции такого типа вступают даже неметаллы:
![]() <
center>
<
center>
Эта реакция – промышленный процесс. Водяной пар пропускают над раскаленным добела коксом (углем, нагреваемым без доступа воздуха). В результате получается смесь оксида углерода с водородом, которую называют "водяным газом".
Водород может получаться и при сильном нагревании метана:
![]() <
center>
<
center>
Поэтому в промышленности большое количество водорода получают именно из метана, добавляя к нему при высокой температуре перегретый водяной пар:
1) CH4 + H2O = CO + 3 H2
2) CO + H2O = CO2 + H2
В сумме этот процесс можно записать уравнением:
CH4 + 2 H2O = 4 H2 + CO2
Смесь газов охлаждают и промывают водой под давлением. При этом СО2 растворяется, а малорастворимый в воде водород идет на промышленные нужды.
Наиболее чистый водород в промышленности получают электролизом воды:
![]()
** При электролизе атом водорода Н (+1) принимает 1 электрон с отрицательного электрода, превращаясь в водород со степенью окисления (0), а атом кислорода О (-2) отдает 2 электрона положительно заряженному электроду, также превращаясь в атомарный кислород. Атомов водорода в 2 раза больше, поэтому электронный баланс обеспечен.
Этот способ требует больших затрат энергии, поэтому распространен меньше, чем высокотемпературная реакция кокса или метана с водой. Существуют и другие способы получения водорода.
Задачи.
7.2. Сколько граммов цинка нужно взять для реакции с соляной кислотой HСl, чтобы получить 1,12 л водорода при нормальных условиях?
7.3. Между собой прореагировали 23 г Na и 1018 мл воды. Сколько граммов NaOH растворено в 1л полученного раствора? Сколько литров водорода (при н.у.) выделилось?
7.4. Сколько литров водорода (при н.у.) теоретически можно получить в реакции 448 л метана CH4 с перегретым паром? Какой объем занимал водород сразу после окончания реакции при давлении 1 атм и температуре 1000 оС?
7.5. В сосуд с водой поместили электроды и некоторое время пропускали постоянный электрический ток. Масса сосуда уменьшилась на 360 г. Сколько литров водорода (при н.у.) было получено в процессе электролиза?
Для закрепления материала выполнить задания по рабочей тетради
Домашнее задание: §30 пересказ №10-№11 стр.84
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.