Данные материалы предназначены для диагностики предметных образовательных результатов по теме "Основания". уникальность материалов состоит в том, что в них представлены программные требования к освоению предметных результатов, примеры выполнения заданий и задания для самостоятельной работы. материалы можно использовать при подготовке к ЕГЭ.
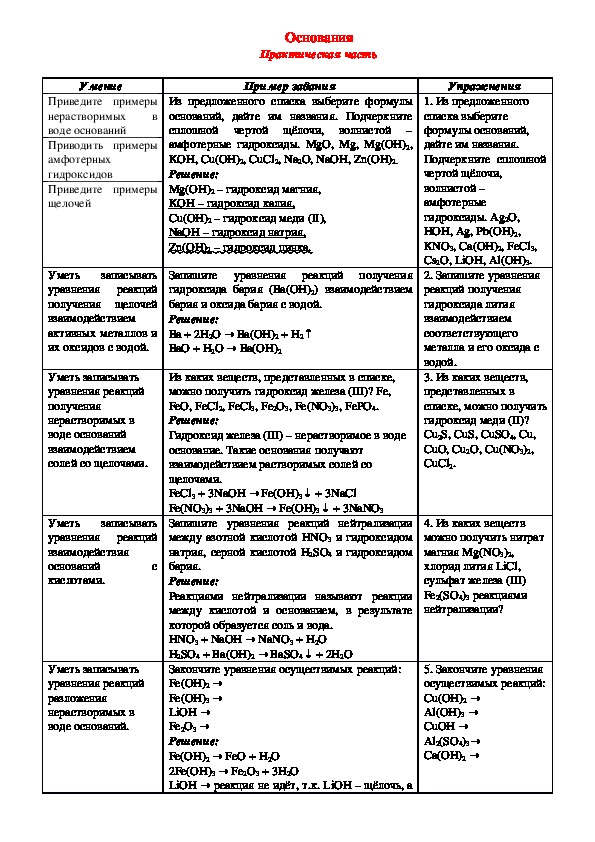
Умение
Приведите примеры
нерастворимых
в
воде оснований
Приводить примеры
амфотерных
гидроксидов
Приведите примеры
щелочей
записывать
Уметь
уравнения реакций
получения щелочей
взаимодействием
активных металлов и
их оксидов с водой.
Уметь записывать
уравнения реакций
получения
нерастворимых в
воде оснований
взаимодействием
солей со щелочами.
записывать
Уметь
уравнения реакций
взаимодействия
оснований
кислотами.
с
Уметь записывать
уравнения реакций
разложения
нерастворимых в
воде оснований.
Основания
Практическая часть
Пример задания
Из предложенного списка выберите формулы
оснований, дайте им названия. Подчеркните
сплошной чертой щёлочи, волнистой –
амфотерные гидроксиды. MgO, Mg, Mg(OH)2,
KOH, Cu(OH)2, CuCl2, Na2O, NaOH, Zn(OH)2.
Решение:
Mg(OH)2 – гидроксид магния,
KOH
Cu(OH)2 – гидроксид меди (II),
NaOH
( OH
Zn
– гидроксид натрия,
)2 – гидроксид цинка.
– гидроксид калия,
Запишите уравнения реакций получения
гидроксида бария (Ва(ОН)2) взаимодействием
бария и оксида бария с водой.
Решение:
→
Ва + 2Н2О
Ва(ОН)
→
ВаО + Н2О
Ва(ОН)
2 + Н2↑
2
+ 3NaNO
3
Fe(OH)
→
+ 3NaCl
↓
3
↓
Fe(OH)
Из каких веществ, представленных в списке,
можно получить гидроксид железа (III)? Fe,
FeO, FeCl2, FeCl3, Fe2O3, Fe(NO3)3, FePO4.
Решение:
Гидроксид железа (III) – нерастворимое в воде
основание. Такие основания получают
взаимодействием растворимых солей со
щелочами.
→
FeCl3 + 3NaOH
Fe(NO3)3 + 3NaOH
Запишите уравнения реакций нейтрализации
между азотной кислотой HNO3 и гидроксидом
натрия, серной кислотой H2SO4 и гидроксидом
бария.
Решение:
Реакциями нейтрализации называют реакции
между кислотой и основанием, в результате
которой образуется соль и вода.
→
HNO3 + NaOH
3 + H2O
H2SO4 + Ba(OH)2
Закончите уравнения осуществимых реакций:
Fe(OH)2 →
Fe(OH)3 →
LiOH →
Fe2O3 →
Решение:
→
FeO + H
Fe(OH)2
Fe→ 2O3 + 3H2O
2Fe(OH)3
→
реакция не идёт, т.к.
LiOH
LiOH – щёлочь, а
NaNO
→
BaSO
2O
3
+ 2H↓
4
2O
Упражнения
1. Из предложенного
списка выберите
формулы оснований,
дайте им названия.
Подчеркните сплошной
чертой щёлочи,
волнистой –
амфотерные
гидроксиды. Аg2O,
НОН, Аg, Pb(OH)2,
KNO3, Ca(OH)2, FeCl3,
Cs2O, LiOH, Al(OH)3.
2. Запишите уравнения
реакций получения
гидроксида лития
взаимодействием
соответствующего
металла и его оксида с
водой.
3. Из каких веществ,
представленных в
списке, можно получить
гидроксид меди (II)?
Cu2S, CuS, CuSO4, Cu,
CuO, Cu2O, Cu(NO3)2,
CuCl2.
4. Из каких веществ
можно получить нитрат
магния Mg(NO3)2,
хлорид лития LiCl,
сульфат железа (III)
Fe2(SO4)3 реакциями
нейтрализации?
5. Закончите уравнения
осуществимых реакций:
Cu(OH)2 →
Al(OH)3 →
CuOH →
Al2(SO4)3→
Ca(OH)2 →Уметь записывать
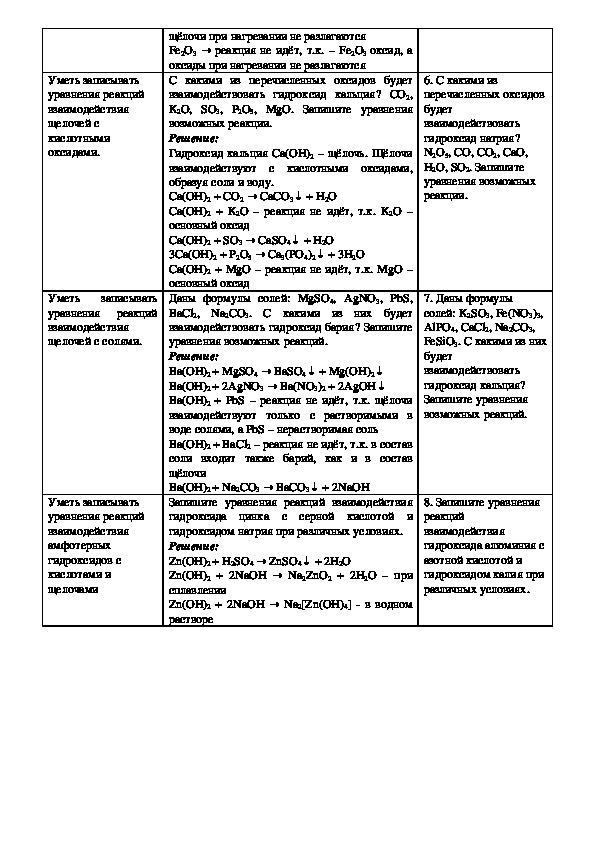
уравнения реакций
взаимодействия
щелочей с
кислотными
оксидами.
Уметь
записывать
уравнения реакций
взаимодействия
щелочей с солями.
Уметь записывать
уравнения реакций
взаимодействия
амфотерных
гидроксидов с
кислотами и
щелочами
→
→
СаСО
3
+ Н↓
2О
реакция не идёт, т.к. –
Fe2O3 оксид, а
→ CaSO4
+ Н↓
→ Ca3(PO4)2
2О
+ 3Н↓
щёлочи при нагревании не разлагаются
Fe2O3
оксиды при нагревании не разлагаются
С какими из перечисленных оксидов будет
взаимодействовать гидроксид кальция? CO2,
K2O, SO3, P2O5, MgO. Запишите уравнения
возможных реакции.
Решение:
Гидроксид кальция Са(ОН)2 – щёлочь. Щёлочи
взаимодействуют с кислотными оксидами,
образуя соли и воду.
Са(ОН)2 + СО2
Са(ОН)2 + K2O – реакция не идёт, т.к. K2O –
основный оксид
Са(ОН)2 + SO3
3Са(ОН)2 + P2O5
Са(ОН)2 + MgO – реакция не идёт, т.к. MgO –
основный оксид
Даны формулы солей: MgSO4, AgNO3, PbS,
BaCl2,
Na2CO3. С какими из них будет
взаимодействовать гидроксид бария? Запишите
уравнения возможных реакций.
Решение:
Ba(OH)2 + MgSO4
Ba(OH)2 + 2AgNO3
Ba(OH)2 + PbS – реакция не идёт, т.к. щёлочи
взаимодействуют только с растворимыми в
воде солями, а PbS – нерастворимая соль
Ba(OH)2 + BaCl2 – реакция не идёт, т.к. в состав
соли входит также барий, как и в состав
щёлочи
Ba(OH)2 + Na2CO3
Запишите уравнения реакций взаимодействия
гидроксида цинка с серной кислотой и
гидроксидом натрия при различных условиях.
Решение:
→
Zn(OH)2 + H2SO4
Zn(OH)2 + 2NaOH
сплавлении
Zn(OH)2 + 2NaOH
растворе
ZnSO
Na→ 2ZnO2 + 2H2O – при
+ ↓ Mg(OH)2↓
3)2 + 2AgOH↓
→ Na2[Zn(OH)4] в водном
→ BaSO4
→
Ba(NO
+ 2NaOH
+ 2H↓
4
BaCO
3
2O
2О
→
↓
6. С какими из
перечисленных оксидов
будет
взаимодействовать
гидроксид натрия?
N2O5, CO, CO2, CaO,
H2O, SO2. Запишите
уравнения возможных
реакции.
7. Даны формулы
солей: K2SO3, Fe(NO3)3,
AlPO4, CaCl2, Na2CO3,
FeSiO3. С какими из них
будет
взаимодействовать
гидроксид кальция?
Запишите уравнения
возможных реакций.
8. Запишите уравнения
реакций
взаимодействия
гидроксида алюминия с
азотной кислотой и
гидроксидом калия при
различных условиях.