
Алкены. Этилен
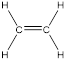
Алкены (олефины, этиленовые углеводороды) – углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
Первый член ряда – этилен (этен) C2H4:
Номенклатура алкенов
Двойную связь обозначают с помощью суффикса -ен.
Основная цепь должна включать кратную связь. Нумерация цепи проводится с того
конца, к которому ближе двойная связь: CH3-CH2-CH2-CH=CH-CH3 - гексен-2 (гексен-4); ![]() - 2-этилпентен-1
- 2-этилпентен-1
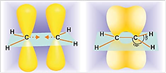 Строение алкенов
Строение алкенов
Рис. 1. Строение этилена
Атомы углерода при двойной связи находятся в состоянии sp2-гибридизации. Двойная связь состоит из σ-связи, образованной sp2-гибридными орбиталями, и π-связи, возникающей за счет перекрывания p-орбиталей. Три σ-связи атома углерода направлены к вершинам треугольника с атомом С в центре, угол между связями 120о (рис. 1).
Молекула этилена плоская, а электронная плотность π-связи расположена над и под этой плоскостью (рис. 2). В других алкенах плоским является фрагмент, который непосредственно примыкает к двойной связи (рис. 3). В углеродных соединениях π-связь значительно слабее, чем σ-связь. Под воздействием реагентов π-связь легко разрывается. Шаростержневые модели молекул этена и пропена отражают их пространственное строение.
|
|
|
|
Рис. 2. Модель молекулы пропена |
Рис. 3. Модель молекулы этена |
Изомерия алкенов
1. Изомерия углеродного скелета.
|
|
|
|
бутен-1 |
2-метилпропен |
2. Изомерия положения двойной связи.
|
|
|
|
бутен-1 |
бутен-2 |
3. Межклассовая изомерия (с циклоалканами).
|
|
|
|
циклобутан |
метилциклопропан |
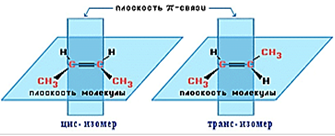 4. Геометрическая изомерия.
4. Геометрическая изомерия.
Вращения вокруг двойной связи не происходит, ведь для этого нужно разорвать π-связь. Из-за этого у алкенов существует изомерия, связанная с тем, что заместители могут располагаться по одну или по разные стороны двойной связи, как, например, у бутена-2 (рис. 4).
Для бутена-1 геометрическая изомерия невозможна (у одного из атомов С при двойной связи оба заместителя одинаковы: 2 атома водорода).
Рис. 4. Геометрические изомеры бутена-
Физические свойства и нахождение в природе алкенов
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Алкены бесцветны, нерастворимы в воде и легче ее, обладают характерным резким запахом.
Это интересно: Этилен образуется в фруктах, регулируя процесс их созревания. К классу алкенов принадлежат феромоны некоторых насекомых.
Структура этилена и его гомологов
Этилен (C2H4) – это простой алкен, состоящий из двух атомов углерода и четырех атомов водорода. У этилена есть две связи между атомами углерода – одна сигма-связь и одна пи-связь. Сигма-связь образуется из перекрытия орбиталей s и p, а пи-связь образуется из перекрытия двух орбиталей p.
Гомологи этилена – это алкены, которые имеют аналогичную структуру, но с различным числом атомов углерода. Например, пропилен (C3H6) – это гомолог этилена, в котором есть три атома углерода и шесть атомов водорода.
Другие гомологи этилена включают бутен (C4H8), пентен (C5H10), гексен (C6H12) и так далее. Каждый гомолог имеет одну двойную связь между атомами углерода и соответствующее число атомов водорода.
Физические свойства этилена и его гомологов определяются их молекулярной структурой и межмолекулярными взаимодействиями:
1. Точка кипения и плавления. У этилена и его гомологов точка кипения и плавления зависят от их молекулярной массы и межмолекулярных сил притяжения. Обычно, с увеличением числа атомов углерода в молекуле, точка кипения и плавления также увеличиваются. Например, этилен (C2H4) имеет точку кипения -103,7 °C, а бутен (C4H8) имеет точку кипения -6,3 °C.
2. Плотность этилена и его гомологов также зависит от их молекулярной массы. Обычно, с увеличением числа атомов углерода в молекуле, плотность также увеличивается. Например, плотность этилена составляет около 0,97 г/см³, а плотность бутена составляет около 0,66 г/см³.
3. Растворимость. Этилен и его гомологи обладают низкой растворимостью в воде, так как их молекулы не образуют водородных связей с молекулами воды. Однако, они хорошо растворяются в неполярных растворителях, таких как бензол или гексан.
4. Газовая форма. Этилен и его гомологи обычно находятся в газообразном состоянии при комнатной температуре и давлении. Они обладают хорошей летучестью и могут быть использованы в качестве газовых топлив или промышленных сырьевых материалов.
Химические свойства этилена и его гомологов
1. Полимеризация. Этилен и его гомологи обладают способностью к полимеризации, то есть образованию полимеров. Полимеризация этилена приводит к образованию полиэтилена, который является одним из наиболее распространенных пластиков. Полиэтилен обладает высокой прочностью, гибкостью и химической стойкостью, что делает его идеальным материалом для производства пластиковых изделий, упаковки и труб.
2. Гидрирование. Этилен и его гомологи могут быть гидрированы, то есть добавлению молекулы водорода. Гидрирование этилена приводит к образованию этилена гликоля, который широко используется в производстве пластиков, растворителей и косметических продуктов.
3. Галогенирование. Этилен и его гомологи могут быть галогенированы, то есть добавлению атомов галогенов (хлора, брома, йода) к двойной связи. Галогенирование этилена приводит к образованию галогенэтанов, которые могут использоваться в качестве растворителей, анестетиков и промышленных химических реагентов.
4. Окисление. Этилен и его гомологи могут быть окислены, то есть добавлению кислорода. Окисление этилена приводит к образованию этиленоксида, который используется в производстве этиленгликоля, растворителей и пластиков.
5. Аддиционные реакции. Этилен и его гомологи могут участвовать в аддиционных реакциях, то есть образованию новых химических связей с другими молекулами. Например, этилен может аддироваться к молекуле брома, образуя 1,2-дибромэтан. Аддиционные реакции этилена и его гомологов широко используются в органическом синтезе для получения различных химических соединений.
Применение этилена и его гомологов
Этилен и его гомологи имеют широкое применение в различных отраслях промышленности и научных исследованиях. Вот некоторые из основных областей, где они находят применение:
1. Производство пластиков. Этилен является основным сырьем для производства полиэтилена – одного из самых распространенных пластиков в мире. Полиэтилен используется во многих областях, включая упаковку, строительство, автомобильную промышленность и медицину. Гомологи этилена, такие как пропилен и бутадиен, также используются для производства различных типов пластиков.
2. Производство растворителей. Этилен и его гомологи используются в производстве растворителей, которые широко применяются в химической промышленности, лакокрасочной промышленности и других отраслях. Некоторые из наиболее распространенных растворителей, получаемых из этилена и его гомологов, включают этиленгликоль, пропиленгликоль и бутанол.
3. Производство синтетических волокон. Этилен и его гомологи используются в производстве синтетических волокон, таких как полиэфир, полипропилен и полибутадиен. Эти волокна широко применяются в текстильной промышленности для производства одежды, ковров и других текстильных изделий.
4. Производство резин. Этилен и его гомологи используются в производстве различных видов резин, включая полиэтиленовую резину, полипропиленовую резину и бутиловую резину. Резина на основе этилена и его гомологов обладает различными свойствами, такими как гибкость, упругость и химическая стойкость, что делает их идеальными для использования в автомобильной промышленности, производстве шин и других изделий.
5. Производство пестицидов и гербицидов. Этилен и его гомологи используются в производстве пестицидов и гербицидов. Например, этиленоксид используется в производстве некоторых пестицидов, а пропилен используется в производстве гербицидов.
Это лишь некоторые из множества областей, где этилен и его гомологи находят применение. Их уникальные свойства и возможность образования новых химических соединений делают их важными компонентами в различных процессах и продуктах. Таблица сравнения алкенов
|
Свойство |
Этилен |
Пропилен |
Бутен |
|
Молекулярная формула |
C2H4 |
C3H6 |
C4H8 |
|
Структура |
Простой двойной связи между углеродами |
Две двойные связи между углеродами |
Три двойные связи между углеродами |
|
Физические свойства |
Бесцветный газ, легче воздуха |
Бесцветный газ, легче воздуха |
Бесцветный газ, легче воздуха |
|
Химические свойства |
Реакции аддиции, полимеризации |
Реакции аддиции, полимеризации |
Реакции аддиции, полимеризации |
|
Применение |
Производство пластиков, резин, этиленового гликоля |
Производство пластиков, резин, синтетических волокон |
Производство пластиков, резин, синтетических волокон |
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.