
Класс 10 Б Дата 21.12.20 г.
Тема урока: Фенолы и ароматические спирты.
Цель: изучить состав, строение, свойства фенола и его соединений. Изучить различие между фенолом и ароматическим спиртами.
Задачи:
Образовательные:
Развивающие:
Воспитательные:
Планируемые результаты обучения:
Личностные. Формировать ответственное отношение к учению, коммуникативная компетентность
Метапредметные. Развивать умение самостоятельно определять цели своего обучения, ставить и формулировать для себя новые задачи в учебе и познавательной деятельности, развивать мотивы и интересы своей познавательной деятельности, соотносить свои действия с планируемыми результатами, осуществляет контроль в своей деятельности в процессе достижения результата
Предметные. Знать химические свойства фенолов. Знать строение фенола, а также уметь отличать от ароматических спиртов.
Средства обучения: икт, химический эксперимент (демонстрационный и ученический), опорные конспекты, тесты.
Ход урока
Приветствие. Проверка присутствующих на уроке.
2. Мотивация.
«Границ научному познанию и предсказанию предвидеть невозможно»
Д.И. Менделеев.
3. Подготовительный этап (актуализация знаний).
Учитель: Здравствуйте, ребята!
Сегодня у нас необычный урок. Настройтесь на волну успеха и у нас с вами всё получится.
Ребята, скажите, пожалуйста, с чем мы знакомились на уроках химии?
Ученик: Мы знакомились с органическими веществами различных классов.
Учитель:
Вспомните эти классы органических веществ и установите соответствие между изученными классами органических веществ и отличительными характеристиками данных классов веществ:
Приложение 1. Основные классы углеводородов (учебник)
Алканы СnН2n +2 Все связи С – С одинарные СН3 - СН3 Этан
Алкены СnН2n Одна двойная связь Этен (этилен)
Алкадиены СnН2n- 2 Две двойные связи Бутадиен
Алкины СnН2n- 2 Одна тройная связь Этин (ацетилен)
Арены СnН2n- 6 Ароматическая связь (бензольное кольцо) Бензол
Спирты СnН2n +1ОН -ОН гидроксильная группа СН3-СН2-ОН Этанол
Фенол С6Н5ОН -ОН гидроксильная группа С6Н5- фенил
Учитель: А что у нас осталось без определения?
Фенол С6Н5ОН -ОН гидроксильная группа С6Н5- фенил
А почему в такой последовательности распределили классы?
Ученик: Из первого класса алканов предельных углеводородов мы получали следующий класс веществ.
Учитель: Что вы можете сказать о данной формуле?
Ученик: В данной формуле присутствует гидроксильная группа-ОН как у класса спиртов.
Учитель: Как вы думаете: какая тема нашего урока? Какую задачу нам предстоит решить на уроке?
Ученик: Изучить свойства данного вещества и определить к какому классу веществ относится фенол.
Учитель: Сегодня на уроке мы познакомимся с новым органическим веществом. Запишите в тетрадь: тема урока ФЕНОЛ. Как вы считаете, какие вопросы мы должны рассмотреть? Какой план урока?
4. Основной этап (усвоение новых знаний и способов действий)
Определение фенолов Соединения, в которых ароматический радикал фенил С6Н5- непосредственно связан с гидроксильной группой, отличаются по свойствам от ароматических спиртов, настолько, что их выделяют в отдельный класс органических соединений, называемый фенолами.
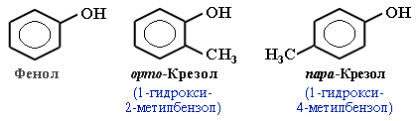
Классификация и изомерия фенолов В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
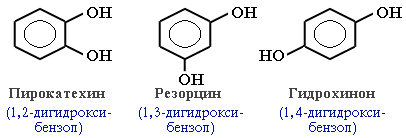
Как видно из приведенных примеров, фенолам свойственна структурная изомерия (изомерия положения гидроксигруппы).
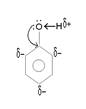 ЭЛЕКТРОННОЕ
СТРОЕНИЕ
ЭЛЕКТРОННОЕ
СТРОЕНИЕ
Обращаем внимание, что валентные связи атома кислорода расположены не по прямой, а под некоторым углом друг к другу.
Вопрос: Как влияет углеводородный радикал на подвижность атома водорода группы ОН в предельных одноатомных спиртах? (Понижает)
Фенильный радикал оттягивает на себя неподеленную пару электронов от атома кислорода. Это приводит к тому, что 2р - орбиталь атома кислорода вступает во взаимодействие с электронной системой бензольного кольца. В результате усиливается поляризация гидроксильной группы и отрыв атома водорода в виде протона облегчается.
Физические свойства: Фенол - бесцветное кристаллическое вещество (розовеет при хранении из-за окисления) с характерным запахом его температура плавления 40,9 оС. В холодной воде он малорастворим, при нагревании растворяется в любых количествах.
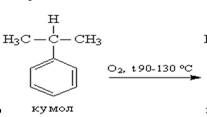
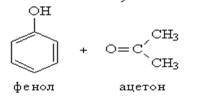
Получение: Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон.
Другой способ – каталитический гидролиз галогензамещенных бензолов.
Химические свойства фенолов
А) Кислотные свойства фенола
- 1) В отличие от спиртов, фенол вступает в реакцию нейтрализации со щелочами:
С6Н5ОН +NaOH → С6Н5ОNa + Н2О
Фенол фенолят натрия
2) фенолят натрия может быть получен и при взаимодействии фенола с металлическим натрием:
2С6Н5ОН + 2Na → 2С6Н5ОNa + Н2
Фенол фенолят натрия
Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН.
Фенол – слабая кислота (карболовая).
Б) Ароматические свойства фенола
- Нитрование фенола
3) Влияние гидроксила на фенил состоит в том, что он делает атомы водорода в положениях 2, 4 и 6 более подвижными, и потому фенол, в отличие от бензола, взаимодействует с азотной кислотой не по одному, а сразу по трём положениям, образуя 2,4,6 – тринитрофенол, известный под названием пикриновая кислота (сильное взрывчатое вещество):
С6Н5ОН + 3НNО3 à С6Н5ОН(NО2)3 + 3Н2О
Фенол 2,4,6 – тринитрофенол
- Галогенирование фенола
4. При взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенол:
С6Н5ОН + 3Вr2 à С6Н5ОНBr3 + 3НBr
Фенол 2,4,6 – трибромфенол
Эта реакция служит для качественного обнаружения фенола.
В экстрактах многих растений, особенно обладающих дубильным и вяжущим действием, содержатся вещества, называемые «танины». В состав их молекул входит большое число фенольных остатков. Они также дают с хлоридом железа (III) интенсивное фиолетовое окрашивание.
В чайных листьях содержится большое количество танина, придающего напитку терпкий вяжущий привкус.
Лабораторная работа.
Опыт № 1 «Определение танина в холодной заварке чая»
В чистую пробирку налить 2 – 3 мл холодной заварки чая и добавить 2 – 3 капли FeCI3.
Что произошло? Почему изменилась окраска?
Сделайте вывод.
Опыт № 2 «Определение фенола в парацетамоле».
В чистую пробирку налить 2 – 3 мл воды и поместить полтаблетки парацетамола.
Встряхнуть пробирку, чтоб таблетка растворилась.
Добавить 2-3 капли FeCI₃
Что произошло? Почему изменилась окраска?
Сделайте вывод.
Применение
Фенол - ядовит!!! При попадании на кожу вызывает ожоги, при этом он всасывается через кожу и вызывает отравление.
Биологическая роль соединений фенола (кодосхема)
|
Положительная |
Отрицательная |
|
-лекарственные препараты (пурген, парацетамол) антисептики (3-5 % раствор –карболовая кислота) -эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце - эвгенол в гвоздике, базилике Флавоноиды (способствуют удалению радиоактивных элементов из организма) |
|
5. Закрепление и применение знаний.
Решение тестов демонстрационных, которые представлены на слайде.
1. Формула фенола:
А) С2Н5ОН Б) С6Н5ОН В) С6Н2Br3 Г) СН3СООН
2. Качественная реакция на фенол с:
А) металлическим Na Б) NaOH B) FeCI3 Г) НBr
3. Фенол проявляет:
А) кислотные свойства Б) основные свойства
В) амфотерные свойства Г) кислотно – основные свойства
4. Фенол – это
А) белое кристаллическое вещество, хорошо растворимо в холодной воде
Б) белое кристаллическое вещество, с характерным запахом, быстро розовеющее на воздухе в следствии окисления.
В) прозрачная жидкость с характерным запахом
Г) газообразное, ядовитое вещество
5. Фенол не получают из:
А) каменного угля Б) предельных углеводородов
В) бензола Г) изопропилбензола
6. Фенол не реагирует с:
А) NaOH Б) HNO3 B) H2O г) бромной водой
Ответы: 1-Б; 2- В; 3- А; 4- Б; 5- Б; 6 - В
Что нового вы узнали сегодня на уроке?
– Можно ли считать, что ваши цели на урок достигнуты?
– Оцените свою деятельность на уроке, дайте оценку полученным знаниям, их значимости в дальнейшей деятельности.
(Учащиеся отвечают на вопросы).
§22, упр. 5,7, стр.110.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.