
№14
Уроки № 88-95 обобщающее повторение
Уроки № 92 обобщающее повторение темы «Молекулярная физика»
Тема урока: обобщающее повторение темы «Молекулярная физика»
Цели работы для учащегося:
- понимание основных понятий и формул;
- формирование навыков решения задач
Краткая теория
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химического вещества. В основе молекулярно-кинетической теории лежат три основных положения:
· Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными и состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы (соответственно: катионы и анионы).
· Атомы и молекулы находятся в непрерывном хаотическом движении и взаимодействии, скорость которого зависит от температуры, а характер – от агрегатного состояния вещества.
· Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Атом – наименьшая химически неделимая частица элемента (атом железа, гелия, кислорода). Молекула – наименьшая частица вещества, сохраняющая его химические свойства. Молекула состоит из одного и более атомов (вода – Н2О – 1 атом кислорода и 2 атома водорода). Ион – атом или молекула, у которых один или несколько электронов лишние (или электронов не хватает).
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах молекулы конденсируются в жидкое или твердое вещество. При повышении температуры средняя кинетическая энергия молекулы становится больше, молекулы разлетаются, и образуется газообразное вещество.
Идеальный газ – это газ, молекулы которого не взаимодействуют друг с другом, за исключением процессов упругого столкновения и считаются материальными точками.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома. Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро: NА = 6,022·1023 моль–1.
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории. Количество вещества определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА, или как отношение массы к молярной массе:
![]()
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро (то есть на количество частиц в одном моле). Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса. В таблице Менделеева молярная масса указана в граммах на моль. Таким образом имеем еще одну формулу:
![]()
где: M – молярная масса, NA – число Авогадро, m0 – масса одной частицы вещества, N – число частиц вещества содержащихся в массе вещества m. Кроме этого понадобится понятие концентрации (количество частиц в единице объема):
![]()
Напомним также, что плотность, объем и масса тела связаны следующей формулой:
![]()
Если в задаче идет речь о смеси веществ, то говорят о средней молярной массе и средней плотности вещества. Как и при вычислении средней скорости неравномерного движения, эти величины определяются полными массами смеси:
![]()
![]()
Давление газа – это результат столкновений молекул со стенками сосуда. Если нет стенки или любого другого препятствия для молекул, то само понятие давления теряет смысл. Поскольку давление есть следствие ударов молекул о стенку сосуда, очевидно, что его величина должна зависеть от характеристик отдельно взятых молекул (от средних характеристик, конечно, Вы ведь помните про то, что скорости всех молекул различны). Эта зависимость выражается основным уравнением молекулярно-кинетической теории идеального газа:
![]()
где: p - давление газа, n - концентрация его молекул, m0 - масса одной молекулы, vкв - средняя квадратичная скорость (обратите внимание, что в самом уравнении стоит квадрат средней квадратичной скорости). Физический смысл этого уравнения состоит в том, что оно устанавливает связь между характеристиками всего газа целиком (давлением) и параметрами движения отдельных молекул, то есть связь между макро- и микромиром.
Как уже было отмечено в предыдущем параграфе, скорость теплового движения молекул определяется температурой вещества. Для идеального газа эта зависимость выражается простыми формулами для средней квадратичной скорости движения молекул газа:
![]()
где: k = 1,38∙10–23 Дж/К – постоянная Больцмана, T – абсолютная температура. Сразу же оговоримся, что далее во всех задачах Вы должны, не задумываясь, переводить температуру в кельвины из градусов Цельсия (кроме задач на уравнение теплового баланса). Закон трех постоянных:
![]()
где: R = 8,31 Дж/(моль∙К) – универсальная газовая постоянная. Следующей важной формулой является формула для средней кинетической энергии поступательного движения молекул газа:
![]()
Оказывается, что средняя кинетическая энергия поступательного движения молекул зависит только от температуры, одинакова при данной температуре для всех молекул. Ну и наконец, самыми главными и часто применяемыми следствиями из основного уравнения МКТ являются следующие формулы:
![]()
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
![]()
При этом изменение температуры на 1ºС соответствует изменению температуры на 1 К. Изменения температуры по шкале Цельсия и Кельвина равны. В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой К. Например, комнатная температура TС = 20°С по шкале Кельвина равна TК = 293 К. Температурная шкала Кельвина называется абсолютной шкалой температур. Она оказывается наиболее удобной при построении физических теорий.
Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
Уравнение состояние идеального газа является очередным следствие из основного уравнения МКТ и записывается в виде:
![]()
Данное уравнение устанавливает связь между основными параметрами состояния идеального газа: давлением, объемом, количеством вещества и температурой. Очень важно, что эти параметры взаимосвязаны, изменение любого из них неизбежно приведет к изменению еще хотя бы одного. Именно поэтому данное уравнение и называют уравнением состояния идеального газа. Оно было открыто сначала для одного моля газа Клапейроном, а впоследствии обобщено на случай большего количество молей Менделеевым.
Если температура газа равна Tн = 273 К (0°С), а давление pн = 1 атм = 1·105 Па, то говорят, что газ находится при нормальных условиях.
Газовые законы
Решение задач на расчет параметров газа значительно упрощается, если Вы знаете, какой закон и какую формулу применить. Итак, рассмотрим основные газовые законы.
1. Закон Авогадро. В одном моле любого вещества содержится одинаковое количество структурных элементов, равное числу Авогадро.
2. Закон Дальтона. Давление смеси газов равно сумме парциальных давлений газов, входящих в эту смесь:
![]()
Парциальным давлением газа называют то давление, которое он бы производил, если бы все остальные газ внезапно исчезли из смеси. Например, давление воздуха равно сумме парциальных давлений азота, кислорода, углекислого газа и прочих примесей. При этом каждый из газов в смеси занимает весь предоставленный ему объем, то есть объем каждого из газов равен объему смеси.
3. Закон Бойля-Мариотта. Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется, следовательно:
![]()
Процесс, происходящий при постоянной температуре, называют изотермическим. Обратите внимание, что такая простая форма закона Бойля-Мариотта выполняется только при условии, что масса газа остается неизменной.
4. Закон Гей-Люссака. Сам закон Гей-Люссака не представляет особой ценности при подготовке к экзаменам, поэтому приведем лишь следствие из него. Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется, следовательно:
![]()
Процесс, происходящий при постоянном давлении, называют изобарическим или изобарным. Обратите внимание, что такая простая форма закона Гей-Люссака выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
5. Закон Шарля. Как и закон Гей-Люссака, закон Шарля в точной формулировке для нас не важен, поэтому приведем лишь следствие из него. Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется, следовательно:
![]()
Процесс, происходящий при постоянном объеме, называют изохорическим или изохорным. Обратите внимание, что такая простая форма закона Шарля выполняется только при условии, что масса газа остается неизменной. Не забывайте про перевод температуры из градусов Цельсия в кельвины.
6. Универсальный газовый закон (Клапейрона). При постоянной массе газа отношение произведения его давления и объема к температуре не изменяется, следовательно:
![]()
Обратите внимание, что масса должна оставаться неизменной, и не забывайте про кельвины.
.
Изобарным процессом называют процесс, протекающий при неизменным давлении и массе газа. Как следует из уравнения состояния идеального газа, в этом случае объем изменяется прямо пропорционально температуре. Графики изобарического процесса в координатах р–V; V–Т и р–Т имеют следующий вид:
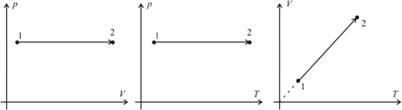
Обратите внимание на то, что продолжение графика в V–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как при очень низких температурах газ превращается в жидкость и зависимость объема от температура меняется.
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме и при условии, что количество вещества в сосуде остается неизменным. Как следует из уравнения состояния идеального газа, при этих условиях давление газа изменяется прямо пропорционально его абсолютной температуре. Графики изохорного процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
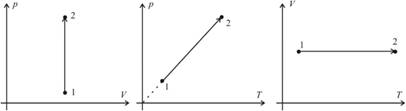
Обратите внимание на то, что продолжение графика в p–T координатах направлено точно в начало координат, однако этот график никогда не сможет начаться прямо из начала координат, так как газ при очень низких температурах превращается в жидкость.
Изотермическим процессом называют процесс, протекающий при постоянной температуре. Из уравнения состояния идеального газа следует, что при постоянной температуре и неизменном количестве вещества в сосуде произведение давления газа на его объем должно оставаться постоянным. Графики изотермического процесса в координатах р–V; р–Т и V–Т имеют следующий вид:
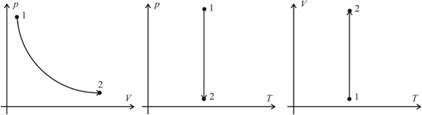
Заметим, что при выполнении заданий на графики в молекулярной физике не требуется особой точности в откладывании координат по соответствующим осям (например, чтобы координаты p1 и p2 двух состояний газа в системе p(V) совпадали с координатами p1 и p2 этих состояний в системе p(T). Во–первых, это разные системы координат, в которых может быть выбран разный масштаб, а во–вторых, это лишняя математическая формальность, отвлекающая от главного – от анализа физической ситуации. Основное требование: чтобы качественный вид графиков был верным.
Ссылки на интернет-ресурс: https://educon.by/index.php/materials/phys/molekuliaraja
Задания для самостоятельного решения
Основное уравнение МКТ. Температура
Задание #1
Вопрос:
Из основного уравнения молекулярно-кинетической теории ясно, что...
Выберите несколько из 4 вариантов ответа:
1) Давление газа прямо пропорционально средней кинетической энергии его молекул
2) Давление газа обратно пропорционально концентрации
3) Давление газа пропорционально силе, с которой молекулы ударяются о стенки сосуда
4) Давление газа зависит от рода газа
Задание #2
Вопрос:
Концентрация газа равна 2х1027 м-3, а средняя кинетическая энергия его молекул составляет 3,5х 10-22 Дж. Найдите давление этого газа (в кПа).
Запишите число:
___________________________
Задание #3
Вопрос:
Плотность газа, находящегося при нормальном давлении равна 1,5 кг/м3. Найдите среднюю скорость движения его молекул (в м/с)
Запишите число:
___________________________
Задание #4
Вопрос:
В чем состоит основное отличие температуры от остальных макропараметров тела?
Выберите один из 4 вариантов ответа:
1) Температура связана со средней кинетической энергией молекул
2) Температура не может быть строго определена
3) Температура описывает внутреннее состояние тела
4) Температура не зависит от других макропараметров
Задание #5
Вопрос:
Температура...
Выберите несколько из 4 вариантов ответа:
1) Является мерой средней кинетической энергии тел
2) Является характеристикой теплового равновесия
3) Является причиной установления теплового равновесия
4) Остается постоянной при неизменном давлении
Задание #6
Вопрос:
Температура тела равна 200 К. Каково значение температуры в оС?
Запишите число:
___________________________
Задание #7
Вопрос:
Средняя кинетическая энергия молекул тела равна 6х10-21 Дж. Какова температура этого тела (в К)?
Запишите число:
___________________________
Задание #8
Вопрос:
Два моля идеального газа находится при температуре -20 оС. Каково давление газа (в кПа), если он занимает объём, равный 10 л?
Запишите число:
___________________________
Задание #9
Вопрос:
Абсолютный ноль - это...
Выберите несколько из 4 вариантов ответа:
1) Самая низкая температура в природе
2) Температура, равная 0 оС
3) Температура, при которой тепловое движение прекращается
4) Самая низкая температура, зарегистрированная на Земле
Задание #10
Вопрос:
Формула, связывающая среднюю кинетическую энергию молекул с температурой верна...
Выберите один из 4 вариантов ответа:
1) Для любых тел
2) Только для газов
3) Для любых тел, подчиняющихся механике Ньютона
4) Для газов, подчиняющихся механике Ньютона
Уравнение состояния идеального газа. Газовые законы
Задание #1
Вопрос:
При каких процессах наблюдается линейная зависимость между двумя макропараметрами идеального газа
Выберите несколько из 4 вариантов ответа:
1) Изотермический
2) Изобарный
3) Изохорный
4) Адиабатный
Задание #2
Вопрос:
В одном моле идеального газа отношение произведения давления и объёма к температуре равно...
Выберите один из 4 вариантов ответа:
1) 1
2) 8,31
3) 6,02
4) 1,38
Задание #3
Вопрос:
Как изменится давление идеального газа, если его температура увеличилась в три раза, а объём - в 2 раза?
Выберите один из 4 вариантов ответа:
1) Уменьшится в 6 раз
2) Увеличится в 6 раз
3) Уменьшится в 1,5 раза
4) Увеличится в 1,5 раза
Задание #4
Вопрос:
Отношение давления идеального газа к его температуре остается постоянным. Тогда, речь идет об...
Выберите один из 4 вариантов ответа:
1) Изохорном процессе
2) Изобарном процессе
3) Изотермическом процессе
4) Адиабатном процессе
Задание #5
Вопрос:
На графике указаны две изобары. Исходя из графика...
Изображение:
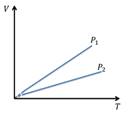
Выберите один из 3 вариантов ответа:
1) P2<P1
2) P2>P1
3) P2=P1
Задание #6
Вопрос:
Газ, изотермически расширяясь, изменил объём от 1 л до 4 л. Начальное давление газа равно 200 кПа. Каким станет давление (в кПа), когда газ закончит расширяться?
Запишите число:
___________________________
Задание #7
Вопрос:
Один грамм водорода находится в баллон под давлением 150 кПа. Найдите температуру водорода (в К), если объём баллона равен 3 л.
Запишите число:
___________________________
Задание #8
Вопрос:
Воздушный шарик, который не пропускает воздух, находится в комнате при температуре 20 оС. Предполагая, что процесс охлаждения шарика является изобарным, определите, до какой температуры нужно остудить шарик, чтобы его объём уменьшился вдвое?
Запишите число:
___________________________
Задание #9
Вопрос:
Азот находится в баллоне при температуре 90 оС. Предполагая, что плотность азота при данных условиях равна 7,5 кг/м3, найдите давление азота (в кПа) на стенки баллона.
Запишите число:
___________________________
Задание #10
Вопрос:
Универсальная газовая постоянная измеряется в...
Выберите один из 4 вариантов ответа:
1) Дж/моль
2) Дж/К
3) Дж/(моль*К)
4) Дж/(моль*К*м3)
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.