
|
Раздел долгосрочного плана: 10.3 А Окислительно-восстановительные реакции |
Школа: Средняя школа №10 |
||||||
|
Дата: 17.01.2020 |
ФИО учителя: Худашева М. Р. |
||||||
|
Класс: 10 «В» |
Количество присутствующих: |
отсутствующих: |
|||||
|
Тема урока |
Гальванические элементы. |
||||||
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу) |
10.2.3.5 понимать гальванический элемент как устройство для преобразования энергии химической реакции в электрическую 10.2.3.6 объяснять принцип работы гальванических элементов |
||||||
|
Цели урока |
Ознакомение с видами гальванических элементов. Ознакомление с принципом работы гальванических элементов. Изучение процесса преобразования химической энергии в электрическую. Применение показателей стандартных электродных потенциалов для вычисления ЭДС гальванического элемента; Изучение преимуществ и недостатков гальванических элементов; Влияние отработанных гальванических элементов на окружающую среду |
||||||
|
Критерии достижения |
Знает виды гальванических элементов; Может объяснить принцип работы гальванического элемента; Может назвать какой элемент будет восстановителем, а какой окислителем, используя таблицу стандартных электродных потенциалов Может вычислить ЭДС заданного гальванического элемента; Может перечислить преимущества и недостатки заряжаемых и незаряжаемых гальванических элементов |
||||||
|
Языковые цели
|
Rechargeable cells – перезаряжаемые ячейки(гальванические элементы) На катоде происходит ........... На аноде происходит ............. Между электродами возникает напряжение которое называется .......... |
||||||
|
Привитие ценностей |
Трудолюбие, аккуратность, внимательность |
||||||
|
Межпредметные связи |
Физика. Электродинамика |
||||||
|
Навыки использования ИКТ |
Презентация Работа с интернет ресурсами |
||||||
|
Предварительные знания |
Строение атома, образование ионов, электрохимический ряд напряжения металлов, стандартный электродный потенциал |
||||||
|
Ход урока |
|||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке
|
Ресурсы |
|||||
|
Начало урока
26-36 мин
|
Орг момент. Психологический настрой. Деление на группы. Демонстрируются фотографии различных батареек, аккумуляторов. Задается вопрос: для чего мы используем эти вещи? Какой процесс идет в батарейках? За счет чего образуется электрическая энергия? В чем разница батареек и аккумуляторов? объясняется, что батарейки и аккумуляторы это химические источники электрической энергии и называются гальваническими элементами. Есть перезаряжаемые гальванические элементы которые называются аккумуляторами. Какими техническими характеристиками должна обладать на ваш взгляд батарейка? Работа в группах. Раздается текст с заданием. Прочитайте текст Простейший гальванический элемент. Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов. На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя. Задание: на примере цинко-медного гальванического элемента 1. Какую величину вы будете использовать для написания схемы гальванического элемента? 2. Запишите схему заданного гальванического элемента 3. Запишите схему процесса происходящего на аноде 4. Запишите схему процесса происходящего на катоде 5. Запишите суммарную окислительно-восстановительную реакцию, происходящую в гальваническом элементе 6. Вычислите ЭДС цинко-медного гальванического элемента, используя формулу ЭДС= Екатод -Е анод Для групп учащихся не справляющихся с заданием дается подсказка -картинка
После ознакомления с выполненными работами, учитель объясняет неясные моменты, задавая уточняющие вопросы: почему анодом является цинк? почему катодом является медь? Какой процесс происходит на катоде? Какой процесс происходит на аноде? Зачем нужен солевой мостик или пористая стенка между электродами? Почему в качестве электролита выбрали (какой нибудь раствор соли)? Что такое ЭДС и как ее применяют? Работа в парах Раздается текст с заданием. Круглый гальванический элемент - "button" cell, используются в кардиостимуляторах, в других медицинских приборах , в часах и в калькуляторах. Обычно используют литий или цинк как отрицательный полюс, йод, оксид марганца (ІV) или оксид серебра как положительный полюс.
Преимущества: длительный срок хранения, который составляет до 12 лет; невосприимчивость к перепадам температур, они не содержат жидкий или в виде пасты электролит, что исключает утечку. Задание: перед вами рисунок литиевый гальванический элемент. литий часто используется как отрицательный полюс в круглых батарейках Чему равно напряжение данной батарейки? 1. Объясните, почему литий часто используется при изготовлении батареек - источника электрического тока?(самый низкий электродный потенциал обладает высокими восстановительными свойствами, ион лития обладает низкими окислительными свойствами) 2. Вам даны полуреакции для литий -иодной батарейки: Li+ + ē→ Li Eө= -3.04V ½ I2 (s) +ē → I- (ag) Eө= +0.54 V 1. Вычислите ЭДС электрохимической ячейки. 2. Запишите схему электролитической ячейки 3. Практическое напряжение в литий/иодном гальваническом элементе равно 2,87V. Предположите, почему имется разница между теоретическим вычисленным вами и практическим напряжением? (ответ: условия не стандартные) 4. Предложите еще два преимущества литий/иодной батарейки перед другими сухими батарейками. (Ответ: постоянное напряжение; высокая ёмкость и плотность энергии; независимость энергоёмкости от тока нагрузки; небольшая масса) Индивидуальная работа. Задание: При разряде в аккумуляторах Li/FeS2 протекает следующая реакция: 4Li + FeS2 → 2Li2S + Fe Интересной особенностью является сохранение работоспособности системы Li/FeS2 при -40 по Цельсию. Это по силам только батареям с катодами в жидком виде. Батарейки Li/FeS2имеют стабильные характеристики при работе с потребителями, требующими большой мощности. 1. что является анодом? Объясните свой ответ: (литий, имеет низкий электродный потенциал, т.е. является восстановителем) 2. что является катодом? Поясните свой ответ: (сульфид железа, т.к. железо E0Fe2+/Fe0 имеет более высокое значение электродного потенциала, чем E0(Li+/Li) 3. Напишите уравнение полуреакции происходящее на аноде 4. Напишите уравнение полуреакции проиходящего на катоде 5. Используя таблицу стандартных электродных потенциалов вычислите ЭДС гальванического элемента |
Bilimland- Химия -окружающая среда- гальванические элементы
|
|||||
|
|
Д/з 1гр ознакомиться с работой автомобильного аккумулятора http://avto-blogger.ru/akb-avto/kak-rabotaet-akkumulyator-avtomobilya-kratko-ob-ustrojstve-video.html 2 гр водородного топливного элемента. Подготовить презентации Рефлексия: - что узнал, чему научился? что осталось непонятным? |
|
|||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение
техники безопасности |
|||||
|
Все учащиеся: Знают и могут объяснить работу химического источника энергии, описать процессы происходящие на катодах и анодах на примере солевых гальванических элементов Большинство учащихся могут объяснить расписать электрохимическую ячейку гальванического элемента Некоторые учащиеся: Достигают учебным целям урока и делают выводы |
(П)- работа в паре Работу каждого учащегося учитель поддерживает и просматривает, по необходимости дает дополнительные объяснения, учащиеся оценивают сами себя. (W) работа с классом В ходе урока ученики оценивают все выполненные действия по данным ответам.
|
Физминутки и активные виды деятельности используются при необходимости (если учащиеся на уроке устали).
|
|||||
Доп задания. http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-elektrodnye-processy-galvanicheskij-element.html
Приложение 1
Что и говорить, аккумулятор (АКБ – аккумуляторная батарея) это электрическое сердце наших авто. Сейчас с компьютеризацией машин его роль становится все значимее. Однако если вспомнить основные функции, то их можно выделить всего три:
При выключенном состоянии питание электрических цепей нужных для авто, например бортовой компьютер, сигнализация, часы, настройки (как приборной панели, так, даже и сидений, ведь они на многих иномарках регулируются электричеством).
Запуск двигателя. Основная задача – без батареи вы не запустите мотор.
При больших нагрузках, когда генератор не справляется, подключается аккумулятор и отдает накопившуюся в нем энергию (но такое бывает крайне редко), если только генератор уже на последнем вздохе.
Устройство аккумулятора автомобиля
Знаете, первая свинцовая батарея появилась еще в 1859 году (изобрел француз Гастон Плантэ). И за свои полторы сотни лет она мало в чем изменилась. Правда, для аккумулятора машины используют несколько подключенных последовательно элементов.
ИТАК: Автомобильная батарея (АКБ) обычно состоит из 6 последовательно подключенных элементов. Каждый элемент считается независимым, то есть если его отключить он будет работать автономно – выдавая примерно 2,1 — 2,2В. Если представить одну ячейку в разрезе это будет – плоская и прямоугольная, герметичная «банка» — именно так ее называют. Как вы догадались если 2,1В умножить на «6», то получится 6 Х 2,1 = 12,6В, это нормальное общее напряжение в заряженном состоянии.

В каждую «банку» помещены свинцовые пластины и залит специальный электролит(основанной на серной кислоте). Пластины разбиты по отдельным группам – плюсовые и минусовые. Они не примыкают друг к другу, хотя и находятся рядом, между ними проложены диэлектрические элементы — обычно это пластиковые или прорезиненные листы. Если минусовые и плюсовые пластины соприкоснуться, то батарея работать не будет – банка замкнет. Делаются пластины из свинца:
Минусовые – обычно из чистого, но пористого свинца (Pb)
Плюсовые – делаются из диоксида свинца (PbO2)
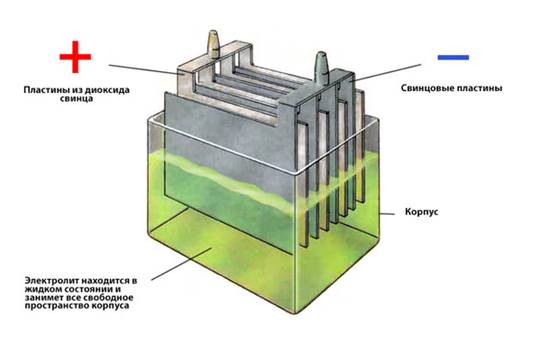
Серная кислота, в которую они погружены, является очень хорошим проводником – по-научному электролитом, она способствует накоплению энергии. Смысл прост — если подать на аккумулятор электрический ток, он начнет его накапливать. Затем через какое-то время, он будет его отдавать.
Есть еще такое понятие как емкость аккумулятора – она зависит от количества свинца использованного при производстве – чем больше – тем больше энергии можно накопить. Измеряется в Ампер-часах (А*ч) — это количество Ампер, которые отдаст аккумулятор за час. Сейчас самые распространенные варианты – это 55 – 60 А*ч, которые применяются на большинстве легковых машин.
Чтобы запустить двигатель его нужно «раскрутить» и подать искру на сжатое топливо. Крутит двигатель такое устройство как стартер, а генерируют искру катушки зажигания, после чего она идет на свечи. И для того и для другого действия нужен электрический ток – его то и дает аккумулятор автомобиля, это его самая главная задача.
Как это происходит – при помощи химической реакции внутри батареи вырабатывается электрический ток. Вы садитесь и поворачиваете ключ зажигания – сразу же на генератор подается энергия, бендикс (обгонная муфта) входит в зацепление с маховиком двигателя и начинает вращаться – к маховику подсоединен коленвал, который в свою очередь начинает толкать поршни – далее в высшей точке (сжатие) – происходит подача искры (опять же от аккумулятора) – топливо поджигается и двигатель запускается. После от генератора начинает идти зарядка, которая восполняет (заряжает) потерю энергии аккумулятора. При разряде батареи на пластинах начинает образовываться сульфат свинца (по сути его соль), это нормально, обычная химическая реакция, чем больше отдается энергии, тем больше этого налета. Чем больше соли, тем менее концентрированный электролит, падает выработка энергии.
Но стоит вам подключить АКБ на зарядку, то процесс идет в обратном направлении – соли начинают растворяться в электролите, концентрация восстанавливается, что способствует накоплению энергии. После зарядки выработка электрического тока восстанавливается.
Почему батарея автомобиля может выйти из строя?
Как не прискорбно — нет ничего вечного, вот и АКБ со временем изнашивается. Конечно, если вы его используете правильно, то он прослужит достаточно долго, но уже через 4 – 5 лет (иногда 6), нужна замена. Так почему же умирает батарея?
Все просто – основная причина это глубокий разряд, если разрядить – совсем, да еще и долго не заряжать то пластины покрываются солями гораздо плотнее. Их рабочая поверхность падает, а соответственно будет падать и емкость аккумулятора, он уже не сможет выдерживать большие нагрузки.
Вторая причина это банально износ. Со временем от множества циклов заряда – разряда, пластины начинают медленно осыпаться. Что также ведет к деградации батареи. Особенно сильно страдают, если испарился электролит и пластина осталась «сухой» (часто это происходит летом при высоких температурах), если будет идти зарядка, то это очень быстро «убьет» аккумулятор. Вот почему в случае с обслуживаемым аккумулятором нужно всегда проверять уровень электролита.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.