
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» Дисциплина «Химия» |
|
|
|
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ТЕМА ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
|
|
|
|
|
|
Торжок, 2018
|
|
|
Министерство образования Тверской области ГБП ОУ «Торжокский государственный промышленно-гуманитарный колледж» |
||
|
Рецензент должность, место работы __. __. 2018 |
УТВЕРЖДАЮ зам. директора по УМР _____________ О.В.Гамелько __. __. 2018
|
|
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
Составлена в соответствии с ФГОС СПО
|
||
Содержание
Пояснительная записка
Информационная карта урока
Задания квеста
Пояснительная записка
В ходе урока используется квест.
В своем классическом значении квест (от англ. quest – поиск) – это командная игра, в которой востребованы эрудиция, сообразительность, креативность и нестандартное мышление. Идея игры проста – команды, перемещаясь в реальном или виртуальном пространстве, выполняют различные задания. Игра включает в себя последовательность точек (локаций) и задач, объединенных общим сценарием. Выполнив задание, команда получает направление на следующую точку или задание, и таким образом продвигается к финишу. Количество точек (уровней) и их сложность определяется для каждой игры в соответствии с ее целью и сюжетными особенностями. Используя свои знания, интеллект, смекалку, команда игроков должна стремиться выполнить все задания и преодолеть маршрут за определенное время.
Квест обладает всеми преимуществами игры как таковой, то есть дает возможность реализовать все плюсы игрового обучения. Это и пробуждение активности учащихся, и организация свободного творческого пространства, и формирование навыков принятия самостоятельных и коллективных решений. Не стоит забывать и о мотивационных возможностях состязательного характера игры, который, как правило, присутствует в любом квесте.
Игровая ситуация задается на старте квеста и может быть очень разнообразной. Выбирая сюжет игры, необходимо учитывать несколько важных условий. Прежде всего, он определяется целями проведения квеста – как учебными, так и воспитательными. Немаловажен возраст учащихся и психологические особенности группы. Но какими бы ни были сюжет и задачи квеста, важно изначально проектировать его многовариантность, динамику и драматургию, а в ходе проведения стараться поддерживать атмосферу игры, аккуратно управлять ей, не допуская превращение увлекательного приключения в бесконечную череду утомительных учебных заданий.
Квест – это всегда поиск. В буквальном смысле – играющим нужно найти месторасположение объекта, опознавательные знаки, информацию, отдельные детали и т.д. И эта задача, безусловно, развивает не только наблюдательность и внимание, но и привычку внимательного всматривания в окружающий мир. Квест убеждает в том, что вокруг нас много интересного, что не всегда бросается в глаза, что стоит стать чуть зорче, и увидишь больше, чем остальные. При этом, хотя игра носит командный характер, для достижения нужного результата важна поисковая работа каждого из участников. Зачастую в этих условиях неожиданно ярко проявляют себя обычно пассивные учащиеся, не обладающие большим багажом знаний, но обнаруживающие в игре наблюдательность или способность быстро ориентироваться в пространстве.
Исследовательские возможности квеста определяются и полной самостоятельностью учащихся, которая является обязательным условием этого типа игры. Учитель выступает здесь лишь дистанционным модератором – он не направляет действия участников, не участвует в определении стратегии поиска, не распределяет роли внутри группы. Все это студентам приходится делать самим для успешного достижения результата. В поисках ответа на заданный вопрос или решения задачи ими определяются оптимальные способы действия, актуализируются накопленные знания, анализируется информация и устанавливаются причинно-следственные связи. При этом результат игры может быть гораздо объемнее, чем достижение заданной на старте цели. В поле зрения участников часто оказываются не имеющие отношения к сюжету, но интересные детали и обстоятельства, возникают дополнительные вопросы, которые могут стать предметом дальнейшего обсуждения и исследования.
Чтобы максимально использовать исследовательскую составляющую квеста, важно организовать его поэтапную рефлексию. По завершении игры можно обсудить ее фактические результаты, обозначить самые сложные и самые интересные задания, отметить самых активных, изобретательных и эрудированных участников. Возможно на этом же этапе предположить возможные темы дальнейших исследований. Зачастую катализатором интересных идей здесь становятся запомнившиеся участникам вопросы или неожиданные наблюдения.
Таким образом, возможности образовательного квеста достаточно широки. Стоит заметить, что, рискнув взяться за подготовку подобных игр, немало приобретает и сам учитель. Открываются интересные факты, рождаются новые идеи. И как всякий творческий процесс, создание квеста – это увлекательное и вдохновляющее, хотя и трудоемкое занятие.
ТЕМА:
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ
|
ЦЕЛИ Изучить химические свойства неорганических веществ |
Развить познавательный интерес, активность. Формировать навыки принятия самостоятельных и коллективных решений
|
Воспитать научное мировоззрение |
|
СОДЕРЖАНИЕ 1. ОРГ.МОМЕНТ 2. АКТУАЛИЗАЦИЯ ЗНАНИЙ 3. УСВОЕНИЕ НОВЫХ ЗНАНИЙ -КЛАССИФИКАЦИЯ - КВЕСТ «ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ» - ИТОГИ КВЕСТА - ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ИЗУЧЕННОГО МАТЕРИАЛА -
|
МЕТОДИЧЕСКИЙ ИНСТРУМЕНТАРИЙ - видеосюжет -ЛСМ (формулы веществ) -ПСХЭ - маршрутные листы - листы с заданиями в конвертах - указатели - слова ключевой фразы
|
Назвать классы неорганических веществ, Распределять вещества по классам Характеризовать свойства различных классов веществ Организовывать совместное взаимодействие |
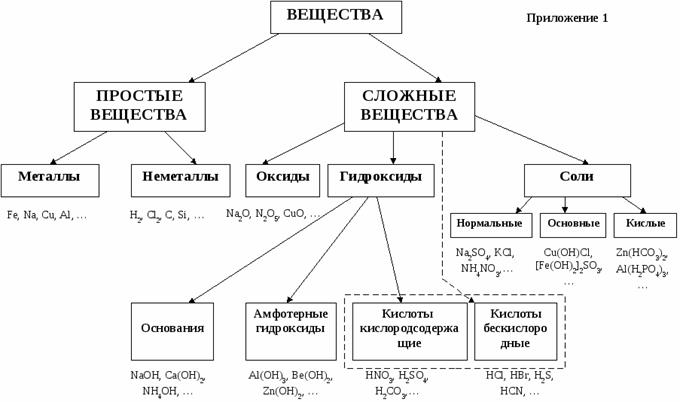
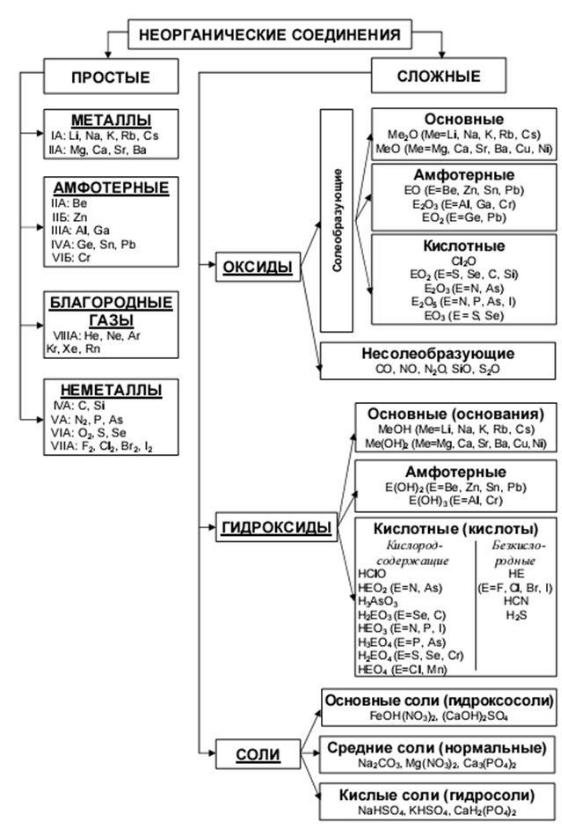
КВЕСТ
В ИТОГЕ ВЫПОЛНЕНИЯ ЗАДАНИЙ У ВАС ПОЛУЧИТСЯ ФОРМУЛА ВЕЩЕСТВА. ЕЕ НЕОБХОДИМИО НАЗВАТЬ. ЗАДАНИЯ ДОЛЖНЫ БЫТЬ ЗАПИСАНЫ В ТЕТРАДЬ ПО ХИМИИ КАЖДОМУ СТУДЕНТУ ГРУППЫ!
Разделение на группы
1.Определить тип оксида по формулам и разделиться по группам: несолеобразующие оксиды, кислотные оксиды, амфотерные оксиды, основные оксиды.
|
NO |
CO |
NO2 |
SiO |
SiO |
NO |
|
N2O |
SiO2 |
N2O3 |
CO2 |
N2O |
SO3 |
|
ZnO |
ZnO |
AL2O3 |
ZnO |
AL2O3 |
ZnO |
|
K2O |
CaO |
Fe2O3 |
Li2O |
CaO |
CaO |
МАРШРУТНЫЕ ЛИСТЫ
|
1 |
Задание
|
Где ключевое слово и следующее задание |
|
старт - кислоты |
Химические свойства кислот. ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ |
Задание у преподавателя |
|
|
Химические свойства солей |
Задание у преподавателя |
|
|
Химические свойства оснований |
финиш |
|
2 |
Задание
|
Где ключевое слово и следующее задание |
|
старт - кислоты |
Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ
|
Задание у преподавателя |
|
|
Химические свойства солей |
Задание у преподавателя |
|
|
Химические свойства оснований |
финиш |
|
3 |
Задание
|
Где ключевое слово и следующее задание |
|
старт - соли |
Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ |
Задание у преподавателя |
|
|
Химические свойства солей |
Задание у преподавателя |
|
|
Химические свойства оснований |
финиш |
|
4 |
Задание
|
Где ключевое слово и следующее задание |
|
старт - основания |
Химические свойства кислот ВНИМАНИЕ: ЗАПИСЫВАТЬ ВЫПОЛНЕННЫЕ ЗАДАНИЯ ВСЕМ СТУДЕНТАМ В ТЕТРАДЬ ПО ХИМИИ
|
Задание у преподавателя |
|
|
Химические свойства солей |
Задание у преподавателя |
|
|
Химические свойства оснований |
финиш |
|
|
Задание
|
||||||||||||
|
1 |
Химические свойства кислот. 1.Продолжите УХР 1.Реакция нейтрализации HCL+Cu(OH)2= 2 взаимодействие с оксидами металлов Fe2O3 +H2 SO4= 3. взаимодействие с металлами Mg+H2 SO4= 4. Взаимодействие с солями CaCL2+H3PO4=
2.Заполните таблицу
|
||||||||||||
|
2 |
Химические свойства солей. 1.Продолжите УХР 1.с металлами
Fe+СuSO4 = 2 взаимодействие с основаниями СuSO4+Ba(OH)2= 3. Взаимодействие с солями BaCL2+FeSO4=
2.Заполните таблицу
|
||||||||||||
|
3 |
Химические свойства оснований. 1.Продолжите УХР 1.Реакция нейтрализации HCL+Cu(OH)2= H2 SO4+Cu(OH)2= 2 взаимодействие с оксидами неметаллов NaOH+CO2= 3. Взаимодействие с солями Ba(OH)2+Na2SO4=
2.Заполните таблицу
|
Ключевые фразы:
|
NaOH |
|
H2C03 |
|
HNO2 |
|
Al 2(SO4)3 |
Задания
Третий лишний
BaCl2, H3PO4, H Cl
BaCl2, AlPO4, H Cl
Ba(OH)2, Al(OH)3, H Cl
Ba(OH)2, Al(OH)3, KOH
Вопросы
Какой элемент входит в состав всех оксидов?
Самый известный оксид?
Какой элемент входит в состав всех кислот?
Формула углекислого газа?
Формула гидроксидной группы?
Определение кислот с точки зрения электролитической диссоциации?
Формула поваренной соли.
Формула серной кислоты.
ЗАПОЛНИТЕ ТАБЛИЦУ
|
|
Класс вещества |
Название |
Mr |
W(%)O |
|
NaOH |
|
|
|
|
|
HCl |
|
|
|
|
|
NO2 |
|
|
|
|
|
Al 2(SO4)3 |
|
|
|
|
НАПИШИТЕ УРАВНЕНИЯ ДИССОЦИАЦИИ
BaCl2, H3PO4, H Cl, Ba(OH)2, Al(OH)3
ПРОДОЛЖИТЕ УХР
BaCl2 + H2SO4=
Al2 (SO4)3+ KOH=
ZnSO4+KOH=
BaCl2 + H3PO4=
КЛЮЧ
BaCl2 + H2SO4=Ba SO4+ HCl
Al2 (SO4)3+ 6KOH= 2Al(OH)3+ 3K2SO4
ZnSO4+2KOH= Zn(OH)2+ K2SO4
3BaCl2 + 2H3PO4=Ba3(PO4)2+ 6HCl
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.