

Углеводороды с открытой цепью, в молекулах которых между атомами углерода имеются

Ациклические углеводороды, содержащие в молекуле , помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле - СnH2n
|
Формула |
Название |
|
C2H4 |
Этен (этилен) |
|
C3H6 |
Пропен (пропилен) |
|
C4H8 |
Бутен |
|
C5H10 |
Пентен |
|
C6H12 |
Гексен |
|
C7H14 |
Гептен |
|
C8H16 |
Октен |
|
C9H18 |
Нонен |
|
C10H20 |
Децен |
Ø По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен.
Ø Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
Ø Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
Ø Цифра, обозначающая положение двойной связи, ставится обычно после суффикса.
4 3 2 1
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2метилпропен) и т.п.
ИЗОМЕРИЯ (Углеродного скелета)
 H2C
H2C![]() CH
CH
![]() CH2
CH2 ![]() CH3
H2C
C
CH3
H2C
C ![]() CH3
CH3
бутен-1
2-метилпропен
ИЗОМЕРИЯ (Кратных связей)
бутен-1 бутен-2
ИЗОМЕРИЯ (Межклассовая)
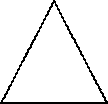
пропен циклопропан
|
H H цис-бутен-2 (Е)-бутен-2 |
H CH3 транс-бутен-2 (Z)-бутен-2 |
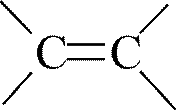
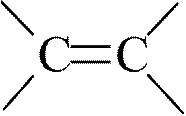 H3CCH3 H3CH
H3CCH3 H3CH
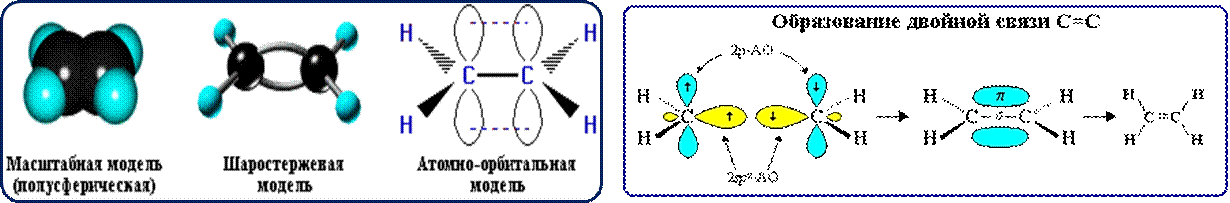
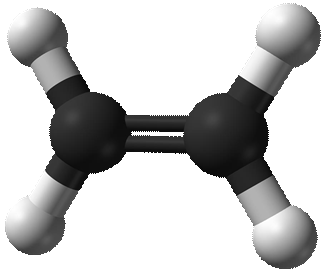
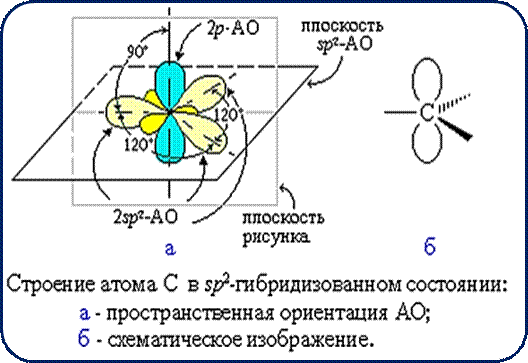 Двойная связь (σ-связь, π-связь) sp2 -
гибридизация
Двойная связь (σ-связь, π-связь) sp2 -
гибридизация
Валентный угол -1200
Длина С-С связи – 0,134 нм
Форма молекулы – плоскостная (треугольная)
ØАгрегатное состояние:
С2 – С4 – газы
С5 – С17 – жидкости
С18 – твердые вещества
Ø Плохо растворимы в воде, но хорошо растворяются в органических
растворителях
ØС увеличением молекулярной массы алкенов, в гомологическом ряду,
повышаются температура кипения и плавления, увеличивается
плотность веществ
1. Реакции присоединения:
Ø Гидрирование
Ø Галогенирование
Ø Гидрогалогенирование
Ø Гидратация
2. Реакции окисления
Ø Горение
Ø Католитическое окисление
3. Реакция полимеризации
Алкены легко присоединяют водород при нагревании и повышенном давлении в присутствии катализаторов
или порошкообразного никеля с образованием алканов.
При комнатной температуре и обычном давлении алкены присоединяют водород в присутствии
катализатора Уилкинсона – ((C6H5)3P)3RhCl
H2C![]() CH2
+
H2
CH2
+
H2
![]() Ni CH3
Ni CH3
![]() CH3
CH3
этилен этан
Галогены присоединяются к алкенам с образованием вицинальных дигалогенопроизводных, т.е. содержащих атомы галогена у соседних атомов углерода
![]() H2C
H2C![]() CH2+
Br2
CH2+
Br2 ![]() CH2
CH2 CH2
CH2
BrBr
1,2-дибромэтан
Реакция идет по механизму электрофильного присоединения (АЕ).
Быстрое обесцвечивание коричневой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие кратных углерод-углеродных связей.
Галогеноводороды присоединяются к алкенам с образованием галогеналкилов. Присоединение в случае несимметричных молекул идет по правилу Марковникова
H2C![]() CH2
+ HCl
CH2
+ HCl ![]() CH3
CH3 CH2
CH2
Cl хлорэтан
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей.
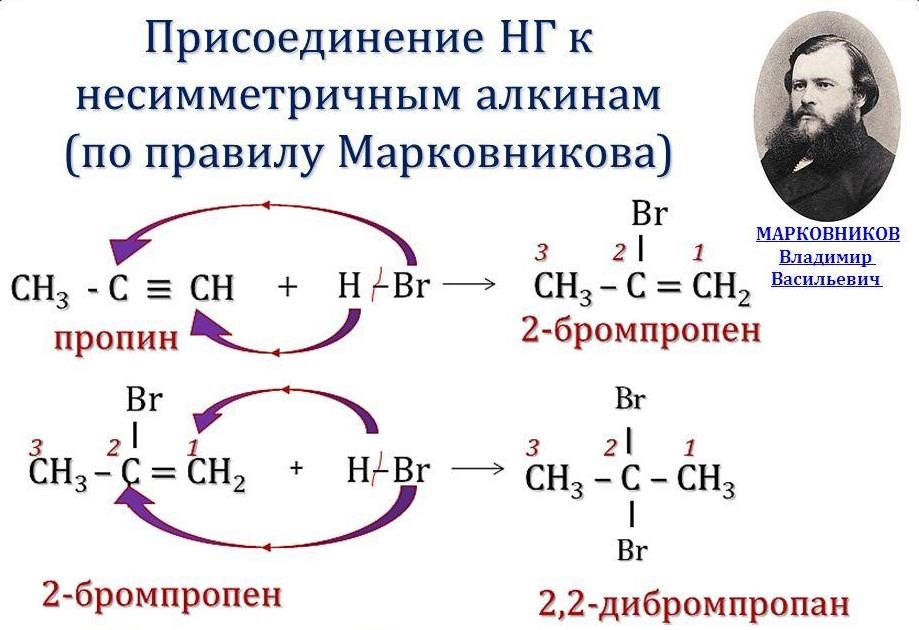 В случае присоединения
В случае присоединения
водородсодержащих соединений к
несимметричному
алкену атом водорода
присоединяется к наиболее
гидрированному (с
наибольшим числом водородных атомов) атому углерода,
стоящему при двойной связи
В присутствии минеральных кислот вода присоединяется по двойной
связи по правилу Марковникова
H2C![]() CH2
+
Н2О
CH2
+
Н2О
![]() CH3
CH3 CH2
CH2
OH
этанол
1. Горение
C2H4 + 3O2 → 2CO2 + 2H2O +Q
2. Окисление KMnO4 (реакция Вагнера)
![]() 3H2C
3H2C![]() CH2
+ 2KMnO4 + 4H2O
CH2
+ 2KMnO4 + 4H2O ![]() 3CH2
3CH2![]() CH2
+ 2KOH + 2MnO2
CH2
+ 2KOH + 2MnO2
OHOH
Мягкое окисление алкенов водным раствором KMnO4 приводит к образованию двухатомных спиртов.
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи.
Реакции полимеризации алкенов идут за счёт присоединения по кратным
связям
nH2C![]() CH2
CH2
 CH2
CH2
![]() CH2
CH2
n
полиэтилен
Число n в формуле полимера называется степенью полимеризации.
1. Реакция идет при пропускании спиртов над оксидом алюминия при 300 – 4000С
CH3 CH
CH
![]() CH2
CH2
![]() CH3
CH3
![]() 300 - 400[Al2O3]0C CH3
300 - 400[Al2O3]0C CH3
![]() CH
CH![]() CH
CH
![]() CH3
CH3
OH втор-бутиловый спирт бутен-2
2. При действии на спирты серной кислоты в мягких условиях (реакция идет через промежуточное образование эфиров серной кислоты)
CH3![]() CH
CH ![]() CH3
+
H2SO4
CH3
+
H2SO4
![]() -HOH CH3 CH3
-HOH CH3 CH3
![]() -H2SO4
CH3
-H2SO4
CH3
![]() CH
CH![]() CH2
CH2
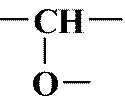 OH SO3H
OH SO3H
изопропиловый спирт
2. Из моногалогенопроизводных Дегидрогалогенирование
CH3![]() CH2
+ KOH
CH2
+ KOH ![]() H2C
H2C![]() CH2
+ KCl + H2O
CH2
+ KCl + H2O
Cl спиртовойраствор
Cl
CH3
 C CH2
C CH2
![]() Mg CH3
Mg CH3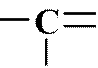 CH2+
MgCl2
CH2+
MgCl2
CH3Cl CH3
1,2-дихлор-2-метилпропан изобутилен
Дегидрирование t0
CH3
![]() CH3
CH3
![]() Ni H2C
Ni H2C![]() CH2
+
H2
CH2
+
H2
5. Крекинг нефтепродуктов
C16H34
![]() t0 C8H18
+ C8H16
t0 C8H18
+ C8H16
октан октен

 ØПолучение
горючего
ØПолучение
горючего
ØПолучение пластмасс
ØПолучение взрывчатых веществ
ØПолучение растворителей
ØДля ускорения созревания фруктов

 ØПолучение
ацетальдегидов
ØПолучение
ацетальдегидов
ØПолучение синтетического каучука
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.