
ISSN(Print) 2616-7034
ISSN(Online) 2663-130Х
Л.Н. Гумилев атындағы Еуразия ұлттық университетiнiң
![]()
|
BULLETIN of L.N. Gumilyov Eurasian National University |
ВЕСТНИК Евразийского национального университета имени Л.Н. Гумилева |
БИОЛОГИЯЛЫҚ ҒЫЛЫМДАР сериясы
BIOSCIENCE Series
Серия БИОЛОГИЧЕСКИЕ НАУКИ
№2(127)/2019
1995 жылдан бастап шығады
Founded in 1995
Издается с 1995 года
Жылына 4 рет шығады
Published 4 times a year
Выходит 4 раза в год
Нұр-Сұлтан, 2019
Nur-Sultan, 2019
Нур-Султан, 2019
Л.Н. ГУМИЛЕВ АТЫНДАҒЫ ЕУРАЗИЯ ҰЛТТЫҚ УНИВЕРСИТЕТIНIҢ ХАБАРШЫСЫ. БИОЛОГИЯЛЫҚ ҒЫЛЫМДАР СЕРИЯСЫ
2(127)/2019
МАЗМҰНЫ
|
Аленова А.А., Ильдербаев О.З. Радиацияның кейiнгi мерзiмдегi әсерiнен антиоксиданты жүйедегi өзгерiстер |
8 |
|
Овэс Е.В., Аникина И.Н., Гаитова Н.А., Кайниденов Н.Н., Сейтжанова Д.Д. In vitro өсiмдiк көбейту процесiнде картоп сорттарының пiсу тобының әсерi |
17 |
|
Ромаданова Н.В., Эшбакова К.А., Карашолакова Л.Н., Махмутова И.А., Абидкулова К.Т., Кушнаренко С.В. Berberis iliensis және Berberis integerrima жемiстерi экстрактiлерiн сапалық және сандық құрамын зерттеу, генетикалық материалды криобанкте сақтау |
22 |
|
Тагаев Д.А., Шахина Б.А. Шығыс Қазақстандағы Ертiс өзенiнiң Phoxinus рhoxinus (Linnaeus,1758) кәдiмгi гольянның морфологиясына талдау |
37 |
|
Конкабаева A.E., Муханова Ш.А., Тыкежанова Г.М., Нугуманова Ш.М. Мыс қосылыстарының ми ұлпасына артық немесе жеткiлiксiз түскен кездегi неврологиялық бұзылулардағы рөлi |
43 |
|
Утарбаева Н.А., Аманова Р.П., Қалиева А.Қ., Бисалыева Р.Н. Ағаш тозаңдарының көлемi мен фертильдiлiгi арасындағы корреляциялық байланыс |
53 |
|
Улекешова Г., Динмухамедова А.С. Мұғалiмдердiң морфофункционалды және психофизиологиялық көрсеткiштерi |
58 |
5
BULLETIN OF L.N. GUMILYOV EURASIAN NATIONAL UNIVERSITY. BIOSCIENCE
SERIES
2(127)/2019
CONTENTS
|
Alenova A.A., Ilderbayev O.Z. Changes in the antioxidant system under the action of radiation in the long term period |
8 |
|
Oves E.V., Anikina I.N., Gaitova N.A., Kainidenov N.N., Seitzhanova D.D. The influence of the group of maturity of potato varieties in the process of replication of plants in vitro |
17 |
|
Romadanova N.V., Eshbakova K.A., Karasholakova L.N., Machmutova I.A., Abidkulova K.T., Kushnarenko S.V. Study of quality and quantitative composition of Berberis iliensis and Berberis integerrima fruits extracts, preservation of the genetic material in cryobank |
22 |
|
Tagayev D.A., Shakhina B.A. On morphology of the Eurasian minnow Phoxinus phoxinus (Linnaeus, 1758) from the Irtysh River in East Kazakhstan |
37 |
|
Konkabaeva A.E., Mukhanova Sh.A., Tykezhanova G.M., Nugumanova Sh.M. The role of copper compounds in neurological disorders due to their excessive or insufficient supply to the brain tissue |
43 |
|
Utarbayeva N.A., Amanova R.P., Kaliyeva A.K., Bisalyeva R.N. Correlation between pollen fertility of woody plants |
53 |
|
Ulekeshova G., Dinmukhamedova A.S. Morphofunctional and psycho-physiological indicators of teachers |
58 |
6
ВЕСТНИК ЕВРАЗИЙСКОГО НАЦИОНАЛЬНОГО УНИВЕРСИТЕТА ИМЕНИ Л.Н.ГУМИЛЕВА. СЕРИЯ БИОЛОГИЧЕСКИЕ НАУКИ
2(127)/2019
СОДЕРЖАНИЕ
|
Аленова А.А., Ильдербаев О.З. Изменения в антиоксидантной системе при действии радиации в отдаленном периоде |
8 |
|
Овэс Е.В., Аникина И.Н., Гаитова Н.А., Кайниденов Н.Н., Сейтжанова Д.Д. Влияние группы спелости сортов картофеля в процессе тиражирования растений in vitro |
17 |
|
Ромаданова Н.В., Эшбакова К.А., Карашолакова Л.Н., Махмутова И.А., Абидкулова К.Т., Кушнаренко С.В. Исследование качественного и количественного состава экстрактов мякоти плодов berberis iliensis и berberis integerrima, сохранение генетического материала в криобанке |
22 |
|
Тагаев Д.А., Шахина Б.А. К морфологии обыкновенного гольяна Phoxinus phoxinus (Linnaeus, 1758) из р. Иртыш в Восточном Казахстане |
37 |
|
Конкабаева A.E., Муханова Ш.А., Тыкежанова Г.М., Нугуманова Ш.М. Роль соединений меди в неврологических нарушениях при избыточном или недостаточном поступлении в мозговую ткань |
43 |
|
Утарбаева Н.А., Аманова Р.П., Қалиева А.Қ., Бисалыева Р.Н. Корреляция между размерами пыльцы и фертильности древесных растений |
53 |
|
Улекешова Г., Динмухамедова А.С. Морфофункциональные и психофизиологические показатели учителей |
58 |
7
МРНТИ 68.35.53; 31.27.21; 62.99.37
Н.В. Ромаданова1 , К.А. Эшбакова2 , Л.Н. Карашолакова1,3 , И.А. Махмутова1 , К.Т. Абидкулова3 , С.В. Кушнаренко1
1 РГП «Институт биологии и биотехнологии растений» КН МОН РК, г. Алматы, Республика Казахстан,
2 Институт химии растительных веществ им. акад. С.Ю. Юнусова АН РУ, г. Ташкент, Республика Узбекистан,
3 Казахский национальный университет имени аль-Фараби, г. Алматы, Республика
Казахстан
(E-mail: nata_romadanova@mail.ru, e_komila@yahoo.com, lyazzat.karasholakova@gmail.com, bio-2013@list.ru, karime_58@mail.ru, svetlana_bio@mail.ru)
Исследование качественного и количественного состава экстрактов мякоти плодов berberis iliensis и berberis integerrima, сохранение генетического материала в криобанке
Аннотация: Проведено изучение и сохранение двух видов барбариса: барбарис илийский (Berberis iliensis M. Pop.) и барбарис цельнокрайний (Berberis integerrima Bunge). В результате работ по введению в культуру in vitro и микроклональному размножению создана коллекция in vitro этих видов, состоящая из 33 образцов. Полученная коллекция in vitro заложена на среднесрочное хранение при температуре 4 ◦ С, освещенность 10 µмол м −2 с −1 , фотопериод -16/8 час. Оптимальная продолжительность хладохранения составляет 12 месяцев. Создан криобанк апикальных меристем и семян. Криобанк семян заложен при температурах: 1) 196 ◦ С, всхожесть семян после размораживания – 80-100%; 2) -20 ◦ С, всхожесть семян после размораживания в среднем составляет 86,7%. Выявлено положительное влияние хранения при низких температурах на всхожесть семян. Для исследования качественного и количественного состава изучены 11 образцов двух исследуемых видов барбариса, в которых выявлены жирные кислоты, эфиры жирных кислот, алканы, алкены, алкадиены, ароматические углеводороды, альдегиды, жирные спирты, тритерпеноиды, кетоны, силиконы, витамины К, К 1 , К2 . В некоторых образцах обнаружен каротиноид сквален, углеводород 28-Nor-17-alpha и амид Пиридин-3-карбоксимидамид.
Ключевые слова: Berberis iliensis, Berberis integerrima, коллекция in vitro, семена, апикальные меристемы, криосохранение, фитохимический анализ.
DOI: https://doi.org/10.32523/2616-7034-2019-127-2-22-36
Введение. В Казахстане произрастает 8 дикорастущих видов барбариса в Зайсане, Алтае и Тарбагатае, Джунгарском, Заилийском и Кунгей Алатау, Чу-Илийских горах. Это в основном кустарники, плоды, листья, кора, древесина и коренья которых обладают различными полезными свойствами [1-2]. Барбарис илийский (Berberis iliensis M. Pop.) произрастает в ущельях восточной части Заилийского Алатау, Кетменского хребта, Джунгарского Алатау, в устьях рек Чилик, Чарын, впадающих в реку Или. Барбарис цельнокрайний (Berberis integerrima Bunge) произрастает в Тянь Шане, Памиро-Алтае, в горах Каратау [3-4].
Барбарис илийский – это редкий эндемичный вид, который занесен в Красную Книгу Казахстана [5-6]. География его произрастания в долине реки Или, на территории которой в последнее время, остро стоит вопрос о сокращении биоразнообразия тугайных лесов, после строительства Капчагайского водохранилища. Порядка 90% тугайных лесов уже утеряно, оставшиеся площади находятся в неудовлетворительном состоянии.
На данный момент поставлена задача сохранения уникальных видов, находящихся под угрозой исчезновения, а особенно эндемичных растений. Традиционные приемы сохранения генетических ресурсов в ботанических садах, заказниках, питомниках и т.д. не всегда надежны и эффективны, поэтому недостатки таких способов сохранения обусловили необходимость разработки биотехнологических методов консервации генофонда, такие как длительное сохранение генетического материала в криобанках [7-8].
В настоящее время во многих странах ведутся исследования в области изучения фитохимического состава [1, 9] и фармакологических свойств барбариса [1, 10]. Уже сейчас барбарис широко используется в мировой фармацевтической промышленности. В его основе изготавливаются лекарственные формы, биологически активные добавки, различные экстракты, настойки и сиропы. Препараты на основе барбариса оказывают обезболивающее, противовоспалительное, жаропонижающее, кровоостанавливающее, спазмолитическое, противоопухолевое, желчегонное действия, высокоэффективны для улучшения аппетита и укрепления иммунной системы, приносят значительную пользу при лечении заболеваний печени, гипертонии и других. Выявлено положительное влияние препаратов барбариса при лечении раковых заболеваний, сахарного диабета, ишемии мозга, сердечно-сосудистых заболеваний, бактериальных, вирусных заболеваний и многих других [1-2, 11-12].
На данный момент нет сведений о компонентном составе казахстанского барбариса, соответственно нет лекарственных препаратов казахстанского производства на его основе. Изучение фитохимического состава казахстанских видов барбариса послужит важной информацией для фармацевтической промышленности.
В статье приведены результаты изучения компонентного состава некоторых форм собранных в Казахстане и Узбекистане двух дикорастущих видов B. iliensis и B. integerrima. Приведены результаты о надежном сохранении этих образцов в криобанке, которые в дальнейшем могут послужить для проведения широкого спектра биологических исследований, а также для возможной последующей их реинтродукции в естественные места обитания.
Методы исследования. Объектами исследования являлись 46 образцов барбариса, собранных в разные периоды вегетации: 19 форм B. iliensis, 27 форм B. integerrima. Место сбора, год и высота над уровнем моря представлены в таблице (Таблица 1).
Сохранение гермоплазмы барбариса. Для сохранения использовали:
1. Семена, которые сохраняли при двух температурных режимах: а) -20 ◦ С – семена по 40200 штук запаковывали в пакеты из ламинированной фольги и закладывали на долгосрочное хранение в морозильную камеру (рисунок 1 A, Б); б) -196 ◦ С – семена по 20-100 штук погружали в криопробирки и закладывали на долгосрочное хранение в Дьюары с жидким азотом в криогенный банк (рисунок 1 В, Г).
2. Апикальные меристемы, изолированные из асептических побегов in vitro. Методика криоконсервации методом PVS2 витрификации подробно описана в статье Ромадановой Н.В. с соавторами [13]. Для сохранения использовали 20 апексов побегов. Опыт проводили в 3 повторностях (n=60). Статистическую обработку экспериментальных данных проводили по общепринятым методикам, описанным в пособии Г.Ф. Лакина и в программном пакете SYSTAT [14-15].
3. Хладохранение побегов in vitro барбариса. Среднесрочное сохранение побегов проводили в специализированных полиэтиленовых пакетах или культуральных сосудах при температуре 4 ◦ С, освещенность 10 µмол м −2 с −1 , фотопериод 16/8 час, на питательной среде Мурасиге и Скуга (МС) с 20 г/л сахарозы, 0,8 мг/л 6-бензиламинопурина (БАП), 0,02 мг/л индолилмасляной кислоты (ИМК), 1,75 г/л джелрайта, 4 г/л агара, рН 5,7.
Фитохимический анализ мякоти плодов барбариса. Исследование качественного и количественного состава экстрактов.
Предварительно высушенные плоды (200 г), очищенные от семян, обработали этанолом в соотношении 1:5 (сырье-реагент) 4-х кратно в течение 24 часов при комнатной температуре. Полученный экстракт после отгонки растворителя анализировали на газовом хроматографе Agilent 7890 A GC c квадрупольным масс-спектрометром Agilent 5975 inert MSD в качестве детектора.
Компоненты исследуемых экстрактов разделяли на кварцевой капиллярной колонке HP-SMS (30 м х 250 мкм х 0,25 мкм) с привитой неподвижной фазой 5% фенилметилтрисилоксаном в температурном режиме 50 ◦ С (2 мин) – 10 ◦ С/мин до 200 ◦ С (6 мин) – 15 ◦ С/мин до 290 ◦ С (15 мин). Объем вносимой пробы – 1 мкл, скорость потока подвижной фазы – 1,3 мл/мин. Компоненты идентифицировали на основании сравнения характеристик массспектров с данными электронных библиотек W8NO5ST.L.
Таблица1 – Формы барбариса, год, место сбора, высота над уровнем моря
|
Наименование образца |
Место сбора, год, орган растения |
Высота над уровнем моря (м) |
|
B. iliensis |
||
|
1 |
Пойма р. Чарын, Чарынский Национальный парк, 2014, (семена) r. Charyn flood plain, Charyn National Park, 2014, (seeds) |
1224 |
|
2 |
Пойма реки Или, с. Баканас, 2014, (семена) r. Ili floodplain, s. Bakanas, 2014, (seeds) |
388 |
|
3-8, 10-12 |
Пойма реки Или, ущелье Кербулак, 2014,2015(побеги, семена) r. Ili floodplain, Kerbulak gorge, 2014, (shoots, seeds) |
424-492 |
|
9 |
АО «Лесной питомник», п. Актогай. 2015, (побеги) “Forest Nursery” JSC, Almaty region, Aktogai s. 2015, (shoots) |
1410 |
|
13-19 |
Пойма р. Узын, ущ. Узын Каргалы, 2016, (семена) Floodplain of the r. Uzyn, Uzyn Kargaly g., 2016, (seeds) |
1990-2009 |
|
B. integerrima |
||
|
1-22 |
Пойма реки Зеравшан, Заравшанский заповедник, 2014 (семена) r. Zeravshan floodplain, Zaravshan Reserve, 2014 (seeds) |
831-853 |
|
23-27 |
Туркестанская область, Толебийский район, Сайрам-Угамский Национальный парк (СУНП), ущелье Каскасу, 2015 (семена) Turkestan region, Tolebi district, Sairam-Ugam National Park (SUNP), Kaskasu gorge, 2015 (seeds) |
1426-1434 |
Колориметрическим методом с применением реактива Фолина-Чокалтеу, где в качестве стандарта использовали галловую кислоту определяли содержание фенолов в экстракте, для чего получали экстракты из плодов барбариса: плоды помещали в колбу и добавляли равный объем метанола, закрывали фольгой и оставляли при комнатной температуре на 1-3 дня. Для расчета массы сухого экстракта метанол выпаривали на роторном испарителе. Для анализа 5 мг экстракта растворяли в 1 мл метанола. Приготовили разные концентрации галловой кислоты (1; 0,8; 0,6; 0,4; 0,2; 0,1; 0 мг/мл) в метаноле. Для реакции использовали 50 мкл образца + 3,9 мл бидист воды + 250 мкл Фолина-Чокалтеу, смесь перемешивали на вортексе и выдерживали в темноте 1-8 мин. Добавляли 750 мкл 20% Na 2 CO3 и инкубировали 2 часа при 25єС. Измерение оптической плотности проводили на спектрофотометре Shimadzu UV-1700 относительно воды при 760 нм. Для определения общего содержания флавоноидов в плодах барбариса смешивали 50 мкл экстракта растворенного в абсолютном этаноле, 50 мкл раствора AlCl3 и 1,15 мл абсолютного этанола. Полученную смесь инкубировали при 25 ◦ С в течение 40 мин в темноте, в качестве стандарта использовали кверцетин. Оптическую плотность измеряли относительно этанола на спектрофотометре Shimadzu UV-1700 при 415 нм [16-17].
Для определения моносахаридов была проведена бумажная хроматография (бумага марки Filtrak № 11) с использованием системы: н-бутанол: уксусная кислота: H 2 O (4: 1: 5,1) и нбутанол: пиридин (Py): H 2 O (6: 4: 3,2). Так как эта система моносахаридов не выявила, то был проведен гидролиз 2% раствором серной кислоты, нейтрализованной BaCO 3 . Полученный раствор упарили и провели бумажную хроматографию (бумага марки Filtrak № 11) твердой системы с использованием растворителей: н-бутанол: уксусная кислота: H 2 O (4: 1: 5,1)

А – семена в пакетиках из ламинированной фольги; Б – морозильная камера Sovitalprodmash CB107-S ШН - 0.7, температурный режим: (-18)-(-20) ◦ С; В – криобокс с криопробирками, заполненными семенами барбариса; Г – погружение держателей с криобоксами в Дьюар с жидким азотом при температуре -196 ◦ С Рисунок1 – Банк долгосрочного хранения семян барбариса
и н-бутанол: Py: H2 O (6: 4: 3,2). Для улучшения качества результатов на бумажную хроматографию распыляли анилин фталат.
Результаты обсуждения. В результате работ по введению в культуру in vitro и микроклональному размножению B. iliensis и B. integerrima создана коллекция in vitro растений, состоящая из 33 образцов [18-20] (рисунок 2 А). Полученная коллекция in vitro заложена на среднесрочное хранение при температуре 4 ◦ С, освещенность 10 µмолм −2 с −1 , фотопериод 16/8 час (рисунок 2 Б). Оптимальная продолжительность хладохранения составляет 12 месяцев.
Полученная коллекция in vitro также послужила основой для создания криобанка апикальных меристем барбариса при температуре -196 ◦ С. Методика PVS2 витрификации для барбариса основана на методике, оптимизированной для яблони и отличается небольшими модификациями [13, 21]. Процент регенерации меристем после криоконсервации составляет – 60-80%.
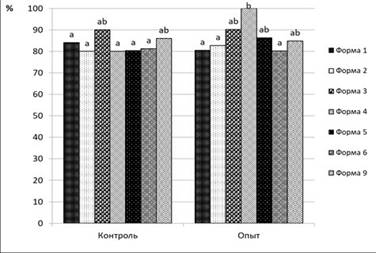
Для создания криобанка использовали также семена 17 форм барбариса цельнокрайнего и 11 форм барбариса илийского, которые заложили на долгосрочное хранение при температуре -20 ◦ С. Способность семян к прорастанию после хранения в течение 2 лет в среднем составляет 86,7%. Процент прорастания семян барбариса илийского после 2 летнего хранения в среднем составляет – 81,6%, это практически соответствует проценту прорастания свежесобранных семян – 83,1% (рисунок 3) [18]. Процент прорастания семян барбариса цельнокрайнего после 2 летнего хранения в среднем составляет – 91,8%, тогда как процент прорастания свежесобранных семян – 68,3% (рисунок 4). В результате чего можно сделать заключение, что хранение при пониженной температуре (-20 ◦ С) положительно сказывается на прорастание семян B. integerrima.

А – в светокультуральной комнате, температурный режим +24 ±1 ◦ С, освещенность 40 µмолм −2 с −1 , фотопериод 16/8 час; Б – в холодильнике, температурный режим 4 ◦ С, освещенность 10 µмолм −2 с −1 , фотопериод 16/8 час, продолжительность среднесрочного хранения 12 месяцев Рисунок2 – Коллекция барбариса in vitro
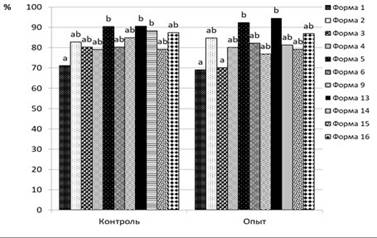
a, b – значения, которые различаются достоверно между собой при < 0,05
Рисунок 3 – Способность прорастания семян B. iliensis после хранения в течение 2 лет при температуре -20 ◦ С (опыт); прорастание свежесобранных семян (контроль)
a, b – значения, которые различаются достоверно между собой при p < 0,05
Рисунок 4 – Способность прорастания семян B. integerrima после хранения в течение 2 лет при температуре -20 ◦ С (опыт); прорастание свежесобранных семян (контроль)
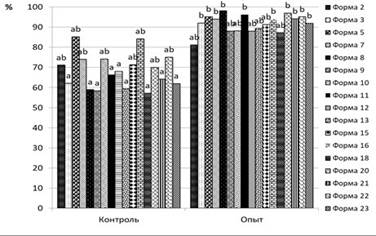
Семена 22 форм барбариса цельнокрайнего и 7 форм барбариса илийского, были заложены и на долгосрочное хранение в криогенный банк при температуре -196 ◦ С. Всхожесть семян после размораживания колеблется в пределах 80-100%. Процент прорастания семян барбариса илийского после 2 летнего хранения в среднем составляет – 86,4%, что несколько выше процента прорастания свежесобранных семян – 83,1% (рисунок 5) [18]. Процент прорастания семян барбариса цельнокрайнего после 2 летнего хранения в среднем составляет – 90,7%, что значительно выше процент прорастания свежесобранных семян – 70,3% (рисунок 6). В итоге хранение при сверхнизкой температуре -196 ◦ С увеличивает процент прорастания семян изученных видов барбариса.
a, b – значения, которые различаются достоверно между собой при p < 0,05
Рисунок 5 – Способность прорастания семян B. iliensis после хранения в течение 2 лет при температуре -196 ◦ С (опыт); прорастание свежесобранных семян (контроль)

a, b – значения, которые различаются достоверно между собой при p < 0,05
Рисунок 6 – Способность прорастания семян B. integerrima после хранения в течение 2 лет при температуре -196 ◦ С (опыт); прорастание свежесобранных семян (контроль)
Для исследования качественного и количественного состава готовили экстракты из 11 образцов барбариса. Компонентный состав плодов указан в таблицах (Таблица 2, 3), где ВУ – время удержания на газовом хроматографе.
Таблица2 – Компонентный состав плодов Berberis iliensis
|
Компоненты |
ВУ |
Содержание компонентов, % |
Класс хим-ких компонентов |
|||
|
Форма 2 |
Форма 3 |
Форма 4 |
Форма 9 |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Гексадекановая кислота |
17,535 |
1,42 |
6,61 |
3,12 |
|
Жирные кислоты |
|
цис-9-октадеценовая кислота |
18,559 |
|
1,10 |
1,29 |
|
|
|
Фталевая кислота |
22,338 |
0,13 |
0,12 |
|
|
|
|
Октадекановая кислота |
22,627 |
0,08 |
1,70 |
|
1,20 |
|
|
Тетрадекановая кислота |
23,626 |
|
0,07 |
|
0,03 |
|
|
Угольная кислота |
24,120 |
|
1,15 |
|
|
|
|
Гексакозановая кислота |
25,036 |
|
0,20 |
|
0,14 |
|
|
Октакозановая кислота |
26,562 |
0,48 |
|
0,56 |
|
|
|
Глицидилолеат |
21,747 |
0,18 |
|
|
0,11 |
Эфиры жирных кислот |
|
Е-11 (13 Метил) тетрадецен-1-ол ацетат |
22,942 |
|
|
0,36 |
|
|
|
Гептакозилацетат |
24,120 |
1,37 |
0,65 |
|
|
|
|
Тетракозил гептофлуоробутират |
25,545 |
0,24 |
|
0,18 |
|
|
|
Триаконтилацетат |
26,664 |
0,41 |
|
|
0,57 |
|
|
Эйкозан |
20,283 |
0,36 |
9,70 |
0,38 |
|
Алканы, Алкены 7 |
|
Октадекан |
21,899 |
|
0,46 |
|
|
|
|
Гептадекан |
21,899 |
0,49 |
|
|
|
|
Продолжение таблицы на следующей странице
Продолжение таблицы 2
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Пентакозан |
21,899 |
|
0,61 |
|
0,42 |
|
|
1-Нонадецен |
23,411 |
|
|
|
3,96 |
|
|
Окись этилена |
24,400 |
0,18 |
0,28 |
0,80 |
|
|
|
Нонакозан |
24,826 |
|
12,22 |
11,12 |
10,08 |
|
|
Тетракозан |
24,832 |
1,20 |
|
4,01 |
|
|
|
Генэйкозан |
24,838 |
|
2,07 |
|
|
|
|
Гептакоз-1-ен |
25,131 |
0,24 |
|
|
0,18 |
|
|
Нонакоз-1-ен |
25,589 |
0,16 |
|
|
|
|
|
Циклотетракозан |
23,420 |
|
5,41 |
|
2,18 |
Ароматичкие углеводороды |
|
Циклогексан |
27,237 |
|
0,62 |
|
|
|
|
Циклооктакозан |
28,255 |
|
|
0,56 |
|
|
|
3,4-Дигидроксифенилэтиленгликоль |
18,839 |
|
|
0,28 |
|
Альдегиды |
|
Октадеценовый альдегид |
21,747 |
|
0,25 |
1,28 |
|
|
|
1,30-Триконтанедиол |
27,606 |
|
0,24 |
|
0,76 |
Жирные спирты |
|
γ-Ситостерол |
28,789 |
0,32 |
|
|
|
Тритерпеноиды |
|
β-Ситостерол |
28,796 |
|
0,64 |
|
|
|
|
3 (2H) - фуранон |
22,663 |
1,12 |
|
|
|
Кетоны |
|
Нонакозан-10-он |
26,187 |
2,90 |
0,98 |
0,49 |
0,50 |
|
|
Фенол, 2,2’-метиленбис [6- (1,1-диметилэтил) -4-метил- |
21,377 |
|
|
|
0,06 |
Разное |
|
Сквален |
24,380 |
|
0,18 |
0,22 |
0,08 |
|
|
2-метил-1,4нафтохинон Филлохинон |
26,275 |
1,84 |
|
|
5,04 |
|
|
Пиридин-3карбоксимидамид |
27,224 |
|
1,29 |
1,08 |
|
Таблица3 – Компонентный состав плодов Berberis integerrima
|
Компоненты |
ВУ |
|
Содержание компонентов, % |
Класс хим-ких компонентов |
|||||
|
Форма 9 |
Форма 11 |
Форма 13 |
Форма 16 |
Форма 20 |
Форма 23 |
Форма 25 |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Циклогексанкарбоксиловая кислота |
20,124 |
|
|
|
0,18 |
|
|
|
Жирные кислоты |
|
9,12,15-октадекатриеновая кислота |
21,791 |
0,13 |
|
|
|
|
|
|
|
|
Фталевая кислота |
22,338 |
0,23 |
|
|
|
0,13 |
0,21 |
|
|
|
Эйкозановая кислота |
24,005 |
|
|
|
|
|
2,00 |
|
|
Продолжение таблицы на следующей странице
Продолжение таблицы 3
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Гидроксиметановая кислота |
24,120 |
|
0,11 |
0,06 |
|
|
|
|
|
|
2-хлорпропионовая кислота |
25,824 |
|
1,05 |
|
|
|
|
|
|
|
Глицидилолеат |
21,747 |
0,23 |
|
|
|
|
|
|
Эфиры жирных кислот |
|
Бис (2- этилгексил) фталат |
22,338 |
|
0,77 |
0,23 |
0,16 |
|
|
|
|
|
Е-11 (13 Метил) тет- радецен-1-ол ацетат |
22,942 |
|
|
0,32 |
|
|
|
|
|
|
Гептакозилацетат |
24,120 |
|
|
0,45 |
|
|
|
|
|
|
2-октадецилпропан-1,3диол |
24,387 |
|
|
|
0,27 |
|
|
|
|
|
Триаконтилацетат |
26,664 |
|
0,67 |
|
|
|
|
0,41 |
|
|
Гексакозан |
20,277 |
|
0,19 |
|
|
|
|
|
Алканы |
|
Эйкозан |
20,283 |
0,28 |
0,10 |
0,30 |
0,36 |
0,37 |
|
|
|
|
Октадекан |
21,899 |
0,24 |
1,07 |
0,51 |
|
0,11 |
|
7,06 |
|
|
Гептадекан |
21,899 |
|
1,20 |
|
|
|
|
|
|
|
Пентакозан |
24,119 |
|
2,90 |
1,40 |
|
|
|
|
|
|
3-метилдотриаконтан |
24,120 |
|
2,14 |
|
|
|
|
|
|
|
Oxirane |
24,400 |
|
|
|
0,14 |
|
|
0,49 |
|
|
Нонакозан |
24,826 |
|
|
12,99 |
|
10,15 |
5,65 |
|
|
|
Тетракозан |
24,832 |
14,03 |
0,99 |
0,37 |
8,29 |
|
0,20 |
0,70 |
|
|
Гептакозан |
24,838 |
|
9,51 |
|
|
|
|
|
|
|
Генэйкозан |
24,838 |
|
2,28 |
0,26 |
0,26 |
|
|
|
|
|
Тетрапентаконтан |
25,023 |
|
1,23 |
|
|
|
|
|
|
|
Триаконтан |
25,500 |
|
1,73 |
|
1,04 |
|
|
|
|
|
Z-14- Нонакозан |
26,664 |
1,20 |
1,37 |
1,26 |
0,63 |
|
1,26 |
|
|
|
2-метилтриаконтан |
32,454 |
|
1,93 |
|
|
|
|
|
|
|
1,1- Эйкозадиен |
19,999 |
0,39 |
|
0,39 |
|
0,52 |
0,41 |
|
Алкены Алкадиены Алкины |
|
5-Додецин |
21,899 |
|
|
|
|
|
0,24 |
|
|
|
1-Гексакозен |
23,305 |
|
0,49 |
|
|
|
|
|
|
|
1-Тетракозен |
23,401 |
|
|
|
|
|
4,15 |
|
|
|
1-Нонадецен |
23,411 |
|
3,92 |
|
3,33 |
4,21 |
|
|
|
|
1-Докозен |
24,202 |
|
0,19 |
6,84 |
|
|
|
|
|
|
Гептакоз-1-ен |
25,131 |
|
1,09 |
|
|
|
|
|
|
|
13-метил-Z- 14-нонакозен |
25,538 |
|
|
|
|
|
0,17 |
|
|
|
9-Трикозен |
25,545 |
|
1,24 |
0,34 |
|
1,90 |
|
|
|
Продолжение таблицы на следующей странице Продолжение таблицы 3
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Нонакоз-1-ен |
25,589 |
|
|
|
|
0,64 |
|
|
|
|
Циклооктакозан |
28,255 |
|
1,38 |
|
|
|
|
0,80 |
Ароматические углеводороды |
|
Циклогексан |
27,237 |
|
|
|
0,36 |
|
|
|
|
|
Докозаналь |
22,936 |
|
|
|
|
|
0,17 |
|
Альдегиды |
|
Тетракозаналь |
22,943 |
0,20 |
|
|
|
0,22 |
|
0,23 |
|
|
Пентадеканаль |
24,393 |
|
|
0,88 |
|
0,60 |
|
|
|
|
Октакозаналь |
25,825 |
0,50 |
|
0,71 |
0,44 |
0,98 |
|
|
|
|
Октакозанол |
21,855 |
0,12 |
|
|
|
|
|
|
Разное |
|
Сквален |
24,380 |
|
3,19 |
|
|
|
0,77 |
|
|
|
Нонакозан-10он |
26,187 |
0,49 |
0,87 |
0,49 |
0,29 |
0,32 |
0,17 |
2,68 |
|
|
2-метил-1,4нафтохинон Филлохинон |
26,275 |
|
|
|
0,02 |
|
|
|
|
|
28-Нор-17-α |
27,040 |
|
0,31 |
|
|
|
|
|
|
|
Пиридин-3карбоксимидамид |
27,224 |
|
0,05 |
|
|
|
|
|
|
|
γ-Ситостерол |
28,789 |
1,45 |
0,65 |
0,99 |
|
|
|
|
Во всех образцах барбариса обнаружены жирные кислоты, эфиры жирных кислот, алканы, алкены, алкадиены, ароматические углеводороды, жирные спирты, тритерпеноиды, кетоны, силиконы, витамины. В таких образцах, как: B. iliensis формы 3, 4, 9; B. integerrima формы 11 и 23 обнаружен каротиноид сквален. У B. integerrima формы 11 обнаружен также углеводород и пиридин-3-карбоксимидамид, который был также установлен в образцах барбариса илийского 3 и 4 формы. Витамин К (2-метил-1,4-нафтохинон Филлохинон) обнаружен у форм 2 и 9 барбариса илийского и у 16 формы барбариса цельнокрайнего. Тритерпеноид γ -ситостерол обнаружен у обоих видов (0,65-1,45) в барбарисе цельнокрайнем и (0,32) в барбарисе илийском формы 2.
Было выявлено, что компонентный состав плодов двух изученных видов барбариса различается по альдегидам (Таблица 2-3). Если в образцах B. iliensis идентифицированы такие альдегиды как 3,4-дигидроксифенилэтиленгликоль (0,28) и октадеценовый альдегид (0,25-1,28), то в образцах B. integerrima класс химических компонентов представлен другими альдегидами (октакозаналь – 0,44-0,98, тетракозаналь – 0,20-0,23, пентадеканаль – 0,60-0,88 и докозаналь – 0,17). Также 1,30-триконтанедиол (B. iliensis формы 3 и 9 – 0,24-0,76) и октакозанол (B. integerrima форма 9 – 0,12) являются единственными представителями жирных спиртов.
Общее содержание фенолов и флавоноидов в экстрактах плодов B. iliensis (формы 1, 2, 3) и B. integerrima (формы 7, 18, 20) определяли колориметрическими методами с использованием реактива Фолина-Чокалтеу и AlCl 3 (Таблица 4). Наивысшее содержание фенолов и флавоноидов обнаружено в экстрактах плодов форм 1 и 2 барбариса илийского, наименьшее содержание – у форм 7 и 18 барбариса цельнокрайнего. Содержание фенолов и флавоноидов в плодах барбариса илийского варьировало в пределах 0,055-0,152 и 0,013-0,045, что в 4-5,5 раз превышает его содержение плодах B. integerrima.
Результаты выражены как среднее значение трехкратной величины стандартного отклонения (±).
Концентрация образцов - 1 мг/мл.
Таблица 4 – Общее содержание фенолов и флавоноидов в экстрактах плодов Berberis iliensis и B.
Integerrima
|
Вид |
Форма |
Общее содержание фенолов (стандарт – галловая кислота) |
Общее содержание флавоноидов (стандарт – кверцетин) |
|
B. iliensis |
1 |
0,123 ± 0,003 |
0,045 ± 0,002 |
|
2 |
0,152 ± 0,004 |
0,035 ± 0,002 |
|
|
3 |
0,055 ± 0,001 |
0,013 ± 0,000 |
|
|
B. integerrima |
7 |
0,029 ± 0,002 |
0,009 ± 0,000 |
|
18 |
0,031 ± 0,001 |
0,010 ± 0,000 |
|
|
20 |
0,040 ± 0,002 |
0,011 ± 0,000 |
В образцах обнаружены также свободные моносахариды: глюкоза – 4,6%, галактоза – 0,5%, ксилоза – 0,6% арабиноза – 0,9% и неизвестные компоненты с различным ВУ и процентным содержанием. Анализируя полученные результаты можно сделать вывод, что в плодах барбариса обнаружен широкий спектр органических веществ, который и обуславливает в конечном итоге активность плодов самого растения. В изученной нами литературе такне приводятся данные об аналогичных химических компонентах в плодах различных видов барбариса, в том числе и в барбарисе цельнокрайнем. Различия можно отметить лишь по содержанию и количеству некоторых компонентов, так, например, нами не были выявлены витамины С и Е [22-23].
В последние время природные фенольные соединения привлекают всеобщее внимание исследователей и как объект химического изучения, и в качестве перспективных веществ для получения биологически активных препаратов и лекарственных средств. В научной литературе приводятся данные о том, что в основном действие фенольных веществ влияет на активность барбариса. Изучение фенольных соединений исследователями в разных странах показало, что эти вещества обладают разносторонним действием на организмы животных и человека, например, обладают антиаллергическими, антиканцерогенными, противовирусными и противовоспалительными свойствами, снижают риск сердечно-сосудистых заболеваний и уменьшают смертность от рака.
Кроме того, обнаруженный амид-пиридин-3-карбоксимидамид является, экстрагентом некоторых радиоактивных металлов и также, как и фенолы влияет на антиоксидантную активность [24]. Витамин К необходим для синтеза белков, обеспечивающих достаточный уровень свёртывания крови, играет значительную роль в обмене веществ в костях и в соединительной ткани, а также в работе почек, участвует в усвоении кальция и в обеспечении взаимодействия кальция и витамина D. Каротиноид сквален является промежуточным соединением в биологическом синтезе стероидов, в том числе и холестерина, к тому же он участвует в обмене веществ. Известно, что многие каротиноиды, в том числе и сквален выполняют функции антиоксидантов в организме человека.
В результате проведенной работы создан банк при пониженных температурах генетического материала двух видов барбариса, изучен их компонентный состав. Полученные данные послужат ценной информацией для различных биологических исследований, а также основой для получения новых фармацевтических препаратов широкого спектра действия.
Выводы.
1. В результате проведенных работ получена коллекция in vitro растений Berberis iliensis и Berberis integerrima, состоящая из 33 образцов, которая помещена на среднесрочное хранение (хладохранение) при температуре 4 ◦ С, освещенность 10 µмолм −2 с −1 , фотопериод 16/8 час. Оптимальная продолжительность хладохранения составляет 12 месяцев.
2. Создан криобанк апикальных меристем барбариса при температуре -196 ◦ С. Криоконсервация проведена методом PVS2 витрификации модифицированной для барбариса, процент регенерации меристем после криоконсервации составляет 60-80%.
3. Создан криобанк семян при температурах: -20 ◦ С (17 форм барбариса цельнокрайнего и 11 форм форм барбариса илийского), всхожесть семян после размораживания в среднем составляет 86,7% и -196 ◦ С (22 форм барбариса цельнокрайнего и 7 форм барбариса илийского). Всхожесть семян после размораживания колеблется в пределах 80-100%. Выявлено положительное влияние низкой и сверхнизкой температур на всхожесть семян после хранения в течение 2 лет.
4. Изучен компонентный состав 11 образцов барбариса. Во всех образцах барбариса обнаружены жирные кислоты, эфиры жирных кислот, алканы, алкены, алкадиены, ароматические углеводороды, жирные спирты, тритерпеноиды, кетоны, силиконы, витамины. В некоторых образцах обнаружен каротиноид сквален, углеводород 28-Нор-17- α, амид пиридин-3-карбоксиамид и витамины К, К 1 , К2 .
5. Колориметрическими методами определены общее содержание фенолов и флавоноидов вэкстрактах плодов 6 образцов барбариса: B. iliensis формы 1, 2, 3 и B. integerrima формы 7, 18, 20. Было установлено, что B. iliensis, особенно формы 1 и 2, отличается высоким содержанием фенолов и флавоноидов по сравнению с B. integerrima.
Благодарность. Работа выполнена в рамках проекта 1783/ГФ4 «Разработка технологии криогенного сохранения гермоплазмы ценных видов и форм барбариса – источника биологически активных веществ» по бюджетной программе: 217 «Развитие науки», подпрограмме 102 «Грантовое финансирование научных исследований».
1 Mokhber-Dezfuli N., Saeidnia S., Gohari A.R., Kurepaz-Mahmoodabadi M. Phytochemistry and Pharmacology of Berberis Species // Pharmacogn. Rev. - 2014. - Vol. 8(15). - P. 8-15. DOI: 10.4103/0973-7847.125517
2 Hosseinzadeh H., Ramezani M., Shafaei H., Taghiabadi E. Anticonvulsant effect of Berberis integerrima L. root extracts in mice // Journal Acupunct. Meridian Stud. - 2013. - Vol. (1). - P. 12-7. PMID:23433050, DOI:
10.1016/j.jams.2012.07.018.
3 Флора Казахстана. Т. III. - Алма-Ата, Изд-во АН КазССР. - 1960 - 55 с.
4 Байтенов М.С. Флора Казахстана. Родовой комплекс флоры. Т. 2. - Алматы, "Ғылым". - 2001. - С. 59.
5 Мухитдинов Н.М., Аметов А.А., Абидкулова К.Т., Ыдырыс А. Некоторые фитоценотические особенности популяций Berberis iliensis M. Pop // Вестник Иссык-Кульского университета. - 2010. - № 27. - С. 233-237.
6 Красная книга Казахстана. - Т. 2(1). Растения. Издание 2, исправленное и дополненное. - Астана, 2014. 452 с.
7 Reed B. M. The basics of in vitro storage and cryopreservation // National Clonal Germplasm Repository, Corvallis, O.R. USA. - 2002. - Р. 34-46. DOI: 10.17660/ActaHortic.2002.596.66.
8 Seeds for Our Future. The U.S. National Plant Germplasm System // United States Department of Agriculture, Agricultural Research Serv. - 1996. - 20 p.
9 Srivastava S., Srivastava M., Misra A., Pandey G., Rawat A. A review on biological and chemical diversity in Berberis (Berberidaceae) // EXCLI Journal. - 2015. - Vol. 14. - P. 247-267. PMID: 26535033 PMCID: PMC4614447 DOI: 10.17179/excli2014-399
10 Fatehi M., Saleh T.M., Fatehi-Hassanabad Z., Farrokhfal K., Jafarzadeh М., Davodi М. A pharmacological study on Berberis vulgaris fruit extract // Journal of Ethnopharmacology. - 2005. - Vol. 102, N. 1. - P. 46-52. PMID: 15993555 DOI: 10.1016/j.jep.2005.05.019
11 Lynch P.T., Benson E.E., Harding K. Climate change: the role of ex situ and cryo-conservation in the future security of economically important, vegetatively propagated plants // J. Horticultural Science & Biotechnology. 2007. - Vol. 82, N. 2. - P. 157-160. DOI: 10.1080/14620316.2007.11512213.
12 Engelmann F. Use of biotechnologies for the conservation of plant biodiversity // In Vitro Cellular & Developmental Biology. - 2011. - Vol. 47, N. 1, - P. 5-16. DOI: 10.1007/s11627-010-9327-2.
13 Romadanova N., Kushnarenko S., Karasholakova L. Development of a common PVS2 vitrification method for cryopreservation of several fruit // In Vitro Cellular & Developmental Biology. - 2017. - Vol. 53(4). - Р. 382-393. DOI:10.1007/s11627-017-9849-y.
14 Лакин Г.Ф. Биометрия: Учебное пособие для биол. спец. вузов / 4-е изд., перераб. и доп. - М.: Высш. школа, 1990. - 352 с.
15 SYSTAT (2007) SYSTAT 12.0, SYSTAT Software, Inc, San Jose, CA, pp. Statistics software.
16 Singleton V.L., Orthofer R., Lamuela-Ravento?s R.M. Analysis of total phenols and other oxidation substrates and antioxidantsby means of Folin-Ciocalteu reagent. In Methods in Enzymology Packer L.E. // Academic Press: San Diego, CA. - 1999. - Vol. 299. - P. 152-178. http://dx.doi.org/10.1016/S0076-6879(99)99017-1
17 Kosar M., Goger F., Baser, K.H.C. In vitro antioxidant properties and phenolic composition of Salvia halophila hedge from Turkey // Food Chemistry. - 2011. - Vol. 129. - P. 374-379. DOI: 10.1055/s-0031-1282693
18 Ромаданова Н.В., Мишустина С.А., Карашолакова Л.Н., Аралбаева М.М., Кабулова Ф.Д., Абидкулова
К.Т., Кушнаренко С.В. Введение в культуру in vitro дикорастущих видов Berberis флоры Казахстана
и Узбекистана // Вестник КазНУ, серия биологическая, №3 (65), 2015. - С. 346-354. DOI:
10.13140/RG.2.1.2178.0243
19 Ромаданова Н.В., Мишустина С.А., Карашолакова Л.Н., Аралбаева М.М., Рахимбаев И.Р., Кушнаренко С.В. Создание коллекции in vitro дикорастущих видов Berberis sp. // Бюллетень Государственного Никитского ботанического сада № 121. - 2016 г. - С. 69-76.
20 Ромаданова Н.В., Махмутова И.А., Карашолакова Л.Н., Христенко А.А., Кушнаренко С.В. Оптимизация микроклонального размножения барбариса // Биотехнология. Теория и практика. - №2. - 2017. - С. 47-55. DOI: 10.11134/btp.2.2017.7
21 Kushnarenko S., Romadanova N., Reed B. Cold acclimation improves regrowth of cryopreserved apple shoot tips // Cryo Letters. - 2009. - Vol. 30 (1). - P. 47-54. PMID: 19274311
22 El Hosry L., Boyer L., Garayev E.E., Mabrouki F., Bun S.S., Debrauwer L., Auezova L., Cheble Е., Elias R. Chemical Composition, Antioxidant and Cytotoxic Activities of Roots and Fruits of Berberis libanotica // Nat. Prod. Commun. - 2016. - Vol. 11(5). - P. 645-652. PMID: 27319140
23 Deepak P., Gopal G.V. Phytochemical profile of Berberis tinctoria Lesch. bark using GC-MS analysis // European Journal of Experimental Biology. - 2014. - Vol. 4(2). - P. 419-425.
24 Barclay L.R.C., Locke S.J., MacNeil J.M. Autoxidation in micelles - synergism of vitamin C with lipid-soluble vitamin-E and water-soluble trolox // Can. J. Chem. - 1985. - Vol.63 (2). - P. 366-374. https://doi.org/10.1139/v85062
Н.В. Ромаданова 1 , К.А. Ешбакова 2 , Л.Н. Карашолакова 1,3 , И.А. Махмутова 1 , К.Т. Абидкулова 3 , С.В. Кушнаренко 1
1 РМК «Өсiмдiктер биологиясы және биотехнологиясы институты» ҚР БҒМ ҒК, Алматы, Қазақстан, 2 акад.
С.Ю. Юнусов атындағы Өсiмдiктер химиясы институты ӨР ҒА Ташкент, Өзбекстан Республикасы
3 әл-Фараби атындағы Қазақ ұлттық университетi, Алматы, Қазақстан
Berberis iliensis және Berberis integerrima жемiстерi экстрактiлерiн сапалық және сандық құрамын зерттеу, генетикалық материалды криобанкте сақтау
Аңдатпа: Бөрiқарақаттың екi түрi (Berberis iliensis M. Pop және Berberis integerrima Bunge) зерттеу және сақтау жүргiзiлдi. In vitro культурасына енгiзу және микроклонды көбейту жұмыстарының нәтижесiнде аталған бөрiқарақат түрлерiнiң 33 үлгiсiнен тұратын in vitro коллекциялары жасалды. Алынған in vitro коллекция жарық 10 µ мол · м −2·c−1 , фотопериод 16/8 сағ, 4 ◦ C температурада орта мерзiмге сақтауға қойылды. Суықта сақтаудың оңтайлы ұзақтығы 12 айды құрайды. Апикальды меристемалар мен тұқымдардың криобанкi құрылды. Тұқымдар криобанкi келесi температураларда құрылған: 1) -196 ◦ C, ерiгеннен кейiнгi тұқымдардың өнгiштiгi – 80-100%; 2) -20 ◦ C, ерiгеннен кейiнгi тұқымдардың өнгiштiгi орта есеппен 86,7% құрады. Төмен температураларда тұқымдарды сақтау олардың өнгiштiгiне оң әсер ететiнi анықталды. Сапалық және сандық талдау жүргiзу үшiн бөрiқарақаттың 2 түрiнiң 11 үлгiсi зерттелдi. Оларда май қышқылдары, май қышқылдарының эфирлерi, алкандар, алкендер, алкадиендер, ароматты көмiрсутектер, альдегидтер, майлы спирттер, тритерпеноидтер, кетондар, силикондар мен К, К 1 , К 2 дәрумендерi анықталды. Кейбiр үлгiлерде сквален каротиноид, 28-Нор-17- α көмiрсутегi және пиридин-3-карбоксимидамид амид табылды.
Түйiнд сөздер: Berberis iliensis, Berberis integerrima, in vitro коллекциясы, тұқымдар, апикальды меристемалар, криосақтау, фитохимиялық анализ
N.V.Romadanova 1 , K.A. Eshbakova 2 , L.N. Karasholakova 1,3 , I.A. Machmutova 1 , K.T. Abidkulova 3 , S.V. Kushnarenko 1
( 1 Institute of Plant Biology and Biotechnology, Almaty, Republic of Kazakhstan,
2 Institute of the Chemistry of Plant Substances named acad. S. Yu Yunusov, Tashkent, Republic of Uzbekistan,
3 al-Farabi Kazakh National University, Almaty, Republic of Kazakhstan
Study of quality and quantitative composition of Berberis iliensis and Berberis integerrima fruits extracts, preservation of the genetic material in cryobank
Abstract: Two barberry species have been studied and preserved: Berberis iliensis M. Pop., Berberis integerrima Bunge. As a result of work the in vitro collection consisting of 33 accessions of these species was established. Obtaining in vitro collection was placed for medium-term storage at 4 ◦ C. Optimal duration of cold storage is 12 months. Cryobank of shoot tips and seeds was created. Cryobank of seeds created at temperatures: 1) -196 ◦ C, seeds germination after defrosting – 80100%; 2) -20 ◦ C, seed germination after defrosting the average is 86,7%. Positive effect of storage at low temperatures on seeds germination was revealed. To study the qualitative and quantitative chemical composition 11 accessions of two barberry species were investigated. Fatty acids, fatty acids esters, alkanes, alkenes, alkadienes, aromatic hydrocarbons, aldehydes, fatty alcohols, triterpenoids, ketones, silicones, vitamins K, K 1 , K 2 were identified in studied accessions. In some barberry accessions carotenoid squalene, hydrocarbons 28-Nor-17-alpha and amide pyridine-3-carboximidamide were detected.
Keywords: Berberis iliensis, Berberis integerrima, in vitro collection, seeds, shoot tips, cryopreservation, phytochemical analysis
1 Mokhber-Dezfuli N., Saeidnia S., Gohari A.R., Kurepaz-Mahmoodabadi M. Phytochemistry and pharmacology of Berberis species, Pharmacognosy Reviews, 8(15), 8-15(2014). doi: 10.4103/0973-7847.125517
2 Hosseinzadeh H., Ramezani M., Shafaei H., Taghiabadi E. Anticonvulsant effect of Berberis integerrima L. root extracts in mice, Journal of Acupuncture and Meridian Studies 1, 12-7(2013). doi: 10.1016/j.jams.2012.07.018 3 Pavlov N.V. (ed.) Flora Kazakhstana [Flora of Kazakhstan]. (Academy of Sciences of the Kazakh SSR, Alma-Ata, 1960, 477 p) [in Russian].
4 Baytenov M.S. Flora Kazakhstana. Rodovoy kompleks flory [Flora of Kazakhstan. Generic Flora Complex] (Gylym, Almaty, 2001, 400 p) [in Russian].
5 Mukhitdinov N.М., Ametov А.А., Abidkulova К.Т., Ydyrys А. Nekotoryye fitotsenoticheskiye osobennosti populyatsiy Berberis iliensis M.Pop. [Some phytocenotic features of populations of Berberis iliensis M.Pop], Vestnik Issyk-Kul’skogo universiteta [Bulletin of the Issyk-Kul University] 27, 233-237(2010).
6 Krasnaya kniga Kazakhstana [Red Book of Kazakhstan] (ArtPrintXXI, Astana, 2014, 452 р) [in Russian].
7 Reed B.M. The basics of in vitro storage and cryopreservation, National Clonal Germplasm Repository, Corvallis, O.R. USA, 34-46(2002) doi: 10.17660/ActaHortic.2002.596.66.
8 United States. Agricultural Research Service. Seeds for Our Future. The U.S. National Plant Germplasm System. United States Department of Agriculture, Agricultural Research Service, 1996, 20 p.
9 Srivastava S., Srivastava M., Misra A., Pandey G., Rawat A. A review on biological and chemical diversity in Berberis (Berberidaceae), EXCLI Journal, 14, 247-267(2015). doi: 10.17179/excli2014-399
10 Fatehi M., Saleh T.M., Fatehi-Hassanabad Z., Farrokhfal K., Jafarzadeh М., Davodi М. A pharmacological study on
Berberis vulgaris fruit extract, Journal of Ethnopharmacology, 102(1), 46-52(2005). doi: 10.1016/j.jep.2005.05.019
11 Lynch P.T., Benson E.E., Harding K. Climate change: the role of ex situ and cryo-conservation in the future security of economically important, vegetatively propagated plants, Journal Horticultural Science & Biotechnology, 82(2), 157-160(2007). doi: 10.1080/14620316.2007.11512213.
12 Engelmann F. Use of biotechnologies for the conservation of plant biodiversity, In Vitro Cellular & Developmental Biology, 47(1), 5-16(2011). doi: 10.1007/s11627-010-9327-2.
13 Romadanova N., Kushnarenko S., Karasholakova L. Development of a common PVS2 vitrification method for cryopreservation of several fruit, In Vitro Cellular & Developmental Biology, 53(4), 382-393(2017). doi:10.1007/s11627017-9849-y.
14 Lakin G.F. Biometriya [Biometrics] (Vysshaya shkola, M, 1990, 352 p) [in Russian].
15 SYSTAT (2007) SYSTAT 12.0, SYSTAT Software, Inc, San Jose, CA, pp. Statistics software.
16 Singleton V.L., Orthofer R., Lamuela-Ravento?s R.M. Analysis of total phenols and other oxidation substrates and antioxidantsby means of Folin-Ciocalteu reagent. In Methods in Enzymology Packer L.E., Academic Press: San Diego, CA. 299, 152-178(1999). http://dx.doi.org/10.1016/S0076-6879(99)99017-1
17 Kosar M., Goger F., Baser, K.H.C. In vitro antioxidant properties and phenolic composition of Salvia halophila hedge from Turkey, Food Chemistry,129, 374-379(2011). doi: 10.1055/s-0031-1282693
18 Romadanova N.V., Mishustina S.A., Karasholakova L.N., Aralbayeva M.M., Kabulova F.D., Abidkulova K.T., Kushnarenko S.V. Vvedeniye v kul’turu in vitro dikorastushchikh vidov Berberis flory Kazakhstana i Uzbekistana [Introduction to in vitro culture of wild species Berberis of flora of Kazakhstan and Uzbekistan], Vestnik KazNU. Seriya biologicheskaya [Bulletin of KazNU. Biological Series], 3(65), 346-354(2015). doi: 10.13140/RG.2.1.2178.0243
19 Romadanova N.V., Mishustina S.A., Karasholakova L.N., Aralbayeva M.M., Rakhimbayev I.R., Kushnarenko S.V. Sozdaniye kollektsii in vitro dikorastushchikh vidov Berberis sp. [Creation of an in vitro collection of wild species of Berberis sp], Byulleten’ Gosudarstvennogo Nikitskogo botanicheskogo sada [Bulletin of the State Nikitsk Botanical Garden], 121, 69-76(2016).
20 Romadanova N.V., Makhmutova I.A., Karasholakova L.N., Khristenko A.A., Kushnarenko S.V. Optimizatsiya mikroklonal’nogo razmnozheniya barbarisa [Optimization of microropagation of barberry], Biotekhnologiya. Teoriya i praktika. [Biotechnology. Theory and practice], 2, 47-55(2017). doi: 10.11134/btp.2.2017.7
21 Kushnarenko S., Romadanova N., Reed B. Cold acclimation improves regrowth of cryopreserved apple shoot tips, Cryo Letters, 30(1), 47-54(2009).
22 El Hosry L., Boyer L., Garayev E.E., Mabrouki F., Bun S.S., Debrauwer L., Auezova L., Cheble Е., Elias R. Chemical composition, antioxidant and cytotoxic activities of roots and fruits of Berberis libanotica, Natural Product Communication, 11(5), 645-652(2016).
23 Deepak P., Gopal G.V. Phytochemical profile of Berberis tinctoria Lesch. bark using GC-MS analysis, European Journal of Experimental Biology, 4(2), 419-425(2014).
24 Barclay L.R.C., Locke S.J., MacNeil J.M. Autoxidation in micelles - synergism of vitamin C with lipid-soluble vitamin-E and water-soluble trolox, Canadian Journal of Chemistry, 63(2), 366-374(1985).
https://doi.org/10.1139/v85-062
Сведения об авторах:
Ромаданова Н.В. – к.б.н., ведущий научный сотрудник в РГП «Институт биологии и биотехнологии растений» КН МОН РК, Алматы, Казахстан.
Ешбакова К.А. – к.х.н., старший научный сотрудник Института химии растительных веществ им. акад. С.Ю. Юнусова АН РУ, Узбекистан, Ташкент.
Карашолакова Л.Н. – PhD, заведующая кафедрой, Жетысуский государственный университет имени И.Жансугурова, Талдыкорган, Казахстан.
Махмутова И.А. – старший лаборант, РГП «Институт биологии и биотехнологии растений» КН МОН РК, Алматы, Казахстан.
Абидкулова К.Т. – старший научный сотрудник, Казахский национальный университет имени аль-Фараби, Алматы, Казахстан.
Кушнаренко С.В. – ассоциированный профессор, к.б.н., заведующая лабораторией, РГП «Институт биологии и биотехнологии растений» КН МОН РК, Алматы, Казахстан.
Romadanova N.V. – PhD, Leading Researcher, Institute of Plant Biology and Biotechnology, Almaty, Kazakhstan.
Eshbakova K.A. – PhD, Senior Researcher, Institute of the Chemistry of Plant Substances named acad. S. Yu. Yunusov, Tashkent, Uzbekistan.
Karasholakova L.N. – PhD, Head of Department, Zhetysu State University named after I.Zhansugurov, Taldykorgan, Kazakhstan.
Machmutova I.A. – Senior Assistant, Institute of Plant Biology and Biotechnology, Almaty, Kazakhstan.
Abidkulova K.T. – Senior Researcher, al-Farabi Kazakh National University, Almaty, Kazakhstan.
Kushnarenko S.V. – Associate Professor, Ph.D., Head of Laboratory, Institute of Plant Biology and Biotechnology, Almaty, Kazakhstan.
Поступила в редакцию 28.03.2019
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.