Урок позволяет обобщить знания о классификации и свойствах оксидов, на примере оксидов углерода. В ходе урока учащихся развивают способность к самостоятельному приобретению знаний, в ходе которой учащиеся отрабатывают навыки записи уравнений реакций, умения отражать сущность окислительно- восстановительных реакций методом электронного баланса.
Урок химии в 9 классе. «_____»___________________ 20____ г.
Оксиды углерода.
Цель. Обобщить знания о классификации и свойствах оксидов, на примере оксидов
углерода.
Задачи.
Образовательные: рассмотреть строение, свойства, получение и применение оксидов
углерода.
Развивающие: развивать способность к самостоятельному приобретению знаний;
продолжить отрабатывать навыки записи уравнений реакций, умение отражать сущность
окислительно восстановительных реакций методом электронного баланса.
Воспитательные: способствовать развитию познавательного интереса учащихся к
изучению химии.
Ход урока.
1. Орг. момент.
2. Повторение изученного материала.
1) Сравните углерод и азот по следующим параметрам: а) строение и размер атома;
б) возможные степени окисления; в) тип кристаллической решетки простого
вещества; г) агрегатное состояние простого вещества в обычных условиях; д)
наличие аллотропных модификаций; е) неметаллическая активность.
2) Запишите формулы веществ, состоящих из атомов углерода и: а) кислорода, б)
водорода, в) серы. Какой вид химической связи характерен для каждого
соединения?
3) Приведите примеры аллотропных видоизменений углерода. Чем они отличаются
друг от друга? Как доказать, что в состав каждого из них входит углерод?
4) Укажите, какие из перечисленных веществ являются аллотропными
модификациями углерода: кремнезем, алмаз, силикагель, графит, карбид,
карбин, карборунд, фуллерен. Для аллотропной модификации углерода,
обладающей наибольшей твердостью, рассчитайте: а) число атомов углерода и
количество (моль) углерода (N (C) = 6 ∙1021 ; n (C) = 0,01 моль); б) массу и
количество углерода, содержащего 3 ∙1023 атомов(m (C) = 6 г; n (C) = 0,5 моль );
в) массу углерода и число атомов углерода в 0,2 моль вещества ( m(C) = 2,4 г;
N(C) = 1,2 ∙1023).
5) Что такое адсорбция? Для каких веществ наблюдается это явление?
6) Укажите, какие свойства (окислительные или восстановительные) проявляет
углерод в реакциях с избытком: 1) оксида углерода (IV); 2) кислорода; 3)
водорода; 4) оксида железа (II); 5) кальция; 6) оксида меди (II); 7) алюминия; 8)
воды. Определите степень окисления углерода в продукте реакции.
7) Упр. 2,5 стр.172.
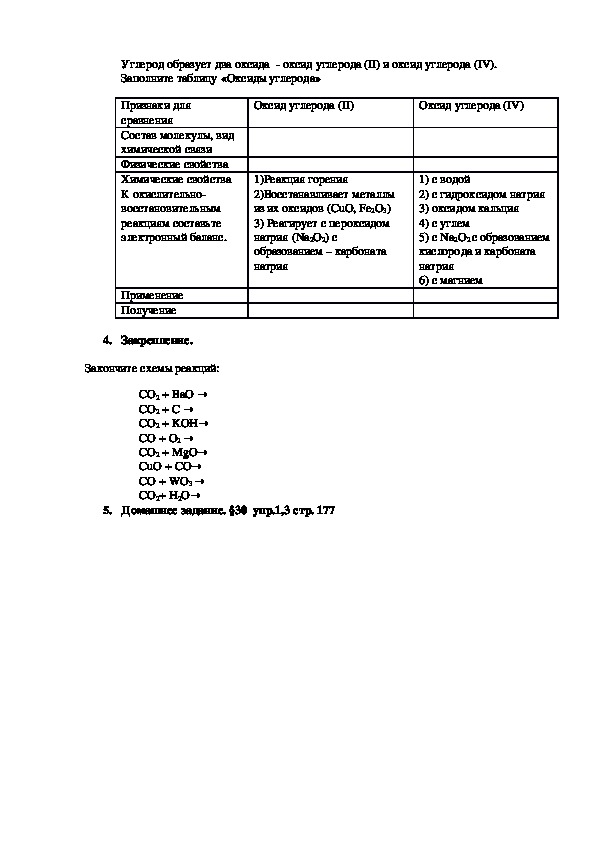
3. Изучение новой темы.Углерод образует два оксида оксид углерода (II) и оксид углерода (IV).
Заполните таблицу «Оксиды углерода»
Оксид углерода (II)
Оксид углерода (IV)
1)Реакция горения
2)Восстанавливает металлы
из их оксидов (CuO, Fe2O3)
3) Реагирует с пероксидом
натрия (Na2O2) с
образованием – карбоната
натрия
1) c водой
2) с гидроксидом натрия
3) оксидом кальция
4) с углем
5) с Na2O2 с образованием
кислорода и карбоната
натрия
6) с магнием
Признаки для
сравнения
Состав молекулы, вид
химической связи
Физические свойства
Химические свойства
К окислительно
восстановительным
реакциям составьте
электронный баланс.
Применение
Получение
4. Закрепление.
Закончите схемы реакций:
CO2 + BaO →
CO2 + C →
CO2 + KOH→
CO + O2 →
CO2 + MgO→
CuO + CO→
CO + WO3 →
CO2+ H2O→
5. Домашнее задание. §30 упр.1,3 стр. 177