
Классификация неорганических соединений Приборы и реактивы: аппарат Киппа; штатив с пробирками; горелка; керамическая плитка; прибор для получения оксида меди; микрошпатели; стеклянные палочки; стеклянные трубки, согнутые под прямым углом, для продувания углекислого газа; капельница с дистиллированной водой. Алюминий (стружка); оксид кремния (IV) (порошок); известковая вода. Растворы: соляной кислоты конц., 10%-й и 2н., гидроксида натрия 2 н., серной кислоты 2 н., сульфата алюминия 0,5 н., гидроксида аммония 1 н., хлорида олова (IV) 0,5 н., хлорида кобальта 1 н., сульфата меди (II) 2 н., иодида калия 1 н., сульфата натрия 2 н., гидроксида бария 6 н., нитрата свинца (II) 2 н., нитрата серебра 2 н., сульфата аммония 2 н., сульфата железа (II) 2 н., фенолфталеина, лакмуса.
Оксид меди (II) получается путем термического разложения карбоната гидроксида меди (II). Для этого собираем прибор, изображенный на рис. В пробирку 2 на 1/3 её объема насыпаем порошок карбоната гидроксида меди
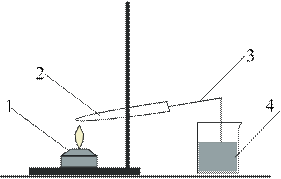 (II), закрываем
пробирку пробкой с газоотводной трубкой 3. Газоотводную трубку опускаем в
стакан с известковой водой 4. Нагреваем
пробирку 2 на пламени горелки 1.
(II), закрываем
пробирку пробкой с газоотводной трубкой 3. Газоотводную трубку опускаем в
стакан с известковой водой 4. Нагреваем
пробирку 2 на пламени горелки 1.
Нагревание проводим постепенно, в направлении от верха пробирки к её дну, до тех пор, пока весь карбонат гидроксида меди (II) не превратится в черный порошок.
Схема прибора для получения оксида Опыт 1.1
меди
|
Что наблюдается, почему |
Уравнения реакции |
|
Наблюдаем конденсацию паров воды на холодных частях пробирки и пробулькивание газа через раствор известковой воды в стакане. Известковая вода мутнеет, т.к. образуется не растворимый карбонат кальция |
2(Cu0H)2C03→ 4Cu0 + 2H20 + 2C02↑ C02+ Ca(0H)2→CaCO3↓+H2O |
Полученный в пробирке оксид меди (II) после охлаждения исследуем на химическую природу. Для этого в три пробирки помещаем по микрошпателю порошка CuO и добавляем по 10 капель: в первую пробирку дистиллированную воду, во вторую – раствор H2SO4, в третью – раствор NaOH. Наблюдаем. Каждую пробирку нагреваем до кипения на газовой горелке или спиртовке.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Комнатная температура Изменения происходят только во второй пробирке: растворяется черного цвета СиО, образуется раствор сульфата меди – синего цвета |
CuO + Н20 →не реагирует CuO + H2S04 →CuSO4+H2O CuO+ NaOH →нереагирует |
|
При нагревании в третьей пробирке образуется комплексная соль ярко-синего цвета |
CuO CuO CuO+ 2NaOH |
|
|
В чистую пробирку поместить 5-6 капель CuS04 и столько же NaOH.
|
Опыт 1.3 Что наблюдается, почему? |
Уравнение реакции |
|
Выпадает голубой осадок гидроксидамедиII. |
CuS04+ 2NaOH→Cu(OH)2↓ + 2Na2SO4 |
Полученный осадок Сu(ОН)2 разделить на 3 пробирки и добавить: 5-6 капель H2S04; NaOH (5-6 капель) соответственно, а третью нагреть.
|
Опыт 1.4 Что наблюдается, почему? |
Уравнения реакций |
|
|
Осадок растворится с образованием раствора синего цвета |
Cu(OH)2+ H2S04→ CuS04+ 2H2O |
|
|
Осадок постепенно растворяется с образованием тетрагидроксокупрата натрия |
Cu(OH)2+ NaOH → Na2[Cu(OH)4] тетрагидроксокупрат (II) натрия |
- |
|
Cu(OH)2 превратился в черный осадок оксида меди |
Cu(OH) |
|
В пробирку поместить 20 капель 0,5 М раствора Al2(SO4)3 и добавить столько же 1 н. раствора NH4OH.
|
Опыт 2.1 Что наблюдается, почему? |
Уравнение реакций. |
|
|
Выпадает студенистый нерастворимого алюминия |
белый осадок гидроксида |
A12(S04)3+ 6NH40H→2Al(OH)3↓+ 3(NH4)2S04
|
Содержимое разделить на три пробирки. В одну из пробирок при взбалтывании прибавить по каплям 10%-й раствор соляной кислоты до полного растворения осадка, во вторую прилить 10%-й раствор гидроксида натрия, тоже до полного растворения осадка. Третью пробирку нагреть на пламени горелки.
|
Опыт 2.2 Что наблюдается, почему? |
Уравнения реакций |
|
В 1 пробирке при взбалтывании осадок полностью растворяется. Во 2 пробирке при взбалтывании осадок полностью растворяется. Реакции в 1 и 2 пробирках подтверждают амфотерные свойства гидроксида алюминия. При нагревании на пламени горелки полностью разлагается гидроксид алюминия до оксида. |
А1(ОН)3 + НС1→ AlCl3 +3 H2O А1(ОН)3 + NaOH→Na3AlO3 + 3H2O
2А1(ОН) O |
Полученный Al2O3 разделить на три части и поместить в три пробирки. В первую добавить 5 – 8 капель 10%-гораствора HCl, во вторую – столько же 10%-го раствора гидроксида натрия (NaOH), в третью – дистиллированную воду. Затем пробирки нагреть.
|
Опыт 2.3 Что наблюдается, почему? |
Уравнения реакций |
|
Комнатная температура В 1 и 2 пробирках наблюдается растворение оксида алюминия. В 3 пробирке изменений не наблюдается. По химическим свойствам оксид алюминий является амфотерным. Он реагирует с кислотами, проявляя свойства основных оксидов.Реагируя сощелочами, он проявляет свойства кислотных оксидов. В растворах щелочей образуются комплексные соединения |
Al2O3+ 6HCl → 2AlCl3+ 3H2O. Al2O3+ 2KOH + 3H2O → 2K [Al(OH)4] А1203+ Н20 →не реагирует |
|
При нагревании Во второй пробирке при сплавлении оксида алюминия и щелочи образуются соли метаалюминиевои кислоты |
Al2O3 + 6HCl → 2AlCl3 + 3H2O. Al2O3 + 2KOH → 2KAlO2 + H2O А1203+ Н20 →не реагирует |
Для изучения характера свойств диоксида углерода налить в пробирку 10 – 15 капель дистиллированной воды и прибавить 1 – 2 капли лакмуса. Затем пропустить из аппарата Киппа в воду оксид углерода (IV) до изменения окраски раствора.
Поместить в две пробирки по микрошпателю оксида кремния (IV). В одну пробирку добавить 5 – 7 капель концентрированной щелочи, а в другую – столько же концентрированной соляной кислоты. Обе пробирки нагреть.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Лакмус приобретает красный цвет, что свидетельствует о наличии иона водорода Н+. При сплавлении SiO2сщелочамидиоксид кремния растворяется, образуется силикат Оксид кремния проявляет кислотные свойства |
С02 + Н20 + лакмус Н2О + СО2↑
Si02 + HC1→не реагирует
|
Опыт 4 Получение основной соли и перевод её в среднюю соль
Налить в пробирку 6 капель 1 н. раствора хлорида кобальта (II) и прилить к нему 4 капли 1 н. раствора NaOH.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Образуется основная соль хлоридгидроксокобальта (II) – осадок синего цвета |
CoCl2 + NaOH = CoOHCl↓ + NaCl |
Далее к полученной основной соли кобальта (II) добавить 2 – 3 капли 2 н. раствора соляной кислоты.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Соляная кислота растворяет осадок основной соли с образованием растворимой средней |
CoOHCl↓ + HCl→CoCl2 + H2O |
Налить в пробирку 10 – 15 капель насыщенного раствора гидроксида калия (известковой воды) и пропустить в данный раствор из аппарата Киппа несколько пузырьков оксида углерода (IV).
|
Что наблюдается, почему? |
Уравнение реакций |
|
При недостатке углекислого газанерастворимый карбонат кальция выпадает в осадок и раствор мутнеет. |
CO2 + Ca(OH)2→ CaCO3↓+ H2O
|
|
При избытке нерастворимый карбонат кальция переходит в растворимый гидрокарбонат кальция и раствор становится прозрачным. |
CaCO3 + H2O + CO2 → Ca(HCO3)2 |
Полученный раствор разделить на две пробирки. В одну пробирку добавить 2 капли насыщенного раствора гидроксида кальция. Раствор во второй пробирке нагреть до кипения.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Во всех случаях происходит образование осадка карбоната кальция – нерастворимой соли |
Са(НСОЗ)2 + Са(ОН)2 → 2CaCO3↓ + 2H2O
|
Какие еще способы вы могли бы предложить для получения кислых солей и, наоборот, для перевода кислых солей в нормальные?
1) KOH+H2SO4=KHSO4+H2O (гидросульфат калия)
2) KOH+H3PO4=KH2PO4+H2O (дигидрофосфат калия)
3) 2KOH+H3PO4=K2HPO4+2H2O (гидрофосфат калия)
4) Сa(HCO3)2+Na2CO3=CaCO3(осадок) + 2NaHCO3 (гидрокарбонат натрия)
5) NaCl(k)+H2SO4=NaHSO4+HCl(газ) (без температуры или слабое нагревание)
Способы получения солей Получить различные соли следующими способами.
1. Взаимодействие металла с кислотой. В пробирку налить 5 капель 6 н. серной кислоты и опустить алюминиевую стружку (можно микрошпатель алюминиевого порошка).
2. Взаимодействие гидроксида с кислотным оксидом. Налить в пробирку 10 капель насыщенного раствора гидроксида кальция. Продуть в раствор через согнутую трубку воздух изо рта.
3. Взаимодействие соли с металлом. Поместить в пробирку 10 капель 2 н. раствора сульфата меди (II) и поместить в раствор алюминиевую стружку.
4. Взаимодействие соли с неметаллом. Поместить в пробирку 10 капель 2 н. раствора иодида калия и 10 капель хлорной воды.
5. Взаимодействие соли с кислотой. Налить в пробирку 5 капель 2 н. раствора нитрата свинца (II) и 5 капель 2 н. раствора соляной кислоты.
6. Взаимодействие двух солей. Налить в пробирку 5 капель 2 н. раствора нитрата свинца (II) и 5 капель 2 н. раствора иодида калия.Добавить 10 – 15 капель дистиллированной воды. Нагреть до растворения осадка и охладить.
|
Что наблюдается, почему? |
Уравнение реакций |
|
Для ускорения реакции пробирку нагрели, наблюдаем выделение пузырьков газа Наблюдаем образование белого осадка, а при дальнейшем продувании растворение его. Через некоторое время раствор синего цвета обесцветился В случае реакции хлорной воды с раствором иодида калия образуется йод, и раствор приобретает коричневый цвет.Хлорнаявода выделяет из растворов йодидов свободный йод Образуется осадок нерастворимого хлорида свинца Образуется осадок нерастворимого иодида свинца При нагревании осадок рся, а при охлаждении опять выпадает. После охлаждения получаются блестящие золотистые кристаллы. |
Al + H2SO4(конц.
)
CO2 + Ca(OH)2 → CaCO3↓ + H2O CaCO3 + H2O + CO2 → Ca(HCO3)2
2Al + 3CuSO4→3Cu + Al2(SO4)3
КI+ НС1 + НС1O→I2↓+KCl+H2O
Pb(N03)2 + 2 HCl → PbCl2↓ + 2HNO3
Pb(N03)2 +КI →PbI2↓+KNO3
|
Налить в пробирку по 10 капель насыщенных растворов сульфата аммония и сульфата железа (II).
|
Что наблюдается, почему? |
Уравнения реакций |
|
Наблюдаем выпадение осадка двойной соли (NH4)2Fe(SO4)2·6H2O. Если осадок не появляется, то добиваемся этого потиранием стеклянной палочкой внутренней стенки пробирки. |
(NH4)2S04 + FeS04→(NH4)2Fe(SO4)2·6H2O |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.