
Лекция
Тема: Микробиологические основы химиотерапии
http://www.medcollegelib.ru/doc/ISBN9785970454824-0007.html?SSr=1301343e2b02570d582450889501497664
https://www.rlsnet.ru/mnn_index_id_216.htm
План
1. Химиотерапевтические средства (ХТС), основные группы.
2. Классификация ХТС по происхождению, химической структуре, спектру и механизму действия.
3. Общая характеристика механизмов устойчивости бактерий к антибактериальным препаратам.
4. Общая характеристика методов оценки антибиотикочувствительности
5. Требования, предъявляемые к антибиотикам.
6. Осложнения антибиотикотерапии.
7. Микробиологические основы рациональной антибиотикотерапии. Факторы антибактериального и антитоксического иммунитета, провоцирование хронического течения болезни и аллергизации организма.
Содержание
Химиотерапия инфекционных заболеваний — это лечение бактериальных, вирусных, грибковых, протозойных инфекций с помощью химиотерапевтических препаратов, которые избирательно подавляют жизнедеятельность соответствующих инфекционных агентов в организме человека. Избирательность действия химиотерапевтических препаратов заключается в губительном воздействии только на микроорганизмы, не затрагивая (или затрагивая минимально) клетки макроорганизма.
1. Химиотерапевтические средства, основные группы.
Антибактериальные препараты - химиотерапевтические средства природного, полусинтетического (синтетического) происхождения, избирательно подавляющие жизнедеятельность микроорганизмов (бактерий, грибов, простейших, вирусов, прионов). В зависимости от способа получения препараты разделяют на
1. Антибиотики -источник продукты метаболизма живых организмов (метаболиты)
2. Синтетические -источник химический синтез
3. Полусинтетические -источник модифицированные метаболиты
4. Классификация ХТС по
происхождению,
химической структуре,
спектру,
механизму действия.
По происхождению (по способу получения) различают ХТС:
1. природные - являются конечным продуктом метаболизма микроорганизмов и продуцируются клетками в питательную среду. Основными источниками получения антибиотиков служат микроорганизмы, обладающие антагонистической активностью: грибы, бактерии (особенно актиномицеты);
2. полусинтетические - получают путем биосинтеза с последующей модификацией молекул химических соединений при введении в них новых химических радикалов;
3. синтетические - аналоги природных антибиотиков, полученные путем химического синтеза.
Классификация по химической структуре
1.
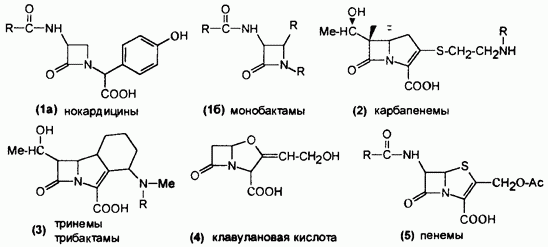
β-лактамные
- в химический структуре имеется β-лактамное кольцо. К ним относятся
пенициллины, цефалоспорины, монобактамы, карбапенемы. 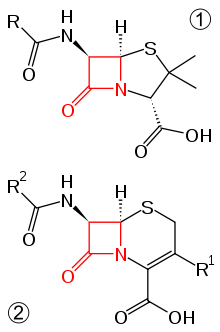
Рисунок 1 1- пенициллины, 2- цефалоспорины, β-лактамное кольцо выделено красным
2.
тетрациклины
- в химической формуле есть четыре бензольных кольца (тетрациклин,
доксициклин); 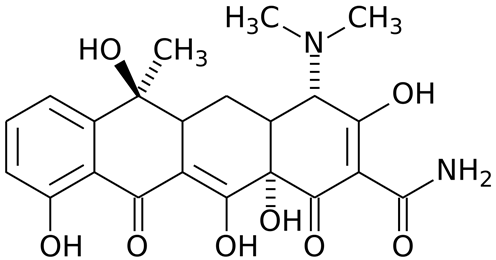
Рисунок 2 Тетрациклины
3. макролиды(14
-членные) – эритромицин и азолиды (15 членные) – азитромицин 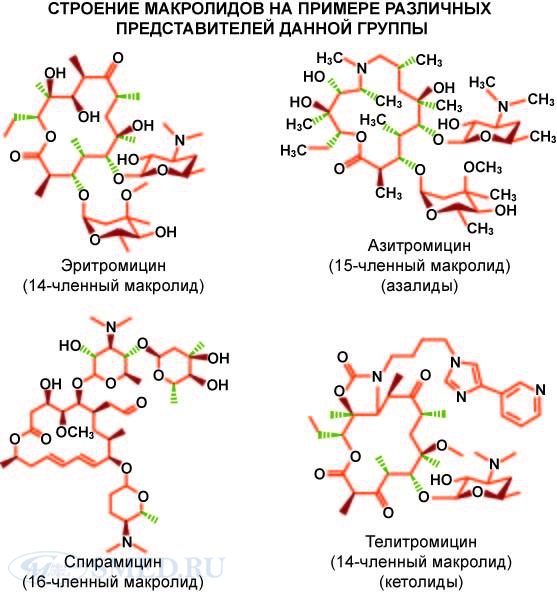
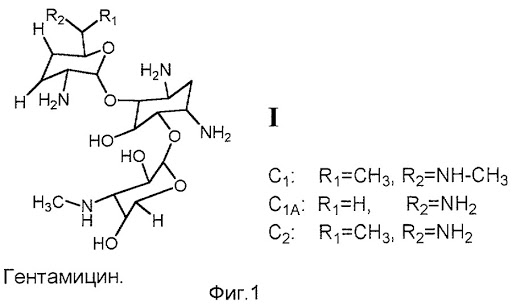
4. аминогликозиды
– стрептомицин, гентамицин; 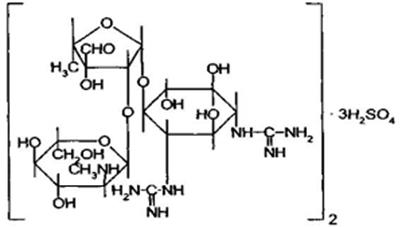
5. хлорамфеникол (левомицетин);
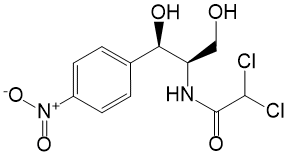
Рисунок 3 Хлорамфеникол
6. полиены
– нистатин, амфотерицин В; 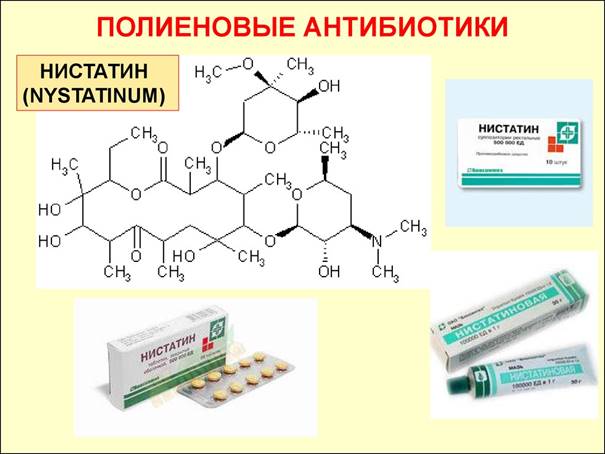
7. пептидные: полипептиды - полимиксин В, липопептиды - даптомицин - нарушают функции ЦПМ микроорганизмов, гликопептиды - ванкомицин - нарушают биосинтез клеточной стенки;
https://xumuk.ru/encyklopedia/2/3236.html
|
пептидные |
|
|
природные |
Полусинтетические |
|
ванкомицин |
Рифампицин |
|
Полимиксины В,М |
Рифампетин |
|
|
рифабутин |
рифампицины рифампицин) - блокируют синтез нуклеиновых кислот;
8. линкозамиды (син.: линкосамиды) — группа антибиотиков, в которую входят природный антибиотик линкомицин и его полусинтетический аналог клиндамицин.
Рисунок 4 Линкомицин
Рисунок 5 Клиндамицин
По характеру противомикробного действия:
1. бактериостатические
2. бактерицидные.
Бактериостатические препараты препятствуют размножению бактерий, приостанавливают рост и развитие микроорганизмов (эритромицин, олеандомицин, тетрациклины, хлорамфеникол).
Бактерицидные препараты вызывают гибель микроорганизмов (пенициллины, цефалоспорины).
По спектру действия
1. Препараты узкого спектра действия: действуют преимущественно на грамположительные бактерии (бензилпенициллина натриевая и калиевая соли, линкомицин) и на грамотрицательные бактерии (полимиксины, монобактамы).
2. Препараты широкого спектра действия (амоксициллин, ампициллин, цефалоспорины 3-го поколения, тетрациклины, аминогликозиды, макролиды и др.).
По механизму действия на микроорганизмы
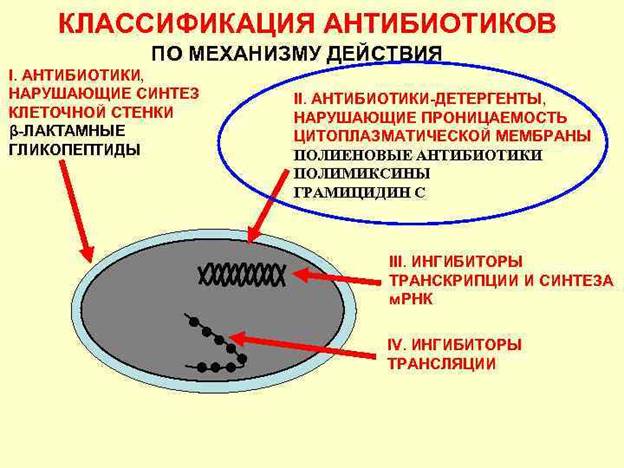
1. Ингибиторы синтеза клеточной стенки: β-лактамные препараты (пенициллины, цефалоспорины, карбапенемы, монобактамы) и гликопептиды.
2. Ингибиторы синтеза белка на рибосомах: связывающиеся с 30S субъединицей (аминогликозиды, тетрациклины); с 50S субъединицей (макролиды, линкозамиды, фениколы); необратимо связывающиеся с 30S и 50S субъединицей рибосом и нарушающие процесс образования 70S-комплекса (оксазолидиноны).
3. Ингибиторы проницаемости цитоплазматической мембраны (ЦПМ): полимиксины, полиеновые препараты.
4. Ингибиторы синтеза рибонуклеиновой кислоты: рифампицин.
Наиболее часто используют смешанную классификацию антибактериальных препаратов, основанную на спектре действия и химическом строении.
3. Общая характеристика механизмов устойчивости бактерий к антибактериальным препаратам.
Широкое применение антибактериальных препаратов сопровождено распространением бактерий, устойчивых к их действию. Результатом развития устойчивости микроорганизмов является ослабление или полное прекращение специфического действия препаратов при лечении инфекционных заболеваниях в течение определенного периода времени.
Устойчивость (резистентность) микроорганизмов к антибиотикам может быть природной и приобретенной.
Природная устойчивость является постоянным видовым признаком и связана с отсутствием у микроорганизмов мишени действия антибиотика или ее недоступностью. Например, β-лактамные антибиотики не действуют на микоплазмы, так как у этих микроорганизмов отсутствует клеточная стенка. Грамотрицательные бактерии, имеющие малопроницаемую для крупных молекул мембрану, устойчивы к пенициллинам.
Приобретенная устойчивость - свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть бактериальной популяции. Эта проблема весьма важна в медицине, особенно для борьбы с внутрибольничными инфекциями, вызываемыми высокорезистентными штаммами возбудителей. Формирование лекарственной устойчивости обусловлено генетически. Гены, кодирующие устойчивость к антибиотикам, могут располагаться как в хромосоме бактериальной клетки, так и в плазмидах и подвижных генетических элементах. Плазмиды могут передаваться между бактериями разных видов, поэтому может происходить быстрое внутри- и межвидовое распространение резистентности.
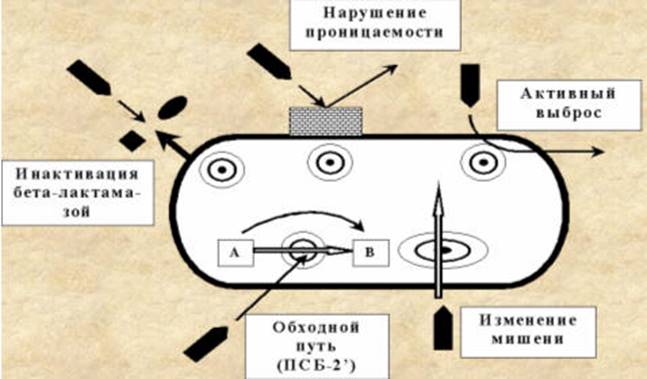
Устойчивость бактерий к антибиотикам может быть обусловлена:
1. изменением мишени действия (изменение структуры рибосом приводит к устойчивости к аминогликозидам);
2. активным выведением антибиотика из микробной клетки или нарушением проницаемости клеточных мембран;
3. инактивацией или модификацией антибиотика с помощью бактериальных ферментов (β-лактамазы разрушают β-лактамное кольцо антибиотиков с образованием неактивных соединений).
Развитию антибиотикоустойчивости микроорганизмов способствуют преждевременная отмена препарата, уменьшение его разовой или суточной доз.
Для предупреждения развития антибиотикоустойчивости необходимо:
1. определять чувствительность микроорганизма к химиотерапевтическим препаратам при назначении лечения;
2. применять антибиотики строго по показаниям;
3. использовать комбинированные препараты, имеющие в своем составе ингибиторы β-лактамаз (клавулановую кислоту), и препараты с разными мишенями действия;
4. по возможности назначать препараты узкого спектра действия, строго соблюдая дозы, концентрацию и продолжительность лечения.
4. Общая характеристика методов оценки антибиотикочувствительности

Метод диффузии в агар.
На поверхность плотной питательной среды с помощью шпателя наносят исследуемую культуру, выделенную от больного (посев «газоном»). Затем на агар помещают бумажные диски, пропитанные растворами антибиотиков. После инкубации в термостате определяют зону задержки роста микроорганизма вокруг каждого диска в миллиметрах. При зоне задержки роста менее 15 мм микроорганизм считается нечувствительным (малочувствительным) к данному антибиотику. При зоне задержки роста более 15 мм антибиотик может быть назначен данному больному.
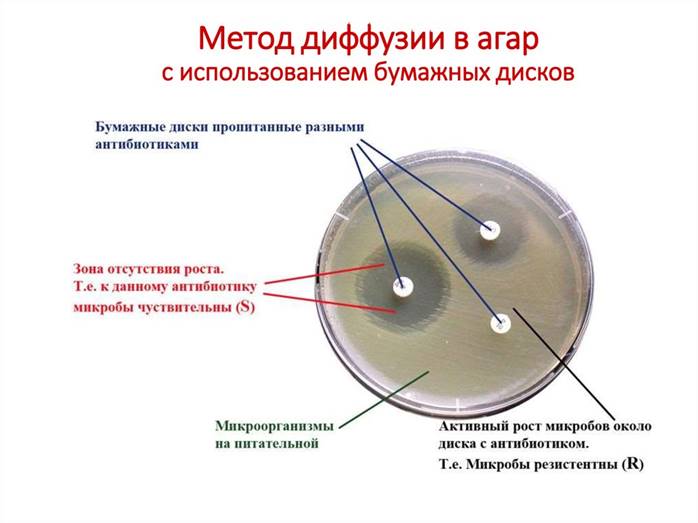
После посева испытуемой культуры на агар с помощью стерильного цилиндра делают лунки, в которые вносят растворы антибиотиков. По окончании инкубации в термостате измеряют зону задержки роста микроорганизма.
Расчет активности антибиотика производят по специальным таблицам.
Метод серийных разведений. В пробирках с жидкой питательной средой проводят разведение антибиотика, затем вносят взвесь клеток микроорганизма. С помощью этого метода определяют минимальную ингибирующую концентрацию (МИК) - минимальную концентрацию антибиотика, который вызывает видимое отсутствие роста микроорганизма в пробирке с питательной средой.

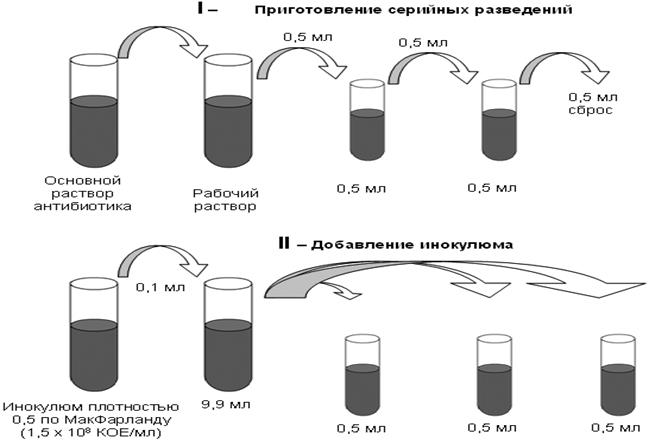
5. Требования, предъявляемые к антибиотикам.
1. высокий терапевтический антибактериальный эффект в дозах, не являющихся токсичными для организма;
2. отсутствие привыкания возбудителя к антибиотику в процессе терапии;
3. преодоление гематоэнцефалитического барьера и сохранение в жидкостях, тканях и органах организма с минимальной инактивацией белками сыворотки крови и ферментами;
4. показатели скорости всасывания, распределения и выведения вещества должны быстро обеспечить терапевтический эффект и поддерживаться в течение заданного времени, при этом наибольшее значение уделяется очагам поражения;
5. удобная лекарственная форма, обеспечивающая эффективность и стабильность в обычных условиях хранения.
6. Осложнения антибиотикотерапии.
Антибактериальные препараты способны оказывать побочные действия на макроорганизм.
- Токсическое воздействие:
1. на печень (рифампицины);
2. почки (аминогликозиды и др.);
3. нервную систему (гликопептиды и аминогликозиды);
4. кроветворение (сульфаниламиды);
5. развивающийся плод при беременности (тетрациклины);
6. возможно развитие эндотоксического шока, поскольку введение антибиотика, разрушающего грамотрицательные бактерии, вызывает высвобождение больших количеств эндотоксина.
- Дисбиоз (дисбактериоз)
Применение антибиотиков широкого спектра действия сопровождается гибелью представителей нормальной микрофлоры макроорганизма, при этом развиваются вторичные инфекции (кандидоз и др.).
- Воздействие на иммунную систему:
1. аллергические реакции немедленного и замедленного типов, анафилактический шок;
2. иммуносупрессивное действие - развитие вторичных иммунодефицитов.
7. Микробиологические основы рациональной антибиотикотерапии. Факторы антибактериального и антитоксического иммунитета, провоцирование хронического течения болезни и аллергизации организма.
– антибиотик должен выбираться (назначаться) в соответствии с чувствительностью к нему возбудителя заболевания;
– антибиотик должен назначаться в такой разовой и суточной дозе и вводиться таким путем, чтобы обеспечить лечебную концентрацию в очаге воспаления;
– антибиотик должен назначаться в такой дозе и вводиться таким путем, чтобы исключить или максимально ограничить его повреждающее действие.
Факторы антибактериального и антитоксического иммунитета: антибактериальные и антитоксические антитела.
Комплексы бактерия (антигены)-антитела образуют мембраноатакующий комплекс, разрушающий наружную мембрану клеточной стенки грамотрицательных бактерий.
Пептидогликан клеточных стенок бактерий разрушается лизоцимом.
Основным механизмом антибактериального иммунитета является фагоцитоз.
Противобактериальная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с бактериями, препятствуют их адгезии на эпителиоцитах.
Инфекционная болезнь служит причиной развития аллергии у человека, который изначально к этому предрасположен. Например, ОРВИ в возрасте до 3-х лет иногда становится триггером бронхиальной астмы. Это можно объяснить тем, что ОРВИ влияет на барьерную функцию дыхательных путей, снижая их защиту от других патогенов, а также от потенциальных аллергенов. Таким образом, инфекционное поражение дыхательных путей подготавливает почву для сенсибилизации к аллергенам, распространяемым воздушным путем, которая может развиться через пару месяцев после ОРВИ.
Химиотерапия, при которой активизировалась или развилась аллергия, осуществляется в двух направлениях:
лечение собственно инфекционного заболевания;
уменьшение симптомов аллергической реакции.
Некоторые лекарства, такие как глюкокортикостероиды, применяемые, например, для лечения некоторых патологий (бронхиальная астма, причиной которой стал вирус), увеличивают опасность развития вторичной пневмонии бактериальной природы у таких пациентов. Естественно, что при бактериальной инфекции используют антибиотики. Иногда у инфицированных больных падает уровень интерферонов. Чаще всего это происходит, когда ОРВИ заболевает человек, склонный к заболеваниям аллергической природы (атопический дерматит), или в случае, когда болезнь, которая может привести к аллергии (бронхиальная астма), развивается под воздействием инфекционных агентов. В этом случае назначаются лекарства-индукторы интерферонов и собственно интерфероны. Первые более предпочтительны, так как запускают естественные процессы выработки организмом собственных интерферонов.
Приложение 1
Схемы, показывающие возникновение устойчивости микрорганизмов к антибиотикам
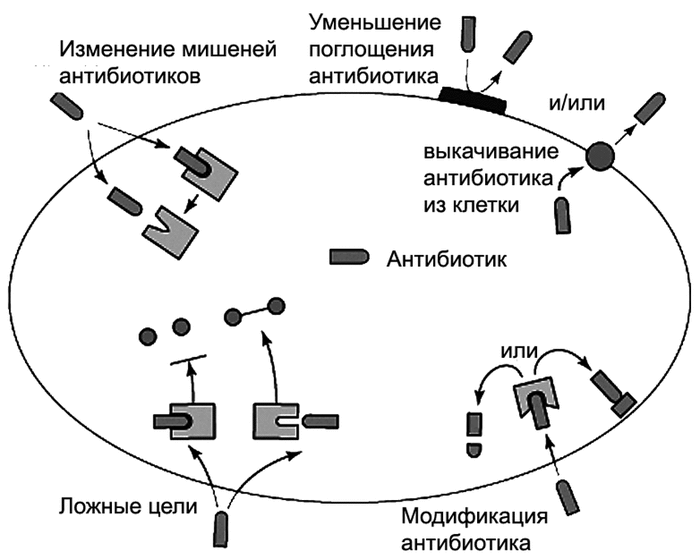
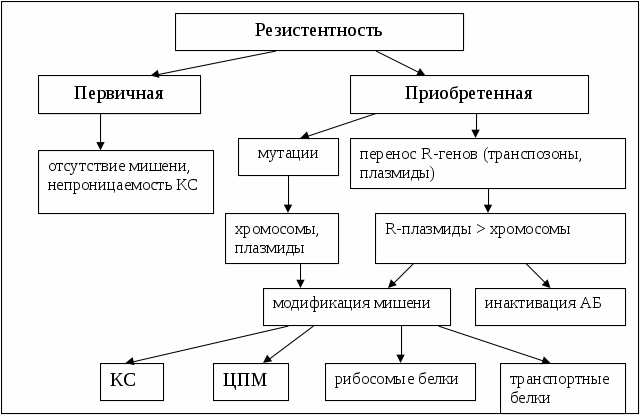
Задания для самоконтроля:
1. Назовите микробы, на которые антибиотики не оказывают действия.
2. Отметьте синтетические антибактериальные препараты:
а) сульфаниламиды;
б) хинолоны;
в) имидазолы;
г) полиены.
2. Назовите метод определения чувствительности к антибиотикам, позволяющий определить МИК.
4. Отметьте антибиотики, нарушающие синтез клеточной стенки бактерий:
1) β-лактамы;
2) тетрациклины;
3) гликопептиды;
4) аминогликозиды.
5. Микробоцидные антибиотики вызывают ……… бактериальных клеток.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.