
|
Дата занятия |
01.06.2020 |
|
Группа |
ПНК 11 |
|
Дисциплина |
Естествознание |
|
Преподаватель |
Ерофеева Евгения Геннадьевна |
|
Изучаемые темы |
Тема: Метиловый и этиловый спирты, глицерин, уксусная кислота. Тема: Жиры как сложные эфиры. Углеводы. |
|
e-mail преподавателя |
erofeevaevg@mail.ru
|
|
Срок исполнения |
08.06.2020 |
1. Тема: Метиловый и этиловый спирты, глицерин, уксусная кислота.
2. Тема: Жиры как сложные эфиры. Углеводы.
3. Задание для контроля освоения темы 4. Список источников для изучения темы.
Тема: Метиловый и этиловый спирты, глицерин, уксусная кислота. Спирты
Предельные одноатомные спирты – это производные предельных углеводородов, в молекулах которых один атом водорода замещен на гидроксильную группу.
Общая формула CnH2n+1OH, n≥1 или R-OH.
По систематической номенклатуре название спиртов образуют от названия соответствующего предельного углеводорода с добавлением суффикса – ол. Цифрой указывают номер атома углерода, с которым связана гидроксильная группа. Нумерацию углеродной цепи начинают с того конца, к которому ближе расположена гидроксильная группа.
CH3- CH- CH2- CH2- CH2- CH3
![]()
OH гексанол- 2
CH3
![]() CH3-
C- CH2- CH2- CH2- OH
CH3-
C- CH2- CH2- CH2- OH
CH3 4,4 – диметилпентанол – 1
CH3OH – C11 H23OH – жидкости
Высшие - твердые вещества.
Метанол, этанол, пропанол – 1 имеют специфический алкогольный запах, другие обладают удушливым неприятным запахом. Высшие спирты запаха не имеют.
Химические свойства предельных одноатомных спиртов
I. Реакции с разрывом связи O-H.
1) Взаимодействие с щелочными и щелочно – земельными металлами, с образованием солей – алкоголятов
![]() 2 C2
H5 OH + 2Na 2 C2 H5 O Na + H2
2 C2
H5 OH + 2Na 2 C2 H5 O Na + H2 ![]()
этиловый спирт этилат натрия
2) Реакция этерификация - взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров.
H2SO4(k);t
CH3 – C = О ![]() CH3
– C = О + H2O
CH3
– C = О + H2O
![]() OH + H-O- C2 H5
OH + H-O- C2 H5
![]()
O- C2 H5
Уксусная этиловый спирт этилацетат кислота
II. Реакции с разрывом связи C- O.
1. Взаимодействие с галогеноводородами C2 H5- OH + H-Br = C2 H5 Br + H2O
Бромэтан III. Реакции дегидратации.
Межмолекулярная дегидратация – отщепление молекулы воды от двух молекул спирта.
H2SO4(k) C2
H5- OH + H- O - C2
H5 ![]() C2 H5- O-
C2 H5 + H2O
T<140ºC
C2 H5- O-
C2 H5 + H2O
T<140ºC
Диэтиловый эфир.
Диэтиловый эфир – одно из первых наркотических веществ, введенных в хирургическую практику.
Внутримолекулярная дегидратация – отщепление молекулы воды от одной молекулы спирта.
H2SO4(k)
C H2- CH2 C H2= CH2 +H2O
 T<140ºC
T<140ºC
H OH
IV. Реакции окисления (горение)
C2
H5 OH + 3O2 ![]() 2CO2 +
3H2O
2CO2 +
3H2O
Классификация спиртов по количеству гидроксильных групп.
![]()
![]()
![]()
![]() C
H3- CH2- CH2 C H3- CH-
CH2 CH2- CH - CH2
C
H3- CH2- CH2 C H3- CH-
CH2 CH2- CH - CH2
![]()
1 OH 2 OH OH OH OH OH 3
1. одноатомные – эти спирты содержат в своем составе одну гидроксильную группу.
2.двухатомные (гликоли) – эти спирты содержат в своем составе две гидроксильные группы.
3.трехатомные спирты
Многоатомные спирты – это производные углеводородов, молекулы которых содержат несколько гидроксильных групп, связанных с разными атомами углерода.
CH2- CH2 двухатомный спирт – этиленгликоль
![]()
OH OH
![]()
![]() CH2-
CH - CH2 трехатомный спирт - глицерин OH OH OH
CH2-
CH - CH2 трехатомный спирт - глицерин OH OH OH
Химические свойства многоатомных спиртов
1. Взаимодействие с активным металлами с образованием гликолятов
![]() CH2 -
OH CH2 - O
Na
CH2 -
OH CH2 - O
Na
![]()
![]() +2Na
+H2
+2Na
+H2
CH2 - OH CH2 - O Na
этиленгликоль этиленгликолят
2. Взаимодействие с галогеноводорадами CH2- OH CH2- Br
![]()
![]() +
2HBr + 2 H2O
+
2HBr + 2 H2O
CH2- OH CH2- Br
1,2 – диброэтан
3. Качественная реакция на многоатомные спирты
H
 CH2 -
OH CH2 - O O - CH2
CH2 -
OH CH2 - O O - CH2
Cu
![]()
![]()
![]() 2 CH - OH + Cu
(OH)2 CH- O H O – CH + 2 H2O
2 CH - OH + Cu
(OH)2 CH- O H O – CH + 2 H2O
CH2 - OH CH2 - OH HO - CH2
глицерат меди (II) ярко-синий р-р
4. Взаимодействие. с азотной кислотой
CH2- OH H + O - NO2 CH2- O - NO2
![]() H2SO4
H2SO4
 CH -
OH + H - O - NO2 CH - O- NO2
+ 3 H2O
CH -
OH + H - O - NO2 CH - O- NO2
+ 3 H2O
CH2- OH H - O - NO2 CH - O- NO2
Нитроглицерин
В малых дозах нитроглицерин расширяет сосуды, поэтому 1% спиртовой р-р применяют в медицине.
Нитроглицерин – взрывчатое вещество (взрывается от легкого сотрясения). Нитроглицерином пропитывают древесную муку и получают динамит.
взрыв
HC3H5 (ONO2)3 ![]() 12CO2 +6 N2+O2+10H2O
12CO2 +6 N2+O2+10H2O
Этиленгликоль необходим для приготовления антифризов – незамерзающих жидкостей, используемых в радиаторах в зимних условиях.
Глицерин применяют для получения нитроглицерина и динамита. Используют в парфюмерии и медицине для изготовления мазей, смягчающих кожу.
Тема: Жиры как сложные эфиры. Углеводы.
Просмотр видео «Жиры, их строение и свойства»
https://youtu.be/RAymrTSWd_o
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами и таким образом впервые синтезировал жир.
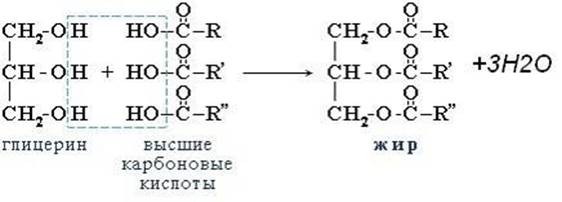
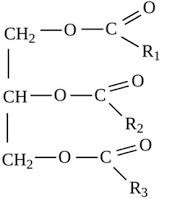
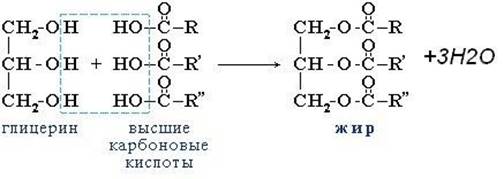
Жиры – сложные эфиры глицерина и высших карбоновых кислот. Общее название таких соединений – триглицериды.
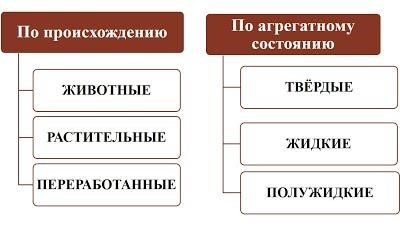
Животные жиры содержат главным образом глицериды предельных кислот и являются твердыми веществами. Растительные жиры, часто называемые маслами, содержат глицериды непредельных карбоновых кислот. Это, например, жидкие подсолнечное, конопляное и льняное масла.
Природные жиры содержат следующие жирные кислоты
|
Насыщенные:
стеариновая (C17H35COOH) пальмитиновая (C15H31COOH) Масляная (C3H7COOH) |
В СОСТАВЕ ЖИВОТНЫХ ЖИРОВ |
|
Ненасыщенные:
олеиновая (C17H33COOH, 1 двойная связь) линолевая (C17H31COOH, 2 двойные связи) линоленовая (C17H29COOH, 3 двойные связи) арахидоновая (C19H31COOH, 4 двойные связи, реже встречается) |
В СОСТАВЕ РАСТИТЕЛЬНЫХ ЖИРОВ |
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства жиров
- Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
- Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
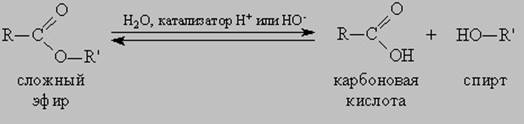
1. Гидролиз, или омыление, жиров происходит под действием воды, с участием ферментов или кислотных катализаторов (обратимо) , при этом образуются спирт - глицерин и смесь карбоновых кислот:
или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами. Мыла получаются при гидролизе жиров в присутствии щелочей:
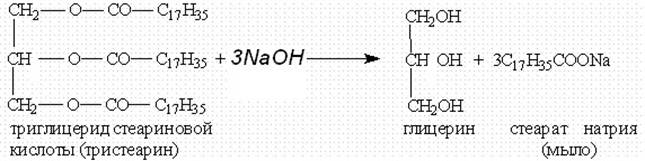
Мыла — это калиевые и натриевые соли высших карбоновых кислот.
2. Гидрирование жиров – превращение жидких растительных масел в твердые жиры – имеет большое значение для пищевых целей. Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас).
Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкого и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Так в промышленности получают маргарин:
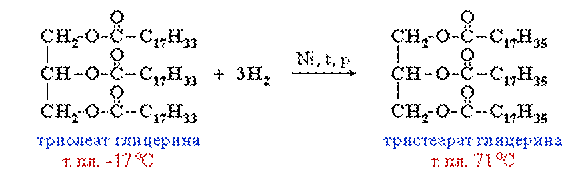
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
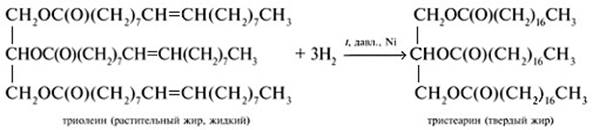
Реакция получения жиров (этерификация)
- Пищевая промышленность
- Фармацевтика
- Производство мыла и косметических изделий
- Производство смазочных материалов
Углеводы – вещества с общей формулой Cn(H2O)m, где n,m >3
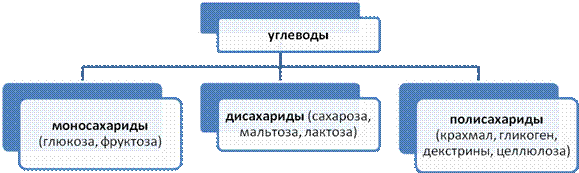
Моносахариды – это углеводы, которые не гидролизуются с образованием более простых углеводов.
Наиболее распространены: глюкоза и фруктоза.
Глюкоза – это бесцветное кристаллическое вещество, хорошо растворимо в воде, сладкое на вкус. Она содержится в соке винограда, поэтому ее называют виноградным сахаром, а также в спелых фруктах и ягодах, в меде.
Состав глюкозы выражает формула C6H12O6.
Химическое строение глюкозы выражается формулой:
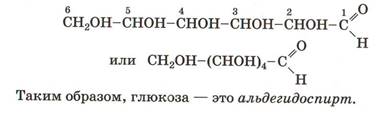
Глюкоза как вещество, содержащее функциональные группы двух видов, проявляет свойства многоатомных спиртов и свойства альдегидов, а также ряд специфических особенностей.

Фруктоза (фруктовый сахар) имеет такую же, как и глюкоза, молекулярную формулу C6H12O6, но отличается строением:
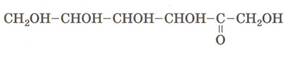
Следовательно, фруктоза является структурным изомером глюкозы. Это кристаллическое вещество, хорошо растворимо в воде, в три раза слаще глюкозы. В свободном виде содержится в ягодах и фруктах. Пчелиный мед представляет собой смесь глюкозы и фруктозы.
Дисахариды – углеводы, при гидролизе которых из одной молекулы образуются две молекулы моносахаридов.
Наиболее распространенный дисахарид – сахароза. Она содержится во всех частях зеленых растений. Наиболее богаты сахарозой сахарная свекла и сахарный тростник. Из этих растений и получают сахарозу, называя ее соответственно свекловичным или тростниковым сахаром. Применяют ее главным образом в пищевой промышленности. Сахароза – один из основных источников углеводов в пище человека.
Полисахариды – это природные высокомолекулярные углеводы, макромолекулы которых содержат сотни и тысячи остатков моносахаридов.
Наибольшее распространение из полисахаридов имеют крахмал, гликоген (животный крахмал), клетчатка (целлюлоза).
Общая формула полисахаридов (C6H10O5)n
В отличии от моно- и дисахаридов полисахариды не обладают сладким вкусом, нерастворимы в воде.
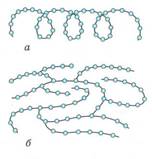
Крахмал – аморфный порошок белого цвета, нерастворимый в воде. В горячей воде он набухает и образует коллоидный раствор – клейстер.
Структура макромолекул крахмала: а) линейная; б) разветвленная.
Крахмал широко распространен в природе, является продуктом фотосинтеза. Часть глюкозы, образующейся в зеленых астениях при фотосинтезе, превращается в крахмал:
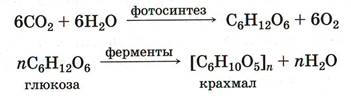
В качестве резервного питательного вещества крахмал накапливается в клубнях, плодах, семенах растений. Так, клубни картофеля содержат до 24% крахмала, зерна пшеницы – до 64 %, риса – 75%, кукурузы – 70%.
Биологическая роль крахмала. Гликоген.
Крахмал - ценный питательный продукт и наряду с сахарозой является основным источником углеводов в организме. Непосредственно крахмал не усваивается организмом, сначала он подвергается гидролизу под влиянием ферментов. Этот процесс начинается уже при пережевывании пищи в полости рта под действием фермента слюны – птиалина и заканчивается в пищеварительном тракте образованием глюкозы. Часть глюкозы организм усваивает сразу, а избыток ее превращается в гликоген (животный крахмал).
Гликоген – полисахарид. Он накапливается в печении мышцах. В организме он служит резервным питательным веществом, которое по мере необходимости гидролизуется до глюкозы.
Целлюлоза (клетчатка), как и крахмал, является природным полимером. Это твердое волокнистое вещество белого или серого цвета, нерастворимое в воде и в обычных органических растворителях.
Ориентация макромолекул целлюлозы в природных волокнах:

Задание для контроля освоения темы
1. Изучить теоретический материал изложенный выше и видео материал (пройдя по ссылкам).
2. Ответить письменно на вопросы.
Тема: Метиловый и этиловый спирты, глицерин, уксусная кислота.
1. Предельные одноатомные спирты – это …
2. Многоатомные спирты – это …..
3. Приведите классификацию спиртов по количеству гидроксильных групп
4. Приведите химические формулы простейших многоатомных спиртов.
Тема: Тема: Жиры как сложные эфиры. Углеводы.
1. Жиры – это ….
2. Общая формула жиров…
3. Привести схему классификации жиров
- по происхождению
- по агрегатному состоянию
4. Какие жирные кислоты входят в состав
- растительных жиров
- животных жиров
5. Химические свойства жиров
а) запишите реакцию гидролиза жиров (омыления) под действием
щелочи в результате которого образуется мыло
Уравнение реакции ……………
б) Гидрирование жиров – это …
в) Маргарин – это уравнение реакции образования молекулы маргарина …… Список источников для изучения темы
1. Химия для профессий и специальностей технического и естественнонаучно профиля. Ерохин Ю.М. Сложные эфиры. Жиры. § 25.4. Доступно по ссылке https://23.edu-reg.ru/shellserver?id=21234&module_id=42776#42776
2. Гаршин, А. П. Органическая химия в рисунках, таблицах, схемах : учебное пособие для среднего профессионального образования / А. П. Гаршин. - 3-е изд., испр. и доп. — Москва : Издательство Юрайт, 2020. - Эфиры. Жиры. с. 90-97
Доступно по ссылке
https://urait.ru/viewer/organicheskaya-himiya-v-risunkah-tablicah-shemah-454130?share_image_id=#page/90
3. Видео «Жиры, их строение и свойства» Доступно по ссылке https://youtu.be/RAymrTSWd_o
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.