
Разгуляева Алена Николаевна
учитель химии
МБОУ СОШ № 38,
г. Озёрск
Методическая разработка учебного занятия по дисциплине «Химия».
Тема занятия: Щелочные металлы
Тип занятия: изучение нового материала.
Вид занятия: комбинированный урок
Цели занятия: Изучить свойства и особенности щелочных металлов; совершенствовать практические умения и навыки написания уравнений реакций и схем электролиза расплавов и растворов электролитов, и решению задач.
Задачи занятия:
Обучающие: формирование знаний учащихся о щелочных элементах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Ход урока
1 Организационный момент
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы изучили общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов. Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных щелочных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
2 Актуализация знаний
Фронтальный опрос
Учитель:
- На какие две большие группы происходит деление химических элементов?
Обучающийся:
- На металлы и неметаллы
Учитель:
- Где находятся металлы в периодической системе Д.И. Менделеева.
Обучающийся:
- В периодической системе элементы – металлы расположены в начале всех периодов, а также в четных рядах больших периодов побочных подгруппах. Условной границей, отделяющей металлы от неметаллов, служит диагональ, отведенная от бора к астату. Металлы оказываются левее и ниже этой прямой, неметаллы – правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, их называют амфотерными.
Учитель:
- Какие группы естественных семейств в периодической системе мы знаем?
Обучающийся:
– Мы знаем особые группы отдельных металлов: щелочные металлы, щелочноземельные металлы, редкоземельные металлы (иттрий, лантан и лантаноиды, актиноиды), переходные металлы.
– Благородные металлы (серебро, золото и шесть платиновых металлов) . Платиновые металлы (платиноиды, рутений, родий, палладий, осмий, иридий, платина) металлы подгруппы алюминия.
Учитель:
– Каковы особенности строения атомов металлов?
Обучающийся:
- Атомы металлов имеют сравнительно большие атомные радиусы, поэтому их внешние электроны значительно удалены от ядра и слабо сними связаны. И вторая особенность, которая присуща атомам наиболее активных металлов – это наличие на внешнем энергетическом уровне 1-3 электронов.
Учитель:
- Как особенности строения атома влияют на физические свойства?
Обучающийся:
- Характерные физические свойства металлов металлический блеск, электрическая проводимость, теплопроводность, Связана с особенностью строения кристаллических решеток атомов металлов. В узлах располагаются атомы и положительные ионы металлов, связанные посредством обобществленных внешних электронов, которые принадлежат всему кристаллу, эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решетки.
Учитель:
- Как особенности строения металлов влияют на их химические свойства?
Обучающийся:
- Самое характерное химическое свойство всех металлов – их восстановительная способность, т.е. способность атомов легко отдавать свои внешние электроны, превращаясь в положительные ионы. Металлы не могут быть окислителями, т. е. атомы металлов не могут присоединять к себе электроны.
3 Изучение нового материала
3.1 Общая характеристика
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций. В периодической системе они расположены в главной подгруппе I группы. Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т.е. химическая активность. В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода. Это типичные металлы, в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью. Оксиды щелочных металлов - твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды - твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
3.2 Физические свойства
Основные сведения о щелочных металлах Таблица 1
Величина |
3Li |
11Na |
19Ka |
37Rb |
55Cs |
87Fr |
|
Атомный вес |
6,94 |
22,99 |
39,1 |
85,47 |
132,9 |
[223]
|
|
Валентные электроны |
(2) 2s1 |
(8) 3s1 |
(8) 4s1 |
(8) 5s1 |
(8) 6s1 |
(8) 7s1 |
|
Металлический радиус атома, нм |
0,155 |
0,189 |
0,236 |
0,248 |
0,268 |
0,280 |
|
Радиус иона, нм |
0,68 |
0,98 |
1,33 |
1,49 |
1,65 |
1,75 |
|
Энергия ионизации, Эв |
5,39 |
5,14 |
4,43 |
4,176 |
3,89 |
3,98 |
|
Содержание в земной коре, ат. % |
0,02 |
2,0 |
1,1 |
4×10-3 |
9×10-5 |
¾ |
|
Плотность, г/см3 |
0,534 |
(0,97) |
0,86 |
1,532 |
1,87 |
|
|
Температура плавления, 0С |
179 |
97,8 |
63,5 |
39,0 |
28,5 |
|
3.3 Химические свойства
1) Взаимодействие с кислородом. В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
![]()
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
2Na + O2 = Na2O2.
![]()
![]()
![]()
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
![]()
2) Взаимодействие с водородом.
2Na + Н2 =2NaН – гидрид натрия.
3) Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
![]()
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
4) Взаимодействие с галогенами
2Na + Сl2 = 2NaCl – хлорид натрия.
5) Взаимодействия с неметаллами
![]()
![]()
![]()
6) Взаимодействие с раствором кислот:
2HСl + 2Na = 2NaСl + H2.
7) Взаимодействие с солями
Менее активные металлы могут быть получены восстановлением щелочными металлами:
3Na + AlCl3 = Al + 3NaCl.
8) Качественные
реакции: окрашивание пламени ионами
Li+ - карминово-красное
Na+ - желтое
K+ - фиолетовое
Демонстрируется опыт
Прокаливается железная проволока до тех пор, пока не перестанет ею окрашиваться пламя, затем вносится в пламя на кончике проволоки раствор соли натрия. Наблюдаем окрашивание пламени ионами натрия в желтый цвет.
Опыт повторяется, используя хлорид калия. Наблюдаем окрашивание пламени в фиолетовый цвет.
3.4
Соединения щелочных металлов
Щелочные металлы - самые сильные восстановители, их ионы не проявляют
окислительных свойств.
Гидроксиды
(едкие щелочи) - твердые кристаллические вещества, типично ионные соединения,
сильные основания. Гидроксиды щелочных металлов являются истинными
гидроксидами, т.к. имеют ионный тип кристаллической решетки.
NaOH-едкий натр, каустическая сода
KOH-едкое кали
Соли - типично ионные соединения, как правило, хорошо растворимы в воде, кроме
некоторых солей лития. Соли, образованные слабыми кислотами сильно гидролизуются.
Na2CO3×10H2O - кристаллическая сода
Na2CO3 - кальцинированная сода
NaHCO3 - питьевая сода
K2CO3 - поташ
3.5 Получение
Т.к. щелочные металлы - это самые сильные
восстановители, их можно восстановить из соединений только при электролизе
расплавов солей:
2NaCl=2Na+Cl2
на катоде: Na++e-=Na
на аноде:2Cl--2e-=Cl2![]()
3.6 Применение
Алюминий-литиевые сплавы нашли применение в авиационной и космической технике.
Литий используется при производстве литиевых аккумуляторов, такие аккумуляторы применяются в кардиостимуляторах.
Расплавы натрия и калия используются в качестве теплоносителей в атомных реакторах и в авиационных двигателях.
Пары натрия используются в люминесцентных светильниках.
Натрий служит катализатором в производстве каучука.
Натрий используется при производстве калия, титана, циркония и тантала, а также тетраэтилсвинца – добавки, улучшающей детонационные свойства бензина.
Пероксид натрия и надпероксид калия используются в подводных лодках и космических кораблях для регенерации кислорода.
Гидроксид калия применяется для получения жидкого мыла и стекла.
Гидроксид натрия используется для производства бумаги, искусственных тканей, мыла, очистки нефтепроводов, в производстве искусственного волокна и в щелочных аккумуляторах.
Хлорид натрия – пищевой продукт и сырье для получения натрия и его соединений, применяется в медицине для приготовления физиологического раствора.
Карбонат натрия используется для производства бумаги, мыла и стекла.
Гидрокарбонат натрия (питьевая сода) применяется в медицине, кулинарии, в производстве минеральных вод, используется в огнетушителях.
Карбонат калия (поташ) необходим при производстве жидкого мыла и стекла.
Нитрат калия – комплексное минеральное удобрение, применяется для производства черного пороха и фейерверков.
Цезий нашел применение в фотоэлементах.
4 Рефлексия
4.1 Решение задачи
К раствору, содержащему 16 г сульфата меди (II), прилили раствор, содержащий 20 г гидроксида натрия. Какова масса образовавшегося осадка?
4.2 Напишите химические уравнения следующих превращений:
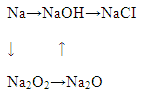
5 Домашнее задание [1] c. 184, зад. 5, 6.
6 Подведение итогов урока, выставление оценок
Список литературы
1. Габриелян, О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
2. Габриелян, О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
3. Габриелян, О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2007.
4. Ерохин, Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом): учеб. пособие для студентов средн. проф. завед. – М., 2004.
5. Кузнецова, Н.Е. Обучение химии на основе межпредметной интеграции / Н.Е. Кузнецова, М.А. Шаталов. – М., 2004.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.