
МИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОСТОВСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ РОСТОВСКОЙ ОБЛАСТИ
«НОВОШАХТИНСКИЙ ТЕХНОЛОГИЧЕСКИЙ ТЕХНИКУМ»
Рассмотрено на заседании МО Согласовано на заседании Утверждаю
«Общеобразовательный цикл» Методического совета Зам. директора по УМР
Протокол №____ от ________ Протокол №_____ __________ И.Ю. Волкова
Председатель МО _________ от «____» _________ «____» _________
Методические рекомендации для обучающихся
по проведению и оформлению
лабораторных и практических работ
по дисциплине «Химия»
Преподаватель химии:
Панчишкина С.Н.
Новошахтинск 2019 г.
Настоящие методические рекомендации составлены в соответствии с рабочими программами учебной дисциплины «Химия» для профессий СПО технического профиля:
Данные методические рекомендации предназначены для закрепления теоретических знаний и приобретения необходимых практических навыков и умений по учебной дисциплине «Химия» для обучающихся по профессиям СПО технического профиля.
Требования к знаниям и умениям при выполнении лабораторных и практических работ.
При выполнении лабораторных и практических работ обучающийся должен:
Знать:
- Основные классы неорганических соединений и их свойства, строение атома, типы химических реакций,
- Теорию электролитической диссоциации,
- Периодический закон и Периодическую систему химических элементов Д. И. Менделеева,
- Качественные реакции на катионы и анионы, условия необратимости химических реакций, факторы, влияющие на скорость химических реакций,
- Теорию химического строения органических соединений А. М. Бутлерова, основные классы органических соединений, их строение и свойства, способы их получения,
- Качественные реакции на органические вещества;
- Правила по технике безопасности при работе в химическом кабинете.
Уметь:
- проводить качественные реакции на неорганические и органические вещества,
- проводить реакции по получению и собиранию газов,
- распознавать органические вещества, изученные по программе, на основе их строения и свойств,
- описывать свойства неорганических и органических веществ, составлять уравнения химических реакций,
- формулировать выводы по проведённым работам.
Данное методическое пособие содержит методические рекомендации по проведению следующих лабораторных и практических работ.
Лабораторные работы:
1. Лабораторная работа №1 «Приготовление суспензии карбоната кальция в воде»
2. Лабораторная работа №2 «Опыты, иллюстрирующие химические свойства кислот»
3. Лабораторная работа №3 «Опыты, иллюстрирующие химические свойства оснований»
4. Лабораторная работа №4 «Опыты, иллюстрирующие химические свойства солей»
5. Лабораторная работа №5 «Опыты, иллюстрирующие химические свойства оксидов»
6. Лабораторная работа №6 «Реакция замещения меди железом в растворе медного купороса»
7. Лабораторная работа №7 «Опыты, иллюстрирующие зависимость скорости химических реакций от различных факторов»
8. Лабораторная работа №8 «Реакции, идущие с образованием осадка, газа и воды»
9. Лабораторная работа №9 «Закалка и отпуск стали»
10. Лабораторная работа №10 «Изготовление моделей молекул органических веществ»
11. Лабораторная работа №11 «Растворение глицерина в воде и его взаимодействие с гидроксидом меди (II)»
12. Лабораторная работа №12 «Свойства уксусной кислоты, общие со свойствами минеральных кислот»
13. Лабораторная работа №13 «Доказательство непредельного характера жидкого жира»
14. Лабораторная работа №14 «Взаимодействие раствора глюкозы и сахарозы с гидроксидом меди (II)»
15. Лабораторная работа №15 «Качественная реакция на крахмал»
16. Лабораторная работа №16 «Проведение качественных реакций на белки»
17. Лабораторная работа №17 «Денатурация белков»
Практические работы:
1. Практическая работа №1 «Приготовление раствора заданной концентрации»
2. Практическая работа №2 «Получение, собирание и распознавание газов»
3. Практическая работа №3 «Решение экспериментальных задач по неорганической химии»
4. Практическая работа №4 «Решение экспериментальных задач на идентификацию органических веществ»
Выполнение лабораторных и практических работ
Обучающийся допускается к выполнению лабораторной или практической работы при наличии тетрадей для лабораторных и практических работ, включающих общие правила по технике безопасности, название и номер лабораторной или практической работы, цель, оборудование и реактивы, ход работы (инструкции по выполнению) и практическую часть (таблицу).
Обучающийся должен знать правила техники безопасности при работе в химическом кабинете. Перед началом выполнения лабораторной или практической работы обучающийся должен изучить правила по технике безопасности при работе с реактивами и оборудованием по данной лабораторной или практической работе и в журнале инструктажа по технике безопасности должен в определённой графе поставить свою подпись.
Обучающийся подробно изучает инструкцию по выполнению лабораторной или практической работы, затем приступает к её выполнению.
Обучающийся выполняет лабораторную или практическую работу, и вносит в таблицу необходимые сведения: что брал(а) и что делал(а), уравнения, наблюдения, вывод.
|
Что брал(а) и что делал(а) |
Уравнения |
Наблюдения |
Вывод |
|
|
|
|
|
В конце занятия преподаватель оценивает лабораторную или практическую работу определенной суммой баллов (по пятибалльной системе) и ставит итоговую оценку, учитывая при этом следующие характеристики:
· Проведение эксперимента;
· Соблюдение правил по ТБ;
· Оформление работы.
Эти данные фиксируются на последнем листе тетради для лабораторных или практических работ по химии в итоговой ведомости
|
№ лабораторной работы (или практической работы) |
Проведение эксперимента |
Соблюдение правил по ТБ |
Оформление работы |
Итоговая оценка |
|
|
|
|
|
|
1. В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование – это может затруднить вашу дальнейшую работу.
2. Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной или практической работы и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе.
3. В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю.
4. Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли).
Чтобы не перепутать пробки, не открывайте одновременно несколько склянок.
5. Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора.
6. В химическом кабинете очень важно быть предельно аккуратным во всем – тут нет мелочей. Прежде чем начать работать, продумайте, каким образом необходимо разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента.
Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать обучающиеся других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке.
ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ ПРИ РАБОТЕ В ХИМИЧЕСКОМ КАБИНЕТЕ
1. Общие требования к поведению учащихся в кабинете химии
1.1. Соблюдение требований настоящих Правил обязательно для обучающихся, работающих в кабинете химии.
1.2. Допуск посторонних лиц в кабинет химии в момент проведения эксперимента разрешается только с ведома учителя химии.
1.3. В кабинете химии обучающиеся обязаны проявлять осторожность в движениях, быть внимательными к указаниям преподавателя и лаборанта. Во время работы соблюдать чистоту и порядок на рабочем месте.
1.4. Запрещается загромождать проходы пакетами, сумками.
1.5.
Прежде чем приступить к выполнению работы, необходимо
подробно изучить по учебнику или пособию порядок ее проведения.
Следует строго соблюдать все указания преподавателя по
безопасному обращению с приборами, реактивами, методам нагревания, наполнению сосудов и т.д.
1.6. Запрещается проводить опыты, не предусмотренные данной работой.
1.7. Запрещается прием пищи в кабинете химии.
1.8. Обо всех неполадках в работе оборудования, водопровода, электросети и т.д. необходимо ставить в известность преподавателя или лаборанта. Устранять неисправности учащимся самостоятельно запрещается.
1.9. Уборку рабочих мест по окончании работы следует производить в соответствии с указаниями преподавателя.
1.10. По окончании практических работ обучающиеся должны вымыть руки с мылом.
1.11. При получении травмы (порезы, ожоги), а также при плохом самочувствии обучающиеся должны немедленно сообщать об этом преподавателю или лаборанту.
1.12. При возникновении в кабинете во время занятий аварийных ситуаций (пожар, появление сильных посторонних запахов) не допускать паники и подчиняться только указаниям преподавателя.
2. Работа с веществами и растворами
2.1. Насыпать или наливать вещества можно только над столом или специальным подносом. Для опыта брать только указанное количество вещества.
2.2. Нельзя ошибочно взятый излишек реактива сыпать (выливать) обратно в склянку или банку.
2.3. Запрещается выносить из кабинета и вносить в него любые вещества без разрешения преподавателя.
2.4. Все работы, связанные с выделением вредных паров или газов, проводить только в вытяжных шкафах при исправной вентиляции.
2.5. Твердые сыпучие реактивы разрешается брать из склянок только с помощью совочков, ложечек, шпателей, пробирок, но не руками. Измельчение твердых веществ разрешается проводить только в фарфоровой ступке с помощью пестика.
2.6. Для ускорения растворения твердых веществ в пробирке нельзя закрывать ее отверстие пальцем при встряхивании.
2.7. Растворение щелочи следует производить в фарфоровой посуде путем прибавления к воде небольших порций вещества, при непрерывном помешивании. Кусочки щелочи можно брать только пинцетом или щипцами.
2.8. При определении запаха вещества нельзя наклоняться над ним, вдыхать пары или выделяющийся газ. Нужно легким движением руки над горлом сосуда направить пар или газ к носу и вдыхать осторожно.
2.9. Пролитую кислоту или щелочь следует засыпать чистым, сухим песком и перемешивать его до полного впитывания всей жидкости. Влажный песок убрать совком в широкий стеклянный сосуд для последующей промывки и нейтрализации. Место разлива следует обработать нейтрализующим раствором, а затем промыть водой.
2.10. Обо всех случаях разлива жидкостей, а также о рассыпанных твердых реактивах нужно сообщить преподавателю или лаборанту. Самостоятельно убирать любые вещества учащимся запрещается.
2.11. Растворы из реактивных склянок необходимо наливать так, чтобы при наклоне этикетка оказывалась сверху (этикетку - в ладонь). Каплю, оставшуюся на горлышке, снимают краем той посуды, куда наливается жидкость.
2.12. При попадании на кожу растворов кислот или щелочей необходимо смыть их после стряхивания видимых капель сильной струей холодной воды, а затем обработать нейтрализующим раствором (2%-м раствором уксусной кислоты при попадании щелочей или 2-% раствором гидрокарбоната натрия при попадании кислот) и ополоснуть водой.
2.13. Запрещается выливать в канализацию растворы и органические жидкости. Необходимо сливать их в склянки, предназначенные для этой цели.
3. Обращение с нагревательными приборами, нагревание
3.1. Зажигать спиртовку (газовую горелку) разрешается только от спички. Запрещается наклоняться над горящей горелкой (спиртовкой).
3.2. Для нагревания жидкостей рекомендуется использовать тонкостенные сосуды. Запрещается перед нагревом заполнять пробирки жидкостью более чем на одну треть их объема. При нагревании пробирки ее отверстие следует направлять в сторону от себя и рядом работающих. В ходе нагревания запрещается наклоняться над сосудами, заглядывать в них. Недопустимо нагревать сосуды на границе и выше уровня жидкости, а также пустые сосуды с каплями влаги внутри.
3.3. Необходимо начинать со слабого нагрева всей пробирки или стеклянной пластинки (2-3 движения над пламенем, если пробирка не закреплена, или слабым пламенем под пробиркой, если пробирка закреплена) и только затем вести дальнейший нагрев вещества.
3.4. Запрещается оставлять без присмотра нагревательные приборы
4. Сборка приборов, их крепление
4.1. При сборке приборов из стекла запрещается применять повышенное усилие.
4.2. Перед тем, как вставить в отверстие пробки стеклянную трубку, конец ее следует смазать глицерином или смочить водой. Пробку следует держать левой рукой, а правой - вставлять в нее трубку, при этом трубку следует поворачивать и не допускать, чтобы конец ее упирался в ладонь.
4.3. Приготовленный к работе прибор необходимо показать преподавателю или лаборанту.
4.4. Пробирки, а также приборы на их основе (для получения газов) надо закреплять в лапке штатива или в пробирке-держателе у отверстия пробирки, а не на середине ее. При креплении в лапке штатива следует поворачивать пробирку пальцами вдоль ее оси и прекращать закручивать зажимной винт, как только вращение пробирки будет затруднено.
4.5. Демонтаж приборов производить только на основании указаний преподавателя.
Правила по технике безопасности при проведении лабораторных и практических работ
– Работая в химическом кабинете, необходимо соблюдать большую осторожность;
– Приступать к выполнению задания после указания преподавателя;
– Химические реакции выполнять с такими количествами и концентрациями веществ, в таких приборах и посуде, как указано в описаниях работ;
– Производить опыты в чистой посуде;
– Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта;
– Все опыты с выделением ядовитых, летучих и неприятно пахнущих веществ (выпаривание, кипячение растворов кислот, содержащих галогены, аммиак, сероводород) проводить только в вытяжном шкафу;
– Выполнять опыты с взрывчатыми, легковоспламеняющимися веществами или кислотами и щелочами с соблюдением мер предосторожности, работая стоя. Поджигать газы и пары после проверки их на чистоту, смесь горючего газа с воздухом взрывается;
– Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе;
– Реактивы не пробовать на вкус, так как большинство из них ядовиты;
– Держать дальше от огня легко воспламеняющиеся вещества: эфир, бензин, спирт, бензол и др. Если эти вещества воспламеняются, накрыть пламя брезентом или засыпать песком;
– Не зажигать спиртовку, наклоняя ее к другой горящей спиртовке. Гасить спиртовку, накрывая ее колпачком;
– В случае возникновения пожара в кабинете химии вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем;
– В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему помощь.
Лабораторная работа № 1
«Приготовление суспензии карбоната кальция в воде»
Цель работы:
Ø Повторить и закрепить знания о дисперсных системах.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, стеклянная трубочка.
Реактивы: свежеприготовленный раствор гидроксида кальция.
Ход работы:
1. В пробирку налейте 4-5 мл свежеприготовленного раствора гидроксида кальция (известковой воды) и осторожно через трубочку продувайте через него выдыхаемый воздух.
2. Запишите наблюдения и уравнение химической реакции в молекулярном виде.
Лабораторная работа № 2
«Опыты, иллюстрирующие химические свойства кислот»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах кислот.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок.
Реактивы: соляная кислота (р-р), серная кислота (р-р), азотная кислота (р-р), гидроксид натрия (р-р), фенолфталеин, раствор сульфата меди (II), раствор карбоната натрия, раствор нитрата серебра, гранулы цинка, стружка меди.
Ход работы
Испытание растворов кислот индикаторами
1. В три пробирки налейте растворы соляной, серной и азотной кислот соответственно. Затем добавьте к ним по 2-3 капли раствора лакмуса. Повторите опыт с использованием раствора метилового оранжевого.
2. Запишите, как изменился цвет сродержимого пробирок?
1. Изучение взаимодействия кислот с основаниями
1. В пробирку налейте 2-3 мл раствора щелочи и добавьте несколько капель фенолфталеина. (Что наблюдаете!) Затем прилейте в пробирку раствор кислоты до полного обесцвечивания содержимого. Объясните результаты наблюдений.
2. Получите нерастворимый гидроксид меди (II) реакций обмена. Для этого в пробирку с 2-3 мл раствора сульфата меди (II) прилейте 1-2 мл раствора щелочи. (Что наблюдаете?)
3. К полученному осадку добавьте раствор соляной или серной кислоты до полного растворения. Объясните результаты наблюдений, напишите уравнения реакций в молекулярной и ионной формах.
2. Изучение взаимодействия кислот с солями
1. В пробирку с раствором карбоната натрия (1-2 мл) добавьте такой же объем раствора соляной кислоты. (Что наблюдаете?)
2. В пробирку с раствором соляной кислотой добавьте несколько капель раствора нитрата серебра. (Что наблюдаете?) Напишите уравнения в молекулярной и ионной формах.
3. Изучение взаимодействия растворов кислот с металлами
В две пробирки опустите по грануле цинка и по кусочку меди соответственно и прилейте в каждую по 2-3 мл раствора соляной кислоты. (Что наблюдаете?) Объясните результат наблюдения. Напишите уравнения в молекулярной и ионной формах.
Лабораторная работа №3
«Опыты, иллюстрирующие химические свойства оснований»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах оснований.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок.
Реактивы: раствор гидроксида натрия, фенолфталеин, лакмус, метиловый оранжевый, раствор хлорида аммония, влажная лакмусовая бумажка, раствор сульфата меди (II), соляная кислота.
Ход работы
1. Испытание растворов щелочей индикаторами
В три пробирки налейте 2-3 мл раствора щелочи, затем добавьте: в первую - несколько капель фенолфталеина, во вторую -небольшое количество раствора лакмуса, в третью - небольшой объем раствора метилового оранжевого. (Что наблюдаете?)
2. Изучение взаимодействия щелочей с солями
1. В пробирку налейте 2 - 3 мл раствора хлорида аммония, затем добавьте 1 - 2 мл раствора щелочи. Содержимое пробирки нагрейте, осторожно понюхайте выделяющийся газообразный продукт или поднесите к отверстию пробирки влажную лакмусовую бумажку.
2. Получите гидроксид меди (II) реакцией обмена. Для этого в пробирку с 2 - 3 мл раствора сульфата меди (II) прилейте 1-2 мл раствора щелочи. (Что наблюдаете?) Напишите уравнения реакций в молекулярной и ионной формах.
3. Изучение взаимодействия щелочей с кислотами
В пробирку налейте 1 мл раствора гидроксида натрия и добавьте несколько капель фенолфталеина, запишите наблюдения; затем прилейте в пробирку 1 мл соляной кислоты, запишите уравнения химической реакции в молекулярном и ионном виде, наблюдения и вывод о характере взаимодействия щёлочи и кислоты.
Лабораторная работа №4
«Опыты, иллюстрирующие химические свойства солей»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах солей.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, стальная кнопка или скрепка.
Реактивы: раствор хлорида натрия, раствор фосфата натрия, раствор иодида натрия, раствор нитрата серебра, раствор карбоната натрия, раствор нитрата аммония, раствор хлорида калия, универсальная индикаторная бумага, раствор сульфата меди (II), раствор сульфата натрия, раствор гидроксида бария.
Ход работы
1. Изучение взаимодействия солей с солями
В каждую из трех пробирок с раствором хлорида, фосфата и иодида натрия соответственно прилейте несколько капель раствора нитрата серебра (II). (Что наблюдаете?) Напишите уравнения реакций в молекулярной и ионной формах.
2. Изучение гидролиза солей
Испытайте растворы карбоната натрия, нитрата аммония и хлорида калия универсальной индикаторной бумагой. (Что наблюдаете?) Сравните изменение цвета с эталонной шкалой. Определите значение рН растворов. Напишите уравнения реакций гидролиза в молекулярной и ионной формах.
3. Изучение взаимодействия солей с металлами
Налейте в пробирку 2 - 3 мл раствора сульфата меди (II) и опустите в него стальную кнопку или скрепку. Напишите наблюдения и уравнения реакций в молекулярной и ионной формах.
4. Изучение взаимодействия солей со щелочами
Налейте в пробирку 1 мл раствора сульфата меди (II) и прилейте к нему 1 мл раствора гидроксида натрия.
Налейте в пробирку 1 мл раствора сульфата натрия и прилейте к нему 1 мл раствора гидроксида бария. Запишите наблюдения, уравнения химических реакций в молекулярном и ионном виде и сделайте соответствующий вывод.
Лабораторная работа №5
«Опыты, иллюстрирующие химические свойства оксидов»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах оксидов.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, держатель для пробирок, сухое горючее, спички.
Реактивы: оксид кальция, вода, фенолфталеин, лакмус, разбавленная соляная кислота
Ход работы
Химические свойства основных оксидов
1. В пробирку с водой насыпьте, немного порошка оксида кальция и добавьте несколько капель фенолфталеина.
2. Налейте в пробирку 1 мл разбавленной соляной кислоты, добавьте несколько капель лакмуса и насыпьте немного оксида кальция.
3. Запишите наблюдения, уравнения соответствующих реакций, сделайте вывод.
Лабораторная работа №6
« Реакция замещения меди железом в растворе медного купороса»
Цель работы:
Ø Повторить и закрепить знания о классификации химических реакций.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок
Реактивы: раствор сульфата меди (II), железный гвоздь
Ход работы
Налейте в пробирку 2 - 3 мл раствора сульфата меди (II) и опустите в неё железный гвоздь. Напишите наблюдения и уравнения реакций в молекулярной и ионной формах. Рассмотрите окислительно-восстановительные процессы.
Лабораторная работа №7
«Опыты, иллюстрирующие зависимость скорости химических реакций от различных факторов»
Цель работы:
Ø Повторить и закрепить знания о зависимости скорости химических реакций от различных факторов;
Ø Закрепить и проверить умения и навыки учащихся пользоваться химическими реактивами и оборудованием,
записывать уравнения проведённых химических реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приёмами сравнения, обобщения, делать выводы.
Реактивы: гранулы цинка, разбавленная соляная кислота (1:2), разбавленная уксусная кислота (1:2), порошок железа, железные стружки, разбавленная серная кислота (1:5), разбавленная серная кислота (1:10).
Ход работы
Опыт I. В две пробирки положите по две гранулы цинка. В первую налейте 2 мл разбавленной соляной кислоты (1:2), во вторую - столько же разбавленной уксусной кислоты (1:2).
Опыт 2. В одну пробирку насыпьте немного порошка железа, а в другую - столько же железных стружек. В обе пробирки налейте по 2 мл, разбавленной соляной кислоты (1:2).
Опыт 3.В две пробирки положите по две гранулы цинка. В первую налейте 2 мл разбавленной серной кислоты (1:5), а во вторую — 2 мл. разбавленной серной кислоты (1:10).
Опыт 4. В две пробирки положите по две гранулы цинка. В обе пробирки, налейте но 2 мл разбавленной серной кислоты (1:10). Одну пробирку слегка подогрейте, а вторую оставьте для сравнения.
Задание. На основании проделанных опытов сделайте вывод, какие факторы влияют на скорость химических реакций. Напишите уравнения соответствующих реакций в молекулярном виде.
Лабораторная работа №8
«Реакции, идущие с образованием осадка, газа или воды»
Цель работы:
Ø Повторить и закрепить знания о реакциях ионного обмена в водных растворах, об условиях их необратимости;
Ø Закрепить умения и навыки пользоваться химическими реактивами, записывать уравнения проведённых химических реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приёмами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок.
Реактивы: раствор нитрата серебра, раствор хлорида натрия, раствор гидроксида натрия, раствор гидроксида кальция, раствор хлорида аммония, разбавленная серная кислота, фенолфталеин.
Ход работы
1. Налейте в пробирку 1 мл раствора нитрата серебра и прилейте к нему 1 мл раствора хлорида натрия, запишите уравнения химической реакции в молекулярном, полном и сокращённом ионном виде, наблюдения и вывод.
2. Налейте в пробирку 1 мл раствора гидроксида натрия и добавьте несколько капель фенолфталеина, запишите наблюдения; затем прилейте в пробирку 1 мл серной кислоты (разб.), запишите наблюдения, уравнения химической реакции в молекулярном, полном и сокращённом ионном виде и вывод.
3. Налейте в пробирку 1 мл раствора гидроксида кальция и прилейте к нему 1 мл раствора хлорида аммония, запишите наблюдения, уравнения химических реакций в молекулярном, полном и сокращённом ионном виде и вывод.
Лабораторная работа №9
«Закалка и отпуск стали»
Цель работы:
Ø Повторить и закрепить знания о свойствах металлов и сплавов.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: тигельные щипцы, горелка, спички, сухое горючее, колба с холодной водой.
Реактивы: швейная игла, лезвие.
Ход работы
Швейную иглу или лезвие безопасной бритвы возьмите тигельными щипцами, раскалите на пламени горелки и постепенно охладите. Игла или лезвие теряют свою упругость, их можно легко согнуть. Произошел отпуск стали.
Если иголку или половинку лезвия снова накалить до красна и немедленно охладить в холодной воде, то они перестанут гнуться, а при попытке согнуть их - ломаются. Произошла закалка стали.
Лабораторная работа № 10
«Изготовление моделей молекул органических веществ»
Цель работы:
Ø Повторить и закрепить знания о предельных углеводородах.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: наборы разного цвета шаров и стержней.
Задания:
1. Соберите шаростержневые модели молекул метана, этана, пропана, бутана.
2. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана.
Ход работы
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С-Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28' относительно друг друга. Расположите четыре стержня под указанным углом.
2. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
3. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
4. Уберите стержни из шаростержневой модели молекулы метана. Сохраняя направленность валентных связей, присоедините к «атому углерода» четыре «атома водорода». Изменилось ли пространственное строение молекулы метана? Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными,
5. Соберите шаростержневые модели молекул метана, этана, пропана, бутана. Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате огромного числа пространственных изомеров. Почему нельзя выделить эти пространственные изомеры?
6. Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. Продемонстрируйте на этих моделях поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана.
7. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана.
8. Ход лабораторной работы и ответы на вопросы занесите в таблицу.
Лабораторная работа № 11
«Растворение глицерина в воде и реакция его с гидроксидом меди (II)»
Цель работы:
Ø Повторить и закрепить знания о физических и химических свойствах многоатомных спиртов.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробок.
Реактивы: глицерин, вода, раствор гидроксида натрия, раствор сульфата меди (II).
Ход работы
1. Налейте в пробирку 1-2 мл глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды.
2. В пробирку налейте 2 мл раствора гидроксида натрия и добавите немного раствора сульфата меди (II) до выпадения осадка.
Задания:
1. Какова растворимость глицерина в воде?
2. Какая реакция характерна для глицерина и других многоатомных спиртов? Напишите уравнения соответствующих реакций.
Лабораторная работа № 12
«Свойства уксусной кислоты, общие со свойствами минеральных кислот»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах карбоновых кислот.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички.
Реактивы: стружки магния, гранулы цинка, раствор гидроксида натрия, фенолфталеин.
Ход работы
1. Взаимодействие уксусной кислоты с металлами.
Задания:
1. Как уксусная кислота реагирует с магнием и цинком?
2. Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном виде.
2. Взаимодействие уксусной кислоты с основаниями.
·
 Влейте в
пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель
раствора фенолфталеина. При добавлении уксусной кислоты
происходит обесцвечивание.
Влейте в
пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель
раствора фенолфталеина. При добавлении уксусной кислоты
происходит обесцвечивание.
Рис. Получение уксусной кислоты
Задание: Напишите уравнения взаимодействия уксусной кислоты с гидроксидом натрия в молекулярном, полном и сокращенном виде.
Лабораторная работа № 13
«Доказательство непредельного характера жидкого жира»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах жиров.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок.
Реактивы: растительное масло, бромная вода (подкисленный раствор перманганата калия).
Ход работы
1. Налейте в пробирку 2 мл растительного масла и 2 мл бромной воды или подкисленного раствора перманганата калия KMnO4. (Смешивается ли масло с водным раствором? Какая из жидкостей имеет большую плотность?)
2. Встряхните содержимое пробирки. (Какой из слоёв – водный или органический обесцвечивается?)
Лабораторная работа № 14
«Взаимодействие раствора глюкозы и сахарозы с гидроксидом меди (II)»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах углеводов (моносахаридов).
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: раствор глюкозы, раствор гидроксида натрия, раствор сульфата меди (II), раствор сахарозы, серная кислота
Ход работы
Опыт 1. Взаимодействие глюкозы с гидроксидом меди (II)
· Налейте в пробирку 2-3 мл раствора глюкозы и столько же разбавленного раствора гидроксида натрия (NaOH должен быть в избытке).
· Затем добавьте несколько капель раствора сульфата меди (II).
· Пробирку с полученным раствором нагрейте.
Задания:
1. Что представляет собою раствор синего цвета?
2. Что доказывает данный опыт?
3. Почему при нагревании в пробирке появляется сначала желтый, а затем красный осадок?
4. Напишите уравнения соответствующих реакций.
Опыт 2. Взаимодействие сахарозы с гидроксидом меди(II)
Проведите опыт, аналогичный опыту 1, взяв вместо глюкозы раствор сахарозы (сахара).
· Какие изменения раствора происходят? Наблюдается ли выделение красного осадка при нагревании смеси? Что доказывает данный опыт?
Опыт 3. Гидролиз сахарозы
В пробирку, содержащую 1—2 см3 раствора сахарозы, добавьте 1—2 см3 раствора серной кислоты и кипятите смесь несколько минут.
После охлаждения добавьте к содержимому пробирки 0,5—1 см3 раствора сульфата меди(П) и приливайте избыток раствора гидроксида натрия до появления интенсивного синего окрашивания. После этого нагрейте содержимое пробирки до появления красного осадка.
· Объясните результаты опыта, ответив на вопросы:
1. Что происходит с сахарозой под влиянием раствора кислоты?
2. Наличие каких функциональных групп вы обнаружили при проведении опыта?
3. Объяснения подтвердите, составив уравнения соответствующих реакций.
Лабораторная работа № 15
«Качественная реакция на крахмал»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах углеводов (полисахаридов).
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: вода, крахмал, раствор йода в спирте, раствор иодида калия.
I
Ход работы:
· Налейте в пробирку 4-5 мл воды, добавьте немного крахмала и встряхните смесь. Образующуюся суспензию понемногу вливайте её пробирку с кипящей водой, постоянно раствор взбалтывая.
· Полученный клейстер разбавьте холодной водой (1:20) и разлейте его по 3-5 мл в две пробирки.
· В одну пробирку добавьте немного раствора йода в спирте, а в другую - раствор иодида калия.
Задание: Почему синее окрашивание появилось только в первой пробирке? (ответ запишите в графе «Вывод»).
Лабораторная работа № 16
«Проведение качественных реакций на белки»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах белков.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: раствор куриного белка, раствор гидроксида натрия, раствор сульфата меди (II), концентрированная азотная кислота, ацетат свинца.
Ход работы:
1. Биуретовая реакция (на пептидные связи)
Влейте в пробирку 2-3 мл раствора белка и добавьте
несколько миллилитров раствора гидроксида натрия, а затем немного раствора
сульфата меди (II).
2. Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
В пробирку налейте 2-3 мл раствора белка и добавьте 0,5-1 мл концентрированной азотной кислоты. (Осторожно!). Нагрейте.
3. Цистеиновая реакция (на остатки аминокислот, содержащих серу)
В пробирку налей 2-3 мл раствора белка, добавьте несколько миллилитров раствора гидроксида натрия и немного ацетата свинца.
Задания:
1. Как можно доказать наличие белков в пище?
2. Какова сущность цветных реакций белков?
Лабораторная работа № 17
«Денатурация белков»
Цель работы:
Ø Повторить и закрепить знания о химических свойствах белков.
Ø Закрепить умения и навыки пользоваться химическими реактивами и оборудованием, записывать уравнения химических
реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приемами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок, пипетка.
Реактивы: раствор куриного белка, 1%-ный раствор уксусной кислоты, 10%-ный раствор уксусной кислоты, насыщенный раствор хлорида натрия, раствор гидроксида натрия.
Ход работы:
Задания:
1. Запишите схематически уравнения реакций, проделанных вами опытов.
2. На основании проделанных опытов сделайте соответствующие выводы.
Практическая работа №1
«Приготовление растворов с заданной концентрацией»
Цель работы. Приготовление трех растворов заданной концентрации путем растворения твердого вещества в воде, разбавления раствора и добавления твердого вещества к имеющемуся раствору.
Оборудование: весы, комплект гирь, химический стакан, мерный цилиндр, стеклянная палочка.
Реактивы: вода, хлорид натрия (или сахар).
Ход работы. Получите у преподавателя вариант задания:
|
Номер варианта |
Растворенное вещество |
Масса раствора № 1, г |
Массовая доля растворенного вещества, % |
||
|
в растворе № 1 |
в растворе № 2 |
в растворе №3 |
|||
|
1 |
Хлорид натрия |
50 |
10 |
6 |
8 |
|
2 |
Хлорид натрия |
30 |
20 |
8 |
12 |
|
3 |
Сахар |
70 |
5 |
4 |
6 |
|
4 |
Сахар |
80 |
8 |
6 |
10 |
Приготовление раствора № 1. Рассчитайте массу твердого вещества и воды, необходимых для приготовления раствора № 1. С помощью технохимических весов отмерьте рассчитанную массу твердого вещества и перенесите в химический стакан. Зная, что плотность воды равна 1 г/мл, рассчитайте объем воды, необходимой для приготовления раствора. Мерным цилиндром отмерьте вычисленный объем воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
Приготовление раствора № 2. Рассчитайте массу воды, которую необходимо добавить к раствору № 1, чтобы получить раствор № 2 меньшей концентрации. Переведите вычисленную массу воды в объем, отмерьте его с помощью мерного цилиндра и добавьте в раствор № 1. (Сколько граммов раствора № 2 получено?)
Приготовление раствора № 3. Рассчитайте массу твердого вещества, которое следует добавить к раствору № 2, чтобы получить раствор № 3 большей концентрации. На технохимических весах отмерьте необходимую массу вещества, добавьте его в рас твор № 2 и перемешайте стеклянной палочкой до полного растворения. (Сколько граммов раствора № 3 получено?)
Практическая работа №2
«Получение, собирание и распознавание газов»
Цель работы. Получение и собирание газообразных неорганических веществ, их идентификация с помощью качественных реакций, а также изучение некоторых свойств.
Вариант 1
Получение аммиака изучение его свойств. Ознакомление со свойствами водного раствора аммиака
Задания:
Оборудование: детали прибора получения аммиака, лабораторный штатив, штатив с пробирками, фарфоровая ступка с пестиком, ложечка или шпатель, стеклянные палочки (2 шт.), пробка с держателем, нагревательный прибор.
Реактивы: кристаллические гидроксид кальция и хлорид аммония, конц. соляная, конц. азотная и серная (20% -я) кислоты, вода (в стакане), раствор фенолфталеина, раствор хлорида железа (III)
Ход работы.
Получение аммиака.
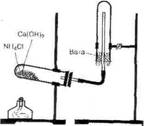 • Соберите прибор для
получения аммиака (рис. 1), испытайте его на герметичность и закрепите его в
штативе так, чтобы удобно было нагревать пробирку.
• Соберите прибор для
получения аммиака (рис. 1), испытайте его на герметичность и закрепите его в
штативе так, чтобы удобно было нагревать пробирку.
 |
Рис. 1. Прибор для получения аммиака • Решите, какое положение прибора (а, б, в или г) является правильным.
· Приготовьте три сухих (почему) пробирки, которые предстоит наполнить аммиаком. Закройте их пробками.
· В ступку насыпьте по одной ложечке хлорида аммония и гидроксида кальция, перемешайте их, разотрите пестиком. Затем перенесите порцию смеси в пробирку прибора, заполнив ее не более чем на 1/3.
· Начните нагревать содержимое пробирки, при этом быстро обогрейте пламенем горелки всю пробирку, затем пламя направьте так, чтобы нагревалась поверхность смеси, и далее перемещайте пламя к отверстию пробирки.
· Наполните три пробирки аммиаком, прекратите нагревание и, не разбирая прибора, перенесите его в вытяжной шкаф.
 Изучение
свойств аммиака.
Изучение
свойств аммиака.
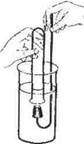
1. Исследуйте растворимость, взаимодействие аммиака с водой. Для этого опустите пробирку с аммиаком в стакан с водой и под водой откройте ее, как это показано на рисунке 2. Что вы наблюдаете? Не вынимая пробирку, закройте ее так же под водой пробкой с держателем, после чего поставьте в штатив. К полученному раствору добавьте 2—3 капли раствора фенолфталеина. Составьте уравнение реакции взаимодействия аммиака с водой.
Рис.2. Растворение аммиака в воде.
2. Смочите стеклянную палочку соляной кислотой, другую — конц. азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдаете? Составьте уравнения происходящих реакций. Почему опыт не получается при использовании серной и фосфорной кислот?
3. Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдаете? Составьте уравнения реакций образования гидросульфата и сульфата аммония.
4. В другую пробирку с раствором аммиака добавьте раствор хлорида железа (III). Что вы наблюдаете? Запишите ионные уравнения реакций.
Вариант 2
Получение оксида углерода (IV) и изучение его свойств
1. Получите углекислый газ взаимодействием мрамора с. соляной кислотой.
 2. Изучите некоторые
физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде,
относительную плотность).
2. Изучите некоторые
физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде,
относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой.
б) осуществите следующее превращение: Са(ОН)2 → СаСОз
Оборудование: прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив с пробирками, пипетки, стаканы на 150мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.).
Реактивы: 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная
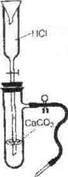
1. Получение оксида углерода (IV).
Зарядите прибор для получения углекислого газа (по рис.). Получите углекислый газ, соберите его в химический и прикройте картонным кружком. (Для чего?)
2. Изучение свойств оксида углерода (IV).
• Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой. Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
• Налейте в пробирку (на 1/4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раствором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте соответствующей реакции. Нагрейте пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
• Прилейте в пробирку (на 1/4 ее объема) известковую воду и. пропускайте через нее углекислый газ. Что вы наблюдаете? Составьте уравнения реакции.
Вариант 3
Получение кислорода и изучение его свойств
Задания:
1) получите кислород разложением перманганата калия, распознайте его;
2) проведите опыт по горению угля в кислороде, определите продукты реакции;
3) опишите проделанные вами опыты;
4) запишите уравнения реакций разложения перманганата калия и горения угля в кислороде.
Оборудование: лабораторный штатив с лапкой, пробирка с пробкой и газоотводной трубкой, химические стаканы (2 шт.) или банки с пробками, стеклянные пластины (2 шт.), железная ложечка, лучинка, спиртовка (горелка), спички, стакан с водой.
Реактивы: перманганат калия, древесный уголь, известковая вода.
Ход работы.
1. Получение и собирание кислорода. Подготовьте прибор для получения и собирания кислорода способом вытеснения воздуха. В пробирку насыпьте примерно на 1/4 ее объема перманганата калия, вложите внутрь пробирки вблизи отверстия тампон ваты (пробирку держите пальцами). Закройте теперь пробирку плотно пробкой, в которую вставлена газоотводная трубка.
Проверьте прибор на герметичность. Для этого, плотно зажав пробирку в руке, опустите конец газоотводной трубки в стакан с водой. Если наблюдается выделение пузырьков воздуха, находящегося в пробирке, значит, прибор герметичен.
После этого укрепите пробирку в лапке штатива. Конец газоотводной трубки должен доходить почти до дна стакана (или банки) для собирания кислорода.
Зажгите спиртовку и начните нагревать пробирку. Сначала обогрейте всю пробирку, затем постепенно передвигайте спиртовку таким образом, чтобы разложение вещества начиналось с поверхности.
Выделяющийся при разложении перманганата калия кислород постепенно заполняет пробирку и газоотводную трубку, и по мере накопления он начинает вытеснять воздух из стакана. Полноту заполнения сосуда (стакана или банки) кислородом можно проверить с помощью тлеющей лучинки, поднеся ее к. краю стакана. Когда вы убедитесь, что сосуд полностью заполнился кислородом, закройте стакан стеклянной пластинкой (банку можно закрыть заранее приготовленной пробкой).
В данном опыте кислород собирают методом вытеснения воздуха; можно использовать также метод вытеснения воды.
2. Изучение горения угля в кислороде. В железную ложечку положите кусочек древесного угля и раскалите его в пламени спиртовки. Затем внесите ложечку с раскаленным углем в стакан с кислородом и наблюдайте за происходящим. Как горит уголь в кислороде? После прекращения горения выньте ложечку из сосуда, влейте в него немного известковой воды и взболтайте жидкость. Что наблюдается при этом? Как и почему изменилась известковая вода?
Практическая работа №3
«Решение экспериментальных задач по неорганической химии»
Цель работы. Проведение идентификации неорганических веществ в растворах с помощью качественных реакций или путем выявления характерных свойств.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: растворы солей: хлорида натрия, карбоната натрия, сульфата натрия, хлорида аммония, хлорида бария, хлорида алюминия, карбоната натрия, нитрата аммония, сульфата калия, медь, раствор сульфата меди (II), раствор гидроксида натрия, серная кислота
Ход работы
1. С помощью качественных реакций определите, в какой из выданных вам пробирок находятся растворы хлорида натрия, карбоната натрия, сульфата натрия. (Напишите уравнения реакций в молекулярной и ионной формах.)
2. С помощью качественных реакций определите, в какой из выданных вам пробирок находятся растворы хлорида аммония, хлорида бария, хлорида алюминия. (Напишите уравнения реакций в молекулярной и ионной формах.)
3. С помощью универсальной индикаторной бумаги определите, в какой из выданных вам пробирок находятся растворы солей: карбонат натрия, нитрат аммония, сульфат калия. (Напишите уравнения реакций гидролиза в молекулярной и ионной формах.)
4. Проведите химические реакции, позволяющие осуществить следующие превращения:
![]()
![]()
![]()
![]() медь
оксид меди (II) сульфат меди (II)
гидроксид меди (II) оксид меди (II).
медь
оксид меди (II) сульфат меди (II)
гидроксид меди (II) оксид меди (II).
5. Опытным путем подтвердите качественный состав хлорида аммония.
6. Получите гидроксид меди (II) реакцией обмена и осуществите реакции, подтверждающие его свойств.
Практическая работа №4
«Решение экспериментальных задач на идентификацию органических соединений»
Цель работы. Распознавание органических веществ с помощью качественных реакций.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: раствор гидроксида натрия, раствор сульфата меди (II), спиртовой раствор йода.
Ход работы
1. В двух пробирках без этикеток содержатся следующие пары веществ:
а) растворы этилового спирта и муравьиной кислоты;
б) растворы этилового спирта и уксусной кислоты;
в) растворы формальдегида и глицерина;
г) растворы глюкозы и глицерина;
д) растворы формальдегида и белка;
е) растительное масло и машинное масло;
ж) крахмальный клейстер и глицерин;
з) растворы глюкозы и этанола;
и) растворы сахарозы и глюкозы.
Предложите способ экспериментального определения содержимого каждой пробирки.
2. С помощью одного и того же реактива докажите, что глюкоза является веществом с двойственной функцией.
3. Вам выданы пробирки с растворами. В одной из них содержится раствор глицерина, в другой — раствор формальдегида, в третьей — раствор глюкозы.
С помощью одних и тех же реактивов определите, в какой из пробирок находится каждое вещество.
4. Докажите опытным путем, что картофель, белый хлеб, пшеничная мука содержат крахмал.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.