
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
Бирская государственная социально-педагогическая академия
Факультет биологии и химии
КАФЕДРА ХИМИИ И МОХ
Лыгин С.А.
Кильдибаев Е.Г.
МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ОПРЕДЕЛЕНИЮ
СОДЕРЖАНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ ВДОЛЬ АВТОДОРОГ
Бирск - 2011
|
Введение……………………………………………………………………… |
4 |
|
|
Глава I. Характеристика Бирского района и токсичность тяжелых металлов………………………..………………………………………….. |
7 |
|
|
1.1. |
Физико-географическая характеристика Бирского района…… |
7 |
|
1.2. |
Токсичность тяжелых металлов………………………………… |
10 |
|
1.3. |
Действие тяжелых металлов на организм человека………………... |
12 |
|
1.3.1. |
Алюминий в жизни человека………………………………………... |
12 |
|
1.3.2. |
Ртуть – металл смерти………………………………………………... |
13 |
|
1.3.3. |
Свинец………………………………………………………. |
14 |
|
1.3.4 |
Цинк…………………………………………………………………… |
15 |
|
1.3.5. |
Медь…………………………………………………………………… |
15 |
|
1.4. |
Нормирование содержания химических веществ в почве…………. |
16 |
|
1.4.1. |
Нормативы для подвижных форм…………………………………… |
18 |
|
1.5. |
Методы удаления и детоксикации ионов тяжелых металлов…… |
18 |
|
1.5.1 |
Реагентные методы очистки…………………………………………. |
19 |
|
1.5.2. |
Механические способы обезвреживания ТМ………………………. |
21 |
|
1.6. |
Миграция химических элементов в почвах………………………… |
24 |
|
Выводы по первой главе …………………………………………………….. |
27 |
|
|
|
Глава II. Методика подготовки и проведения эксперимента… |
29 |
|
2.1. |
Методика выполнения измерений массовой концентрации свинца, меди и цинка…………………………………………………………... |
29 |
|
2.2. |
Подготовка посуды…………………………………………………… |
33 |
|
2.3. |
Приготовление растворов……………………………………………. |
33 |
|
2.3.1 |
Приготовление раствора соляной кислоты с молярной концентрацией 1молъ……………………………… ……………… |
33 |
|
2.3.2 |
Приготовление раствора трилона Б молярной концентрации 0,1 моль |
34 |
|
2.3.3. |
Приготовление насыщенного раствора хлористого калия |
34 |
|
2.3.4 |
Приготовление раствора азотной кислоты с молярной концентрацией 1молъ………………………………………………… |
34 |
|
2.3.5. |
Приготовление аттестованных растворов ионов меди………………….. |
34 |
|
2.3.6. |
Приготовление растворов-добавок ионов кадмия, свинца и меди с массовой концентрацией 10,0 мг/ мл……………………………… |
35 |
|
2.4. |
Приготовление фонового электролита…………………………………... |
35 |
|
2.5. |
Подготовка проб к анализу………………………………………………. |
35 |
|
2.6. |
Порядок измерений…………………………………………………... |
36 |
|
2.6.1. |
Регистрация вольтамперограмм раствора фонового электролита (фона) |
37 |
|
2.6.2. |
Регистрация вольтамперограмм пробы |
37 |
|
2.6.3. |
Регистрация вольтамперограмм пробы |
37 |
|
2.6.4. |
Очистка электродов |
37 |
|
|
Выводы по II главе…………………………………………………… |
38 |
|
|
Глава III. Обсуждение результатов и выводы по работе………..… |
39 |
|
3.1. |
Содержание цинка, свинца и меди в районе АЗС……………….… |
39 |
|
3.2. |
Содержание цинка, свинца и меди у начала подъема……………… |
40 |
|
3.3. |
Содержание цинка, свинца и меди на середине подъема………….. |
43 |
|
3.4. |
Содержание цинка, свинца и меди на вершине подъема |
44 |
|
|
Выводы к Главе III………………………………………………… |
47 |
|
|
Заключение ………………………………………………………….. |
48 |
|
|
Литература…………………………………………………………….. |
50 |
|
|
Приложение 1. Глоссарий …………………………………………… |
52 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Введение
Среди многих негативных последствий хозяйственной деятельности человека особое место занимает загрязнение окружающей среды тяжелыми металлами. Многие тяжелые металлы (ТМ) являются чрезвычайно токсичными даже в следовых количествах. Они способны концентрироваться в живых организмах, вызывая при этом различные патологии развития. В отличие от органических веществ, подвергающихся процессам разложения, металлы способны лишь перераспределяться между природными средами. Всякая хозяйственная деятельность оказывает влияние, и чаще всего отрицательное на окружающую среду.
Мы познакомились с освещением этой проблемы в научной литературе, собрали сведения об источниках загрязнения природной среды в нашем городе. Из литературных источников мы узнали, что из всех металлов, отнесенных к первому классу опасности. Загрязнение природной среды тяжелыми металлами носит наиболее опасный характер.
Актуальность выбранной темы заключатся в том, что:
-основным источником загрязнения нашего города является автотранспорт, работающий на этилированном бензине. Вместе с выхлопными газами свинец, образующийся при сгорании этилированного бензина, попадает в атмосферу, а из атмосферы вместе с осадками проникает в почву.
Автотранспорт перевозит более 80% грузов. Проблема выбросов вредных веществ все больше возрастает, т.к. идет интенсивный рост числа автомобилей, как в народном хозяйстве, так и у личных пользователей.
Тяжелые металлы - биологически активные металлы, оказывающие отрицательное воздействие на физиологические функции человека, биоты и состояние жизнеобеспечивающих природных сред. Тяжелые металлы относятся к загрязняющим веществам, наблюдения за которыми обязательны во всех средах.
Термин "тяжелые металлы", характеризующий широкую группу загрязняющих веществ, получил в настоящее время значительное распространение. Пристальное внимание тяжелым металлам в окружающей среде стало уделяться, когда выяснилось, что они могут вызывать тяжелые заболевания.
По чувствительности живых организмов к тяжелым металлам их можно расположить в ряд: Hg>Cu>Zn>Ni>Pb>Cd>Cr>Sn>Fe>Mn.
При классификации тяжелых металлов немаловажную роль играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции и биомагнификации. Тяжелыми следует считать металлы с плотностью более 8 г/см3: Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg.
Предмет исследования: количественное содержание в почве свинца, меди, цинка, в полосе, прилегающей к автодороге Р-315 Уфа-Янаул, в районе въезда в город Бирск. В направлении от дорожной развязки «кольцо» до КПП в районе д. Баженово (рис. 1.).

Рис. 1.Участок дороги, на котором проводился отбор проб.
Гипотеза: содержание тяжелых металлов в пробах, взятых в районе въезда в город Бирск различно и не превышает нормы ПДК.
Цель: определение количественного содержания тяжелых металлов в почве исследуемого объекта и выявление степени её загрязнения.
Достижение поставленной цели требовало решения ряда задач:
- определение основных источников загрязнения почвы;
- выявление особенностей и опасности химических загрязнений почвы (в частности тяжелыми металлами);
- проведение необходимых практических исследований состояния почв (определение содержания меди, свинца и цинка);
- обработка результатов практического этапа исследования.
Методы и приемы исследования:
1) изучили специальную литературу;
2) отбор проб позволил собрать образцы почвы для химического анализа;
3) освоение методик определения количественного содержания анализируе-мых показателей в пробах.
ГЛАВА I. ХАРАКТЕРИСТИКА БИРСКОГО РАЙОНА И
ТОКСИЧНОСТЬ ТЯЖЕЛЫХ МЕТАЛЛОВ
1.1. Физико-географическая характеристика Бирского района
Рис.2. Бирский район.
Бирск - город республиканского подчинения и центр одноименного района. Расположен в 102 км к северо-западу от Уфы (по автомобильной дороге) на возвышенном правом берегу реки Белой, в месте впадения в нее реки Бирь. Площадь его территории составляет 1717 км². С численностью населения 42,3 тыс. человек.

Рис. 3. Герб города Бирск.


1.2. Токсичность тяжелых металлов
К настоящему времени стало ясно, что токсичность тяжелых металлов обусловлена как их широким распространением и высокой миграционной подвижностью вблизи поверхности Земли, так и способностью аккумулироваться в организме человека, пищевой цепи, включаться в метаболический цикл и вызывать разнообразные физиологические нарушения, в том числе на генетическом уровне. Ионы тяжелых металлов не подвержены биохимическому разложению и могут образовывать летучие газообразные и высокотоксичные металлоорганические соединения.
Способность тяжелых металлов катализировать многие органические и неорганические реакции является одной из главных характеристик данного класса соединений. Многие тяжелые металлы легко соединяются с био-молекулами (например, с белками, пептидами, липидами, аминокислотами), образуя комплексные соединения. Поступая вместе с пищей и жидкостями, металлы удерживаются и накапливаются в теле, как в фильтре.
Организм не может освободиться от тяжёлых металлов, так как они прочно связываются с белками. Биоаккумуляция усугубляется в пищевой цепи, и организмы, находящиеся на вершине пищевой пирамиды, имеют самые высокие дозы токсикантов. Эта доза может стать в сто тысяч раз выше, чем во внешней среде. Такое накопление вещества при прохождении через пищевую цепь называют биоконцентрированием. Эти процессы трудно заметить на ранних стадиях. При достижении опасного уровня практически невозможно исправить ситуацию [2]. Этим объясняется быстрое проникновение тяжелых металлов в организм человека (через органы дыхания и питания), пищевую цепь и жизнеобеспечивающие природные среды. "Коварство" тяжелых металлов заключается в том, что они загрязняют экосистему не только быстро, но и незаметно, так как не имеют цвета, запаха, вкуса.
Для выведения тяжелых металлов из экосистемы до безопасного уровня требуется весьма продолжительный период времени при условии полного прекращения их поступления.
Кроме того, многие тяжелые металлы интенсивно поглощаются биотой. Коэффициенты биоаккумуляции при этом могут достигать нескольких порядков, поэтому загрязнение тяжелыми металлами звеньев пищевой цепи наблюдается довольно часто. Период полувыведения тяжелых металлов из организма человека обычно составляет многие месяцы.
Роль ионов металлов в физиологии человека многообразна. Необходимым считают химический элемент, при недостатке которого в организме возникают функциональные нарушения. Установлено, что в пищевой цепи широко распространен дефицит эссенциальных химических элементов. С ним связаны многие заболевания, например врожденные пороки развития, возникают при дефиците цинка. Ионы некоторых металлов служат терапевтическими агентами (использование карбоксилатов цинка против бактерий, вызывающих заболевание "ноги атлета"). При высоких концентрациях ионы металлов становятся токсичными, что ведет к функциональным деформациям и смерти. В зависимости от концентрации и продолжительности контакта металл может действовать в одном и том же организме по одному из вышеуказанных путей. Необходимый химический элемент может стать токсичным при избытке его потребления [3].
Тяжелые металлы обычно накапливаются в организме совместно. Установлены синергизм и антагонизм такого комплексного воздействия. При синергизме эффект действия многократно усиливается. Токсичность иона свинца усугубляется недостатком по кальцию. Из-за антагонизма цинка и кадмия введение избыточного количества первого приводит к уменьшению содержания последнего, отличающегося повышенной токсичностью. Токсичность тяжелых металлов сильно зависит от химических форм нахождения в окружающей среде. Особо опасны металлоорганические соединения (метилртуть ([CH3Hg]+), алкил свинца и др.), летучие тяжелые металлы (ртуть, кадмий, мышьяк, сурьма, селен, литий) легко проникают в организм человека через органы дыхания. Особую опасность представляют и тонкодисперсные твердые аэрозоли тяжелых металлов, которые широко распространены и задерживаются в легких человека, вызывая рак и другие заболевания [4].
1.3. Действие тяжелых металлов на организм человека
Тяжелые металлы проявляют широкое токсическое действие. Причем механизм воздействия индивидуален для каждого металла и обусловлен конкурирующими реакциями между необходимыми и токсичными металлами за места связывания в белковых молекулах.
Токсичные элементы даже в очень малых количествах ведут к нарушению работы нервной системы, заболеваниям почек и др. Тяжелые металлы - микроэлементы, которые присутствуют в промышленных отходах, смог на улицах от выхлопных газов автолюбителей. Они могут причинить серьезный вред здоровью человека. Вы можете этого не знать, но в тканях вашего организма содержится некоторое количество токсичного свинца. Ранее большое количество данного металла присутствовало в бензине. И это действительно было проблемой. Свинец особенно опасен для здоровья детей, поскольку ухудшает способность к учебе и нарушает поведение [4].
1.3.1. Алюминий в жизни человека
Алюминий присутствует в дезодорантах, некоторых видах кухонной посуды и пищевой фольге. В естественном виде этот метал встречается в почве и продуктах питания. Избыток его может принести вред здоровью человека. Тепловая обработка продуктов, содержащих кислоту (например, томатов), в алюминиевой посуде или фольге опасна проникновением в пищу большого количества алюминия. Он входит в состав средств, нейтрализующих кислоту, а также порошков для выпечки и соли.
Избыток алюминия может вызвать высыпания на коже, расстройства кишечника, а также причинить вред костям и почкам.
Избыточное накопление алюминия в организме взрослого человека в течение длительного времени может влиять на состояние опорно-двигательного аппарата (склонность к развитию остеопороза, остеохондроза, остеопатий, заболеваний, почек (риск мочекаменной болезни, нефропатия), ЦНС (риск прогрессирующей энцефалопатии у пациентов, подвергшихся диализу). У пожилых - риск развития болезни Альцгеймера и Паркинсонизма. У молодых - нарушения внимания, памяти и др. Отложение алюминия в мягких тканях может способствовать развитию в них фиброзных изменений. Токсичность алюминия во многом связана с его антагонизмом по отношению к кальцию и магнию, способностью влиять на функции околощитовидных желез, легко образовывать соединения с белками, накапливаясь в почках, костной ткани, центральной нервной системе [5].
1.3.2. Ртуть – металл смерти
Каждый знает, что это «металл смерти». В древности ртуть называли «живым серебром». Невозможно перечислить болезней, вызванных «живым серебром» (ртутью).
Всюду, где развивается тяжелая промышленность и не находят средств на очистные сооружения, дело всегда кончается отравлением окружающей среды. Ртуть коварна, так как действует бессимптомно. И это самое страшное. Необратимые процессы в организме начинаются незаметно: появляется головная боль, головокружение, воспаление десен, затруднения в концентрации внимания, подташнивание, бессонница, выпадение волос. И только спустя какое-то время нарушается речь, появляются состояние страха, нервозность или сонливость, количество белых кровяных телец уменьшается - все это признаки потери иммунитета, состояние, при котором даже незначительная инфекция может оказаться смертельной [5]. В завершение этого «ползучего» отравления исчезает подвижность суставов, человек превращается в одеревеневшую куклу. Ртуть накапливается в организме животных и людей понемногу, но те, кто живет вблизи от предприятий, загрязняющих воздух отравляющими веществами, накапливают в себе огромное количество этих ядов, причем их накопления могут дать о себе знать и в последующих поколениях. При хроническом отравлении ртутью развиваются астеновегетативный синдром, тремор, психические нарушения, эретизм, лабильный пульс, тахикардия, гингивит, протеинурия, изменения со стороны крови. При пероральном поступлении ртути наблюдаются язвенно-некротический гастроэнтерит, в дальнейшем развивается некротический нефроз с гибелью эпителия проксимальных отделов почечных канальцев.
Отравление органическими соединениями ртути приводит к болезни Минамата, энцефалопатии, мозжечковой атаксии, нарушению зрения и слуха. При продолжающемся воздействии заболевание прогрессирует до патогномоничной триады - атаксия, дизартрия и сужение полей зрения [5].
1.3.3. Свинец
При свинцовом токсикозе поражаются, в первую очередь, органы сердечнососудистой системы и кроветворения (ранее развитие артериальной гипертензии и атеросклероза, анемия), нервная система (энцефалопатия и нейропатия), почки (нефропатия). При начальных формах хронического сатурнизма отмечаются изменения в порфиритовом обмене, ретикулоцитоз (до 20-25%), увеличения количества эритроцитов с базофильной зернистостью до 25-40%, но при этом уровень гемоглобина и количество эритроцитов обычно в пределах нормы [8]. Для всех регионов России свинец - основной антропогенный поллютант из группы тяжелых металлов, что связано с высоким индустриальным загрязнением и выбросами автомобильного транспорта, работающего на этилированном бензине
Загрязнение свинцом окружающей среды одна из основных проблем профилактики и лечения экологозависимых хронических заболеваний [9].
1.3.4. Цинк
Цинк (Zn) поступает в придорожное пространство в результате истирания различных деталей, эрозии оцинкованных поверхностей, износа шин, за счет использования в маслах присадок, содержащих этот металл [11].
При тиреотоксикозе увеличивается количество цинка в тканях щитовидной железы. При передозировке цинка наблюдаются приступы слабости, опасность отравления, т. к. цинк проявляет токсические свойства в дозе 150–600мг, летальная доза – 6 г. Может быть канцерогенен. Оксид цинка и его металлическая пыль вызывают патологические изменения в легких. При попадании на кожу соединений этого металла возникают экзема и дерматит. Нельзя пить воду, хранившуюся в оцинкованных емкостях: растворимые соединения цинка окажут вредное действие на желудочно-кишечный тракт [12].
Нужно отметить, что металлический цинк не токсичен для организма, выраженной токсичностью обладают сульфаты, хлориды и другие его соли.
В больших количествах он вызывает рвоту [13].
1.3.5. Медь.
Медь (Cu) очень важный для жизни металл. Медь входит в состав ряда ферментов–тирозиназы, цитохромоксидазы, стимулирует кроветворную функцию костного мозга.
Токсическая доза меди больше 250 мг. Попав в организм, соединение меди поступает в печень, которая является главным складом этого микроэлемента. Медь концентрируется также в мозге, сердце и почках, мышечной и костной тканях. Многие растения и животные концентрируют медь, и лечебное действие при их использовании связано в большей мере с этим элементом. В больших количествах медь очень опасна для организма. Отравление медью приводит к тяжелейшим заболеваниям – анемии, заболеванию печени, болезни Вильсона (медная болезнь). И хотя у человека отравление медью возникает редко благодаря тонким механизмам всасывания и выведения меди из организма, в больших дозах медь вызывает рвоту. Также может наступить общее отравление медью (понос, ослабление дыхания и сердечной деятельности, удушье,) [14].
Признаки переизбытка меди у человека: расстройства нервной системы (ухудшение памяти, депрессия, бессонница); при вдыхании паров может проявляться "медная лихорадка" (озноб, высокая температура, проливной пот, судороги в икроножных мышцах); воздействие пыли и окиси меди может приводить к слезотечению, раздражению конъюнктивы и слизистых оболочек, чиханию, жжению в зеве, головной боли, слабости, болям в мышцах, желудочно-кишечным расстройствам; нарушения функций печени и почек; поражение печени с развитием цирроза и вторичным поражением головного мозга, связанным с нарушением обмена меди.
Соли меди относятся ко II классу опасности [15].
1.4. Нормирование содержания химических веществ в почве
Разработанные теория, методология и принципиальная схема нормирования химических веществ в почве позволили создать “Методические рекомендации по установлению предельно-допустимых концентраций (ПДК) химических веществ в почве” на основе которых в стране разработано большинство нормативных показателей для техногенных химических веществ.
Предельно допустимая концентрация (ПДК) - количество вредного вещества в окружающей среде, отнесенное к массе или объему ее конкретного компонента, которое при постоянном контакте или при воздействии за определенный промежуток времени практически не влияет на здоровье человека и не вызывает неблагоприятных последствий у его потомства.
Выбор определяемых показателей зависит от целей контроля. Если обследуемый участок является производственной площадкой, то необходимо контролировать те соединения, которые применялись при производстве.
На рекультивируемых участках почвы кроме загрязнителей проверяют и обеспеченность почвы питательными веществами: калием, натрием, фосфором. Учитывая специфику природно-климатических условий каждого региона, а также отсутствие нормативных показателей на многие вещества, оценку состояния почв необходимо производить по отношению к фоновым участкам [15].
Фоновая концентрация – это средняя концентрация вещества в исследуемых почвах, зависящая от геологических и почвообразующих условий [16].
Гигиенические нормативы предельно допустимые концентрации некоторых химических веществ элементов в почве представлены в таблице 1
Таблица 1
Предельно допустимые концентрации приоритетных токсикантов в объектах окружающей природной среды
|
Наименование вещества |
ПДК мг/кг почвы с учетом фона (кларк) |
Показатели вредности |
|||
|
транслокационный |
миграционный |
общесанитарный |
|||
|
водный |
воздушный |
||||
|
Подвижная форма |
|||||
|
Медь |
3,0 |
3,5 |
72,0 |
- |
3,0 |
|
Никель |
4,0 |
6,7 |
14,0 |
- |
4,0 |
|
Цинк |
23,0 |
23,0 |
200,0 |
- |
37,0 |
|
Кобальт |
5,0 |
25,0 |
> 1000,0 |
- |
5,0 |
|
Водорастворимая форма |
|||||
|
Фтор |
10,0 |
10,0 |
10,0 |
- |
25,0 |
|
Валовое содержание |
|||||
|
Сурьма |
4,5 |
4,5 |
4,5 |
- |
50,0 |
|
Марганец |
1500,0 |
3500,0 |
1500,0 |
- |
1500,0 |
|
Ванадий |
150,0 |
170,0 |
350,0 |
- |
150,0 |
|
Марганец + ванадий |
1000,0 + 100,0 |
1500,0 + 150,0 |
2000,0 + 200,0 |
- |
1000,0 + 100,0 |
|
Свинец |
30,0 |
35,0 |
260,0 |
- |
30,0 |
|
Мышьяк |
2,0 |
2,0 |
15,0 |
- |
10,0 |
|
Ртуть |
2,1 |
2,1 |
33,3 |
2,5 |
5,0 |
|
Свинец + ртуть |
20,0 + 1,0 |
20,0 + 1,0 |
30,0 + 2,0 |
- |
30,0 + 2,0 |
|
Хлористый калий |
560,0 |
1000,0 |
560,0 |
1000 |
5000,0 |
|
Нитраты |
130,0 |
180,0 |
130,0 |
- |
225,0 |
|
Бенз(а)пирен (БП) |
0,02 |
0,2 |
0,5 |
- |
0,02 |
|
Бензол |
0,3 |
3,0 |
10,0 |
0,3 |
50,0 |
|
Толуол |
0,3 |
0,3 |
100,0 |
0,3 |
50,0 |
|
Изопропилбензол |
0,5 |
3,0 |
100,0 |
0,5 |
50,0 |
|
Альфаметилстирол |
0,5 |
3,0 |
100,0 |
0,5 |
50,0 |
|
Стирол |
0,1 |
0,3 |
100,0 |
0,1 |
1,0 |
|
Ксилолы |
0,3 |
0,3 |
100,0 |
0,4 |
1,0 |
|
сероводород (H2S) |
0,4 |
160,0 |
140,0 |
0,4 |
160,0 |
|
элементарная сера |
160,0 |
180,0 |
380,0 |
- |
160,0 |
1.4.1. Нормативы для подвижных форм
Определение подвижных форм, при применении кислотной вытяжки (1н HCl) концентрация металлов в водной вытяжке показывает степень подвижности элементов в почве.
Предельно допустимое содержание подвижной формы тяжелых металлов в почве представлены в таблице 2
Таблица 2
ПДК подвижных форм некоторых химических элементов мг/кг
|
Элемент |
Содержание |
Элемент |
Содержание |
Элемент |
Содержание |
|
Ртуть |
0,1 |
Сурьма |
15 |
Свинец |
60 |
|
Кадмий |
1,0 |
Мышьяк |
15 |
Цинк |
60 |
|
Кобальт |
12 |
Никель |
36 |
Ванадий |
80 |
|
Хром |
15 |
Медь |
50 |
Марганец |
600 |
1.5. Методы удаления и детоксикации ионов
тяжелых металлов
Биологическая взаимосвязь между почвой и человеком осуществляется главным образом путем обмена веществ [17]. Почва является как бы поставщиком минеральных веществ, необходимых для цикла обмена веществ, для роста растений, потребляемых человеком и травоядными животными, съедаемыми в свою очередь человеком и плотоядными животными. Таким образом, почва обеспечивает пищей многих представителей растительного и животного мира.

Рис.6. Природа в руках человека.
Наиболее эффективным вариантом сохранения объектов окружающей среды от негативного воздействия ТМ является предотвращение их антропогенного поступления.
Однако в процессе производства человеку не всегда удается избежать эмиссии металлов в атмосферу, почву, поверхностные воды. Соли тяжелых металлов в сточных водах содержатся в виде раствора, а также взвесей. Они способны восстанавливаться, окисляться, осаждаться, адсорбироваться в виде индивидуальных веществ и комплексов. Для удаления солей ТМ из сточных вод используются реагентные и физико-химические методы [18].
1.5.1. Реагентные методы очистки
Реагентные методы очистки наиболее эффективно, применяются для удаления соединений цинка, меди, никеля, свинца, кадмия, кобальта и др.
При использовании этих методов достигается перевод растворимых в воде соединений веществ в нерастворимые с последующим отделением их в виде осадков. В качестве реагентов для удаления сточных вод ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия, сульфиды кальция и натрия, различные шлаки.
Выделение катионов цинка щелочами основано на переводе их в
труднорастворимый гидроксид цинка:
Zn2+ + 2OH - → Zn(OH)2↓
Находящиеся в растворе катионы свинца переводят в осадок в виде одного из трех труднорастворимых соединений:
Pb2+ + 2OH - → Pb(OH)2↓
2Pb2+ + CO32- + 2OH - → (PbOH)2CO3↓
Pb2+ + CO32- → PbCO3↓
Карбонат свинца в воде нерастворим.
Для очистки сточных вод от ионов металлов (цинка, свинца, меди, хрома, никеля, кадмия, ванадия, марганца) применяют ионный обмен. Ионный обмен на примере очистки воды от цинка происходит по уравнению:
2RH + Zn2+ = R2 + 2H+
С течением времени работы катионита его обменная емкость истощается, необходимо проводить его регенерацию:
ZnR2 + nH2SO4 ←→ 2RH + ZnSO4 + (n-1)H2SO4
Наиболее эффективными методами очистки воды от ионов тяжелых металлов является электро- и гальванокоагуляция.
Для ликвидации последствий загрязнения почв тяжелыми металлами используются ряд приемов. На сильно поврежденных почвах вблизи отвалов и хранилищ отходов цветной металлургии ТМ удаляют из загрязненного слоя (10-30 см) путем перевода их соединений в подвижную форму и дальнейшего промывания раствором FeCl3 в кислой среде. Однако механическое перемещение и промывка достаточно дороги, поэтому чаще используют более дешевые способы, например, внесение веществ-инактиваторов. Так, при применении меркапто-8-триазина прочно фиксируются кадмий, свинец, ртуть и никель, а элементы питания – кальций, магний, калий и др. при этом не закрепляются [19].
Защитным эффектом обладает и известкование почв. При этом происходит нейтрализация среды и образование коллоидов гидроксидов тяжелых металлов, находящихся в почвенном растворе.
Важное место в детоксикации тяжелых металлов отводится органическим удобрениям, которые выступают адсорбентами ионов ТМ. В качестве поглотителей ТМ используют и глинистые минералы (монтмориллонит, вермикулит). Все мероприятия по детоксикации почв направлены на недопущение движения ионов ТМ по пищевым цепочкам в экосистеме [20].
1.5.2. Механические способы обезвреживания ТМ
1. Удаление верхнего, наиболее загрязнённого слоя почвы и его захоронение.
2. Перемешивание верхнего загрязнённого слоя с незагрязнённым грунтом.
3. Нанесение на загрязненную почву слоя чистой плодородной земли мощностью до 10см или грунта. Приём может быть эффективен в зоне промывного водного режима. В почвах с непромывным водным режимом положительный эффект наблюдался лишь первые 4-5 лет, а затем часто следует вторичное загрязнение почв в результате вторичного засоления солями загрязняющих элементов. Положение исправляли созданием двухслойного покрова: насыпали слой карбонатного суглинка мощностью 10-15см для создания экрана и защиты вышележащего насыпного гумусированного слоя [21].
На загрязнённых тяжелыми металлами территориях необходимо также проведение агротехнических мероприятий:
1. Применение органических и минеральных удобрений. Использование органических удобрений обогащает почву органическим веществом. Органическое вещество является хорошим адсорбентом анионов и катионов, повышает буферность почвы, снижает концентрацию солей в почвенном растворе. Всё это препятствует поступлению тяжелых металлов в растения . Внесение минеральных удобрений ведет к созданию оптимального состояния растений и снижению токсического действия тяжелых металлов на них .
2. Подбор наиболее устойчивых к загрязнению тяжелыми металлами сельскохозяйственных культур. Например, картофель и зерновые более устойчивы к загрязнению, чем овощные культуры .
3. Выявление сортов сельскохозяйственных культур, устойчивых к загрязнению тяжелыми металлами и не накапливающих эти элементы в товарной продукции. Также целесообразно проведение селекции новых сортов по этим признакам.
4. Возделывание тех продовольственных культур, у которых в пищу используются плоды, так как в репродуктивных органах растений тяжелые металлы накапливаются меньше, чем в вегетативных.
5. Если по каким-либо причинам проведение мероприятий по инактивации ТМ нецелесообразно, то на таких землях рекомендуется возделывать технические культуры: лен, клещевину, картофель для переработки на крахмал, сахарную свеклу и т.д. Можно также использовать эти земли для семенных посевов овощных культур.
Существуют также способы, направленные на удаление тяжелых металлов из верхнего корнеобитаемого слоя почвы. К ним относятся промывание загрязнённой почвы различными экстрагентами, электромелиорация и фитомелиорация.
Для промывки загрязнённых тяжелыми металлами почв используются слабые растворы серной кислоты, хлоридов алюминия и железа и этилендиаминтетрауксусной кислотой (ЭДТА). тяжелые металлы были более подвижны при вымывании раствором солей алюминия и железа, чем при использовании раствора серной кислоты. При промывке почв вышеуказанными реагентами наблюдалась миграция тяжелых металлов с промывными водами и подкисление почв. Высокая степень извлечения тяжелых металлов из почвы (до 90% и более) отмечена при промывке ЭДТА , но при использовании этого экстрагента следует учитывать содержание карбонатов, т.к. на растворение кальцита может расходоваться до 90% внесенной ЭДТА. Увеличение концентрации ЭДТА повышает эффективность удаления тяжелых металлов. Однако при использовании этого способа существует опасность загрязнения грунтовых вод.
В последнее время был разработан новый способ очистки почв от ТМ–электромелиорация. Он основан на осаждении соединений тяжелых металлов, находящихся в проводящем растворе на катоде или аноде (в зависимости от знака заряда иона), Zn, Cu, Cr, Cd, Pb могут быть удалены из искусственно загрязнённого песка с эффективностью более 90 %. Однако электромелиорация является весьма дорогостоящим способом и предпочтение отдается фитомелиорации [22].
Фитомелиорация основана на использовании выноса химических элементов растениями. Для этой цели используются растения, способные накапливать тяжелые металлы в больших количествах (гипераккумулянты). В качестве таких растений зарубежными исследователями рекомендуются Альпийская ярутка (Thlaspi caerulescens), Резушка Галлера (Cardaminopsis halleri) и др. Для вышеупомянутых растений вынос цинка с 1га составил соответственно: 24-43кг, 7,8; 4,7; 4,0; 3,6кг, тогда как для рапса масличного эта величина составляет 0,5кг, а у редиса 0,2кг . Альпийская ярутка также способна накапливать большое количество кадмия.
На практике вышеперечисленные способы обезвреживания тяжелых металлов применяются, как правило, в комплексе. Так, после промывки загрязнённых почв целесообразно производить внесение мелиорантов (например, извести), снижающих подвижность тяжелых металлов. Также при использовании механических и химических способов инактивации тяжелых металлов рекомендуется проведение агротехнических мероприятий. При проведении мероприятий по очистке загрязнённых тяжёлыми металлами почв необходимо, прежде всего, выбрать наименее затратные в данной конкретной ситуации способы обезвреживания загрязнителей, сопоставить расходы на проведение мелиоративных мероприятий с возможными доходами от сельскохозяйственного использования земельного участка, выбрать культуры, выращивание которых даст наилучший результат, рассчитать рентабельность производства и срок окупаемости мероприятий по санации почв. Следует иметь в виду, что механические и химические способы обезвреживания ТМ намного дороже, чем агротехнические. Если проведение мероприятий по очистке загрязнённых тяжёлыми металлами почв экономически нецелесообразно, то нужно использовать данную территорию для промышленных целей [22].
1.6. Миграция химических элементов в почвах
До тех пор, пока тяжелые металлы прочно связаны с составными частями почвы и труднодоступны, их отрицательное влияние на почву и окружающую среду будет незначительным. Однако если почвенные условия позволяют перейти тяжелым металлам в почвенный раствор, появляется прямая опасность загрязнения почв, возникает вероятность проникновения их в растения, а также в организм человека и животных, потребляющие эти растения. Кроме того, тяжелые металлы могут быть загрязнителями растений и водоемов в результате использования сточных вод. Отрицательное влияние ТМ зависит, в большей степени, от их подвижности и растворимости [23].
Тяжелые металлы иногда обнаруживаются в почвах в низких концентрациях, они формируют устойчивые комплексы с органическими соединениями и вступают в специфические реакции адсорбции легче, чем щелочные и щелочноземельные металлы [24].
Миграция тяжелых металлов в почвах может происходить с жидкостью и суспензией при помощи корней растений или почвенных микроорганизмов. Миграции растворимых соединений происходит вместе с почвенным раствором (диффузия) или путем перемещения самой жидкости. Вымывание глин и органического вещества приводит к миграции всех связанных с ними металлов. Миграция летучих веществ в газообразной форме, например, диметила ртути, носит случайный характер, и этот способ перемещения не имеет особого значения. Миграция в твердой фазе и проникновение в кристаллическую решетку являются больше механизмом связывания, чем перемещения [25].
Дождевые черви и другие организмы могут содействовать миграции тяжелых металлов механическим или биологическим путями, перемешивая почву или включая металлы в свои ткани [26].
Из всех видов миграции самая важная – миграция в жидкой фазе, потому что большинство металлов попадает в почву в растворимом виде или в виде водной суспензии и фактически все взаимодействия между тяжелыми металлами и жидкими составными частями почвы происходит на границе жидкой и твердой фаз [27].
Тяжелые металлы в почве через трофическую цепь поступают в растения, а затем потребляются животными и человеком. В круговороте тяжелых металлов участвуют различные биологические барьеры, вследствие чего происходит выборочное бионакопление, защищающее живые организмы от избытка этих элементов. Все же деятельность биологических барьеров ограничена, и чаще всего тяжелые металлы концентрируются в почве. Устойчивость почв к загрязнению ими различна в зависимости от буферности [28].
Почвы с высокой адсорбционной способностью соответственно и высоким содержанием глин, а также органического вещества могут удерживать эти элементы, особенно в верхних горизонтах. Это характерно для карбонатных почв и почв с нейтральной реакцией. В этих почвах количество токсических соединений, которые могут быть вымыты в грунтовые воды и поглощены растениями, значительно меньше, чем в песчаных кислых почвах. Однако при этом существует большой риск в увеличении концентрации элементов до токсичной, что вызывает нарушение равновесия физических, химических и биологических процессов в почве. Тяжелые металлы, удерживаемые органической и коллоидной частями почвы, значительно ограничивают биологическую деятельность, ингибируют процессы нитрификации, которые имеют важное значение для плодородия почв [29].
Песчаные почвы, которые характеризуются низкой поглотительной способностью, как и кислые почвы очень слабо удерживают тяжелые металлы, за исключением молибдена и селена. Поэтому они легко адсорбируются растениями, причем некоторые из них даже в очень малых концентрациях обладают токсичным воздействием [30].
Максимальное содержание ТМ в почвах наблюдается на расстоянии 1-5 км от источника загрязнения (ближняя зона). Они могут превышать уровни на 1-2 порядка. По мере удаления от источника загрязнения содержание металлов уменьшается и на расстоянии 15-20 км приближается к фоновому уровню. Глубина проникновения ТМ в загрязненных почвах обычно не превышает 20 см, при сильном загрязнении проникают на глубину до 160 см. Опасность такого залегания состоит в том, что при кислой реакции среды и промывном режиме имеется угроза поступления токсичных металлов в виде водорастворимых форм в грунтовые воды [31]. Для почв, расположенных вне зоны влияния источника загрязнения, характерно, как правило, равномерное распределение ТМ. Наибольшей миграционной способностью обладают Hg и Zn, кадмий занимает промежуточное положение между ними [27].
Выводы по первой главе
Накопление ТМ растительностью и почвой в значительной степени зависит от рельефа местности, направления ветра и количества транспортного потока, скорости движения, типа машин, удаленности от дороги и наличии защитных насаждений вдоль автомагистрали.
Растительность придорожной полосы шириной до 10м подвержена сильному загрязнению. В связи с этим целесообразно на участках вдоль автодорог, незащищенных лесополосами, высевать злаки, а не кормовые культуры, а также не рекомендуется выпас скота и покос сена на корм. В загрязненных зонах полевых ландшафтов следует выращивать кормовые и технические культуры и запретить сбор плодов, грибов, ягод в лесных ландшафтах.
Основная масса ТМ оседает в придорожной полосе на удалении 10 – 20 м, где обнаружено превышение ПДК по Pb в 1,5 раза в верхнем 0–30 сантиметровом слое почв. Особо заметное накопление ТМ наблюдается на участках с пониженным рельефом. На расстоянии до 100м от трассы содержание в почве Zn, Mn, Fe, Pb, Cd, Co, Mo и Cr в депрессиях рельефа оставалось повышенным по сравнению с ровными участками. Очевидно, накопление ТМ отрицательных элементах рельефа вызвано стоком пылевых частиц с полотна дороги с талыми и дождевыми водами. Мировой опыт показывает, что основная масса выбросов автотранспорта оседает в непосредственной близости от автодорог, причем зона наибольшего загрязнения ТМ и канцерогенами занимает полосу шириной до 10-20м.
Лесополосы вдоль автодорог служат барьером на пути распространения вредных выбросов. На незащищенных лесополосами участках (75–100 м) отмечается повышенное содержание ТМ по сравнению с фоном. Для эффективного снижения вредных выбросов автотранспорта целесообразно рекомендовать примагистральные посадки деревьев с густыми кронами и кустарники. Конструкция лесных полос должна быть ажурно-плотной, породный состав – смешанным. Установлено, что двухрядная посадка деревьев с кустарником высотой 1,5 может снизить концентрацию свинца на 65%.
ГЛАВА II. МЕТОДИКА ПОДГОТОВКИ И ПРОВЕДЕНИЯ
ЭКСПЕРИМЕНТА
2.1. Методика выполнения измерений массовой концентрации
свинца, меди и цинка
Настоящая методика выполнения измерений устанавливает инверсионно-вольтамперометрический метод определения массовой доли кислоторастворимых форм и валового содержания тяжелых металлов и токсичных элементов в почвах, грунтах, донных отложениях, осадках сточных вод.Метод обеспечивает получение результатов измерений массовой доли кадмия, свинца, меди в почвах в диапазонах и с метрологическими характеристиками.
Инверсионно-вольтамперометрический метод основан на зависимости тока, проходящего через ячейку анализатора с анализируемым раствором, от массовой доли элемента, содержащегося в растворе и функционально связанного с формой и параметрами приложенного к электродам поляризующего напряжения.Высота пика элемента, регистрируемого на вольтамперограмме, пропор-циональна массовой доле элемента в растворе.
Процесс вольтамперометрического определения содержания элементов в инверсионном режиме включает:-электрохимическую очистку рабочего электрода;-электрохимическое накопление элемента на рабочем электроде;-электрорастворение накопленного элемента при развертке потенциала при заданных режимах.Массовую концентрацию элемента в растворах проб после их минерализации определяют методом «стандартных добавок», не требующим построения градуи-ровочной кривой.
«Метод стандартных добавок» основан на регистрации при одних и тех же параметрах измерений вольтамперограмм серии растворов для каждой пробы:1) фонового электролита (фона); 2) пробы, подготовленной к измерениям; 3) той же пробы, в которую вводят раствор-добавку измеряемого элемента, с известной массовой концентрацией.Результаты измерений рассчитываются автоматически сравнением значений аналитических сигналов элемента на вольтамперограммах серии растворов.При подготовке к выполнению измерений выполняют следующие работы: подготовку посуды, приготовление растворов, подготовку анализатора к работе.
Измерения проводятся с помощью программного комплекса
“Polar-4.0” которая предназначена для автоматического определения содержания тяжелых металлов и других элементов в водных средах методом инверсионной вольтамперометрии (ИВА) с применением комплекса ИВА-400МК, в состав которого входит программа “Polar-4.0”. Данная программа работает с компьютерным полярографом, реализованный на базе датчика АКВ-07 (рис.7.). Благодаря этому весь процесс измерения автоматизирован.
Программа обеспечивает измерение, обработку данных, создание протокола измерений, хранение, поиск и анализ протоколов измерения для следующих тяжелых металлов и некоторых веществ, не относящихся к тяжелым металлам: Сd, Cu, Zn, Pb, Hg, Vi, Fe, As, сернистая кислота.

Рис.7. Аналитический комплекс
Отбор проб почвы
Пробы отбирались вдоль автотрассы республиканского значения
Р-315 Уфа – Янаул, в районе города Бирск. Изучаемый участок, протянулся в общей сложности на более чем на 7,5 км. Пробы отбирались в на 4 участках (рис.8).
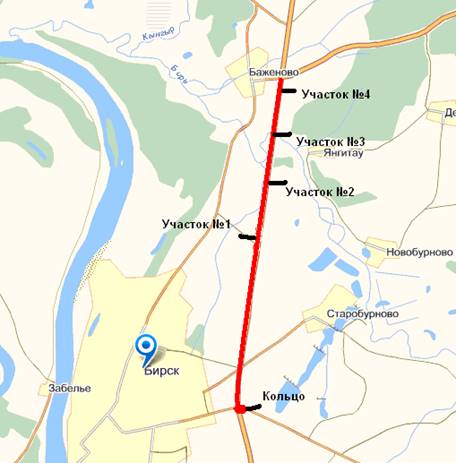
Рис. 8. Схема отбора проб.
. А именно:
· в районе автозаправочной станции «Башнефть». Участок №1;
· у начала подъема. Участок №2;
· на середине подъема. Участок №3;
· на вершине подъема. Участок №4.
Таким образом, были взяты пробы почвы с четырех точек. Анализы собранных образцов почвы проводились в трех повторностях, что позволило получить достоверные сведения о содержании изучаемых элементов в почве.
Пробы отбирались по методике конверта (рис.9,10.). Метод конверта – наиболее распространенный способ отбора смешенных почвенных образцов и чаще всего применяется для исследования почвы гумусового горизонта при этом из точек контролируемого элементарного участка берут 5 образцов почвы. Точки должны быть расположены так, чтобы, мысленно соединив их прямыми линиями, получить изображение запечатанного конверта (длина его стороны может составлять от 1 до 10 м). Обычно при изучении почвы отбирают пробы гумусового горизонта с глубины около 20 см, что соответствует длине штыка лопаты. Из каждой точки отбирают около 1 кг почвы. Почвенные образцы упаковывают в полиэтиленовые или полотняные мешочки и прилагают к ним этикетки (сопроводительные талоны).
Для анализов отбиралась почва с верхних горизонтов на глубине 0-10 см. Образцы почвы очищались от растительных остатков и живых частей растений. Затем ее поместили в пластиковую посуду с крышкой, что позволило изолировать почву от контакта с окружающей средой до начала экспериментов.

Рис. 9. Отбор проб участок №1.

Рис. 10. Отбор проб участок №2.
Порядок подготовки к измерениям
При подготовке к выполнению измерений выполняют следующие работы: подготовку посуды, приготовление растворов, подготовку анализатора к работе.
2.2. Подготовка посудыНовую и загрязненную посуду тщательно промывают хромовой смесью, затем многократно споласкивают водопроводной водой, несколько раз - дистиллированной водой .
При выполнении измерений непосредственно перед использованием подготовленную посуду дополнительно промывают раствором азотной кислоты с молярной концентрацией 1 моль и тщательно ополаскивают дистиллированной водой.
2.3. Приготовление растворов
2.3.1.. Приготовление раствора соляной кислоты с
молярной концентрацией 1молъ.
В мерную колбу вместимостью 1 л наливают немного дистиллированной воды и осторожно цилиндром приливают 165 мл концентрированной соляной кислоты ( плотностью 1,185 г/см3). Раствор перемешивают и после охлаждения доводят до метки дистиллированной водой.
2.3.2.Приготовление раствора трилона Б
молярной концентрации 0,1 моль
Трилон Б помещают в мерную колбу вместимостью 250 мл и растворяют в дистиллированной воде, после чего содержимое колбы доводят до метки и перемешивают.
2.3.3. Приготовление насыщенного раствора хлористого калия
Хлорид калия растворяют при нагревании в 150 мл дистиллированной воды до насыщения. Горячий раствор фильтруют и охлаждают до комнатной температуры. Раствор хранят в контакте с выпавшими кристаллами соли.
2.3.4.Приготовление раствора азотной кислоты с
молярной концентрацией 1молъ
В мерную колбу вместимостью 1 л, добавляют 500 мл дистиллированной воды, цилиндром вместимостью 100мл вносят 62 мл концентрированной азотной кислоты (плотностью 1,42 г/см3) и доводят объем раствора до метки дистиллированной водой.
2.3.5.Приготовление аттестованных растворов ионов меди,
свинца и серебра с массовой концентрацией каждого элемента 10,0 мг/лРастворы ионов кадмия, свинца и меди готовят раздельно. Вскрывают стеклянную ампулу ГСО соответствующего иона, выливают содержимое в сухой стакан. Пипеткой объемом 5,0 мл переносят 5.0 мл раствора ГСО в мерную колбу объемом 50 мл и доводят объем раствора до метки дистиллированной водой.2.3.6.Приготовление растворов-добавок ионов кадмия,
свинца и меди с массовой концентрацией 10,0 мг/ млРастворы-добавки готовят отдельно для каждого элемента разбавлением дистиллированной водой соответствующих растворов, приготовленных по 2.3.5.Емкость мерных колб, объем аттестованных растворов, массовая концентрация элементов в растворах-добавках и сроки хранения приведены в таблице 3.
Таблица 3
Емкость, объем, концентрация и сроки хранения растворов - добавок
Массоваяконцентрацияраствора,мг/дм |
Объемисходногораствора,см3 |
Вместимостьмерной колбы.см3 |
Массовая концентрация раствора-добавки, мг'дм"' |
Срок хранения |
100 |
5 |
50 |
10.0 |
30 дней |
2.4. Приготовление фонового электролита
Раствора фона готовят перед регистрацией вольтамперограмм. Дистиллированную воду объемом 20 мл пипеткой переносят в выпарительную чашку, добавляют 1 мл концентрированной азотной кислоты и осторожно, не допуская разбрызгивания, упаривают содержимое чашки на песчаной бане до "влажных солей".
После охлаждения содержимое чашки растворяют в 1 мл раствора соляной кислоты с молярной концентрацией 1 моль и добавляют 1 мл раствора трилона Б с молярной концентрацией 0,1 моль, тщательно перемешивают и количественно переносят в мерную колбу вместимостью 25 мл. Содержимое колбы доводят до метки дистиллированной водой.
2.5. Подготовка проб к анализуНавеску почвы массой не менее 2г (результат взвешивания записывают до второго десятичного знака) помещают в реакционную емкость равномерно смачивают несколькими каплями дистиллированной воды и добавляют (5 - 7) мл концентрированной азотной кислоты и выдерживают при комнатной температуре не менее 30 - 40 мин. Затем в реакционные емкости добавляют 0,5 мл концентрированного пероксида водорода .Полученный раствор из реакционной емкости количественно переносят дистиллированной водой в мерную колбу объемом 25 мл через бумажный фильтр, промытый предварительно горячей дистиллированной водой. Осадок кремниевой кислоты промывают на фильтре несколькими порциями дистиллированной воды, после чего содержимое колбы охлаждают до комнатной температуры, доводят до метки и перемешивают.
В полученном растворе определяют содержание тяжелых металлов и токсичных элементов.
Пробу минерализата, объемом 5 мл пипеткой, объемом 5 мл переносят в фарфоровую чашку объемом (25 - 50) мл и упаривают на песчаной бане, не допуская разбрызгивания, до удаления паров азотной кислоты («влажных солей»). После охлаждения содержимое чашки растворяют в 1 мл раствора соляной кислоты с молярной концентрацией 1 моль /л. Содержимое чашки раствором фонового электролита количественно переносят в мерную колбу объемом 25 мл и доводят объем раствора до метки раствором фонового электролитa.
2.6. Порядок измерений
В соответствии с программой «Polar 4.0» анализатора устанавливают значения параметров измерений и регистрируют вольтамперограммы соответствующего элемента для каждого раствора серии (фон, проба, проба с добавками). Рекомендуется для каждого из растворов серии регистрировать не менее трех вольтамперограмм.Вольтамперограммы для каждого раствора серии (фон, проба или проба с добавками) усредняют. В/А, отличающиеся по высоте пика определяемого элемента между собой более чем на 20% удаляют.
2.6.1. Регистрация вольтамперограмм растворафонового электролита (фона)В стекло-углеродный тигель пипеткой объемом 20 см3 помещают 20 см3 раствора фонового электролита, закрепляют на подставке-держателе анализатора, устанавливают параметры измерений и регистрируют вольтамперограммы цинка, свинца и меди.
2.6.2. Регистрация вольтамперограмм пробыПробу объемом 20 мл, подготовленную к измерениям по 2.5, пипеткой объемом 20 мл помещают в стеклоуглеродный тигель и закрепляют его на подставке-держателе анализатора. Регистрируют вольтамперограммы по 2.6.1.
2.6.3. Регистрация вольтамперограмм пробыс растворами-добавками ионов серебра, свинца и меди.После регистрации вольтамперограмм пробы в стеклоуглеродный тигель дозатором пипеточным переменного объема вносят раствор-добавку соответствующего иона, приготовленный по 2.3.5, и регистрируют вольтамперограммы по 2.6.1.
2.6.4.. Очистка электродовПо окончании работы электроды тщательно промывают дистиллированной водой: рабочий электрод (АКУ-1) очищают механически сухой фильтровальной бумагой, а затем бумагой, смоченной спиртом этиловым. При необходимости электрод шлифуют окисью алюминия, затем промывают дистиллированной водой и высушивают фильтровальной бумаги. Электрод сравнения помешают в емкость с насыщенным раствором хлорида калия.
Выводы по главе II
Изучив методику проведения измерений концентрации тяжелых металлов в почве, провели ряд опытов с целью определения содержания меди, свинца и цинка в почве. Пробы были взяты на автодороге Уфа-Янаул, на участке между дорожной развязкой и КПП в районе д. Баженово. Работа проводилась на прорграмно-аппаратном комплексе “Polar-4.0”
Проведя анализ проб можно сделать вывод что концентрации изучаемых элементов в почве придорожной полосы не превышает ПДК. Что можно объяснить тем, что данная автодорога имеет не большую загруженность и улучшением качества используемого бензина.
ГЛАВА III. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ И
ВЫВОДЫ ПО РАБОТЕ
3.1. Содержание цинка, свинца и меди в районе АЗС
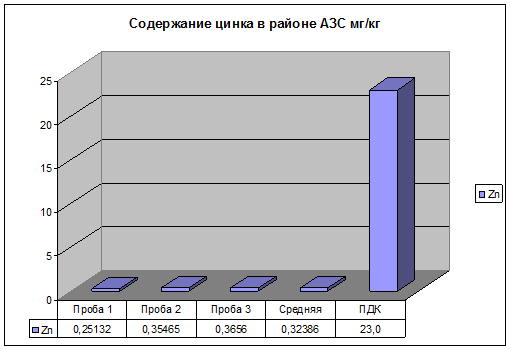
Рис. 11. Содержание цинка в районе АЗС.
![]()
Рис.12. Содержание меди в районе АЗС.
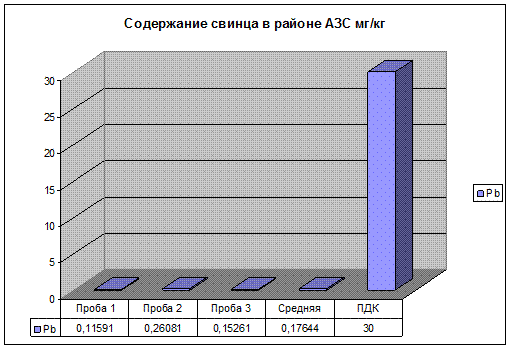
Рис. 13. Содержание свинца в районе АЗС.
После проведения эксперимента, результаты которого представлены на рис.11, 12, 13. Можно сделать вывод, что концентрация, изучаемых элементов значительно меньше ПДК. Это можно объяснить тем, что пробы отбирались на ровном участке автодороги. В связи с этим нагрузка на двигатель автомобилей не большая, топливо сгорает полностью и выброс загрязняющих веществ в атмосферу минимален.
3.2. Содержание цинка, свинца и меди у начала подъема
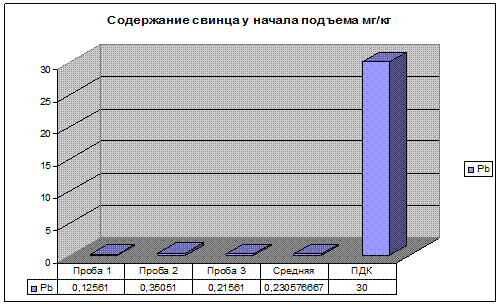
Рис 14.Содержание свинца у начала подъема.

Рис 15. Содержание цинка у начала подъема.
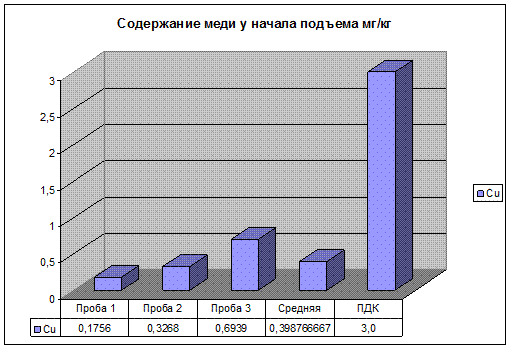
Рис 16. Содержание меди у начала подъема.
Результаты анализов, показанные на рис.14, 15, 16 свидетельствуют о том, что концентрация изучаемых элементов находятся в пределах ПДК. Но стоит заметить, что концентрация несколько больше чем на первом участке, так как перед предстоящим подъемом автомобиль набирает скорость а, следовательно, увеличивается нагрузка на двигатель автомашины. Происходит не полное сгорание топлива и увеличивается выбросы в окружающую среду вредных веществ.
3.3.Содержание цинка, свинца и меди на середине подъема
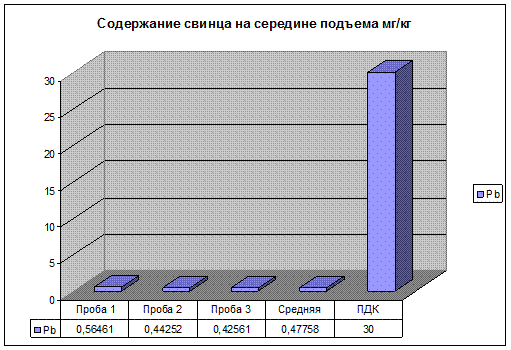
Рис. 17. Содержание свинца на середине подъема.
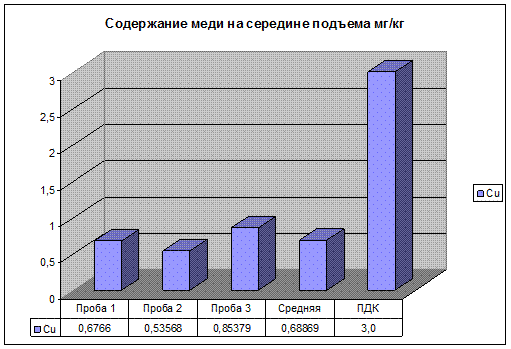
Рис 18. Содержание меди на середине подъема.
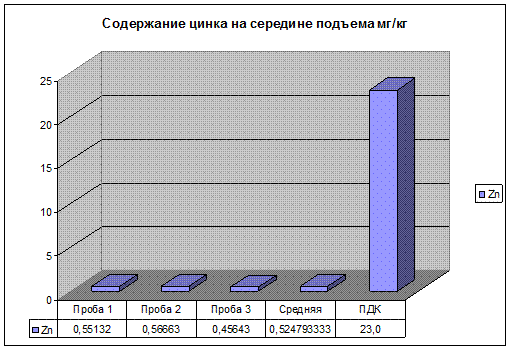
Рис 19. Содержание цинка на середине подъема.
Содержание цинка, свинца и меди, в пробе почвы взятой на середине подъема, находятся в пределах ПДК. Но несколько выше чем на первом и втором участках, это связано с тем что на середине подъема нагрузка на двигатель автомобилей максимальна. Следовательно, происходит не полное сгорание топлива, и увеличение как дымности, так и концентрации загрязняющих веществ в выхлопных газах автомобиля.
3.4.Содержание цинка, свинца и меди на вершине подъема
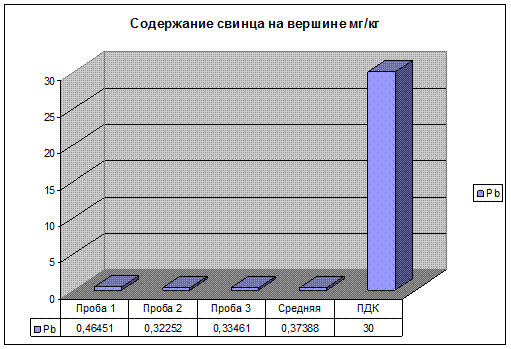
Рис.20. Содержание свинца на вершине.
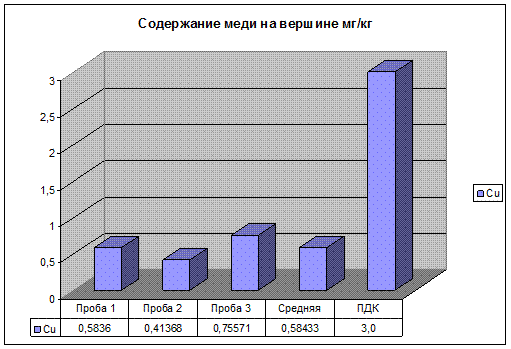
Рис. 21. Содержание меди на вершине.
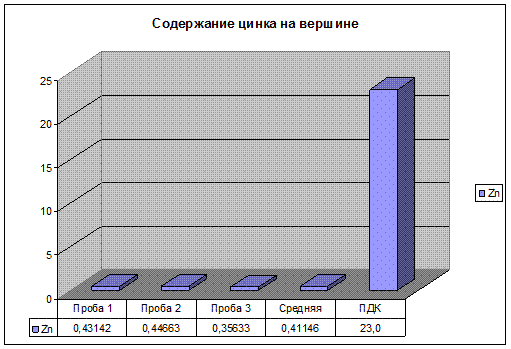
Рис. 22. Содержание цинка на вершине.
Содержание Zn, Pb, на вершине подъема, значительно ниже уровня ПДК. Содержание Cu находится в пределах допустимых значений. И ниже чем на третьем участке, так как, автомобиль снижает скорость перед прямым участком автодороги и, следовательно, снижается нагрузка на двигатель. Так же идет на спад содержание тяжелых металлов в выхлопных газах.
Вывод к главе III
Изучив количественное содержания меди, свинца и цинка, на исследуемом участке автодороги Уфа-Янаул. Можно сделать вывод, что содержание тяжелых металлов находится в пределах ПДК. Наивысшая концентрация наблюдается на середине подъема, это можно объяснить тем, что на данном участке наибольшая нагрузка на двигатель автомобиля, и, следовательно увеличивается выброс токсических веществ в атмосферу, откуда они попадают в почву. Минимальная концентрация изучаемых элементов наблюдается на первом участке, в районе автозаправочной станции, так как она находится на прямом участке дороги. А при движении по прямой и на постоянной скорости выхлопные газы содержат относительно не большое количество загрязняющих веществ, по сравнению с другими режимами езды.
Заключение
В ходе выполнения экспериментальной работы на тему: «Содержание тяжелых металлов вдоль автодорог», была изучена и проанализирована научно-методическая литература. Освоена методика отбора, приготовления и анализа проб почвы.
В ходе выполнения экспериментальной части, изучена методика измерения массовой доли тяжелых металлов при помощи программно-аппаратного комплекса, с использованием программного обеспечения “Polar-4.0”.
В соответствии с поставленными целями и задачами, были проведены примерно 40 измерений, а именно на каждый элемент в 3 повторностях, с предоставлением среднего результата.
Проведенные эксперименты позволяют сделать вывод, что содержание тяжелых металлов в придорожной полосе трассы республиканского значения Уфа-Янаул, на участке от дорожной развязки «кольцо» до КПП в районе д. Баженово, не превышает предельно допустимых значений для каждого элемента.
Наименьшая концентрация, исследуемых элементов зарегистрирована на первом участке в районе АЗС «Башнефть», что может быть объяснено тем, что данный участок дороги ровный, автомобили едут с постоянной скоростью, а большая часть автомашин только начинает движение после заправки.
На втором участке наблюдается рост содержания тяжелых металлов в придорожной полосе, по сравнению с участком в районе АЗС, так как перед предстоящим подъемом автомобиль начинает двигаться с ускорением. Наибольшая концентрация наблюдается на участке №3 на середине подъема, что связано с максимальной нагрузкой на двигатель автомашины, топливо полностью не сгорает и повышается общая дымность и концентрация элементов в выхлопных газах. На вершине подъема содержание, изучаемых элементов несколько снижается, по сравнению с участком №3, но все же превышает концентрацию тяжелых металлов на участке №2, у начала подъема. Это может быть объяснено тем, что нагрузка на двигатель снижается при приближении вершины, и далее следует ровный участок дороги.
В целом проведенные исследования показали что почва в придорожной полосе загрязнена не значительно, концентрации тяжелых металлов не превышают ПДК. И территория может использоваться для хозяйственных нужд.
Следует отметить, что при сохранении существующего темпа научно-технического процесса. Содержание тяжелых металлов в почвах будет несколько увеличиваться, это связано с увеличением числа автомашин в личном пользований и у предприятий осуществляющих перевозку грузов. Поэтому уже сегодня нужно стремится к уменьшению выбросов. Это может быть достигнуто следующими способами:
· использование не этилированного бензина
· преимущественное использование общественного транспорта
· замена автомобиля на велосипед.
Представленные результаты могут быть представлены к печати.
Литература
1. http://ru.wikipedia.org/wiki/Бирский_район. (10.05.2011).
2. www.zelenyshluz.narod.ru (1.02.2011).
3. Никифорова Л.О., Белопольский Л.М. Влияние тяжелых металлов на процессы биохимического окисления органических веществ. М. 2009 г.
4. Давыдова С.Л., Тагасов В.И. Тяжёлые металлы как супертоксиканты XXI века – М.: РУДН, 2002 г.
5. http://optisalt.ru (10.04.2011).
6. http://him.1september.ru (10.04.2001).
7. Романов В.И., Романова Р.Л. Выбросы вредных веществ и их опасности для живых организмов. - М.: Физматкнига, 2009.
8. Дмитриев М.Т., Казнина Н.И., Пинигина И.А. Санитарно-химический анализ загрязняющих веществ в окружающей среде: Справочник. М.: Химия, 1999.
9. Стадницкий, Г.В. Экология / Г.В. Стадницкий. - СПб.: Химиздат, 2001
10. Человек и среда его обитания. Хрестоматия. Под ред. Г.В. Лисичкина и Н.Н.Чернова. М., Мир, 2003.
11. http://www.inmoment.ru (1.02.2010).
12. Некоторые вопросы токсичности ионов металлов. Под ред. Х. Зигель.- М.: Мир, 2002.
13. www.revolution.allbest.ru (3.03.2010).
14. http://Google. Ru / (20.02,2009 ).
15. Справ. изд./ Под ред. В.А. Филова и др. — Л.: "Химия",1989.
16. Котова Д.Л., Девятова Т.А., Крысанова Т.А., Бабенко Н.К., Крысанов В.А. Методы контроля качества почвы: Учебно-методическое пособие. Воронежский Государственный институт. 2007
17. А.С. Степановских. Экология. Курган: ГИПП "Зауралье", 2000.
18. Пинский Д.Л. Физико-химические аспекты мониторинга тяжелых металлов в почвах. /Региональный экологический мониторинг. – М.: Наука, 1993
19. Саст Ю.Е., Ревич Б.А., Янин Е.П. и др. Геохимия окружающей среды. М., 1990.
20. Худолей В.В., Мизгирев И.В. Экологически опасные факторы. – СПб, 1996.
21. Сизов А.П., Хомяков Д.М., Хомяков П.М. Проблемы борьбы с загрязнением почв и продукции растениеводства. М., 1990
22. http://www.agrovodcom.ru (2.10.2009).
23. Вредные химические вещества. Неорганические соединения V-VIII групп: Справ. изд./ Под ред. В.А. Филова и др. — Л.: "Химия",1989.
24. Перечень ПДК И ОДК химических веществ в почве (утв. Минздровом СССР 19.11.1991 N 6229-91) (по состоянию на 7 октября 2006 года).
25. http://www.dioxin.ru/doc/gn2.1.7.2041-06.htm (10.12.2009).
26. Мотузова Г.В. Химия тяжелых металлов, мышьяка и молибдена в почвах. – М.: Изд-во МГУ, 1995.
27. Миркин Б.М., Наумова Л.Г. Экология для устойчивого развития Башкортостана. Уфа, 2006.
28. Дмитриев М.Т., Казнина Н.И., Пинигина И.А. Санитарно-химический анализ загрязняющих веществ в окружающей среде: Справочник. М.: Химия, 1999.
29. Пинский Д.Л. Физико-химические аспекты мониторинга тяжелых металлов в почвах. /Региональный экологический мониторинг. – М.: Наука, 1993 С.
30. http://msuee.ru/science/1/sb-07/sb-07_1_3.html (12.06.2010).
31. http://www.agrovodcom.ru/zz_metall.html (12.06.2010).
Приложение 1
Глоссарий
А
Астеновегетативный синдром – состояние, характеризующееся раздражительностью, слабостью, повышенной утомляемостью, учащением пульса.
Антагонизм – (греч., то есть противодействие) — означает действие тех приспособлений в живом организме, в силу которых деятельность одного органа идет наперерез деятельности другого и даже более или менее совершенно подавляет ее.
Адсорбция – процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).
Адсорбционная способность – способность твёрдого вещества — неподвижной фазы — сорбировать примеси, находящиеся в подвижной фазе.
Б
Биота – исторически сложившаяся совокупность видов живых организмов, объединённых общей областью распространения в настоящее время или в прошедшие геологические эпохи.
Биоаккумуляция – накопление организмом химических веществ поступающих из окружающей среды в концентрации большей, чем находится в окружающей среде. Часто используется для обозначения накопления именно загрязняющих веществ
Балки – (суходол, байрак, лог) — небольшая сухая или с временным водотоком долина с задернованными склонами.
Болезнь Минамата – болезнь человека, проявляющаяся в основном в виде нервно-паралитич. расстройств
Буферность – свойство почвы препятствовать изменению её реакции (pH) под действием кислот.
Бионакопление(см. Биоаккумуляция )
Биомагнификация или Биологическое усиление (в экологии)— увеличение концентрации химических веществ на каждой ступени экологической пирамиды, связанное с тем, что количество поглощаемой организмом пищи намного превышает его собственную массу, а химические вещества выводятся из организма не полностью
В
Водораздел – условная топографическая линия на земной поверхности, разделяющая водосборы двух или нескольких рек, озёр, морей или океанов, направляя сток атмосферных осадков по двум противоположным склонам.
Д
Диффузия – процесс перемешивания (взаимного проникновения) двух веществ, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объём
Детоксикация – Процесс, при котором токсические вещества удаляются с обрабатываемой поверхности или происходит их нейтрализация
И
Инактивация – частичная или полная потеря биологически своей активности.
К
Карстовые воронки – карстовая форма рельефа, представляющая собой естественную впадину, провал, котловину, сенот, яму большого размера в земной поверхности, вызванную вымыванием водами почвы или коренной подстилающей породы, а зачастую и того, и другого.
Канцероген – химическое (вещество) или физическое (излучение) воздействие на организм человека или животного, повышающее вероятность возникновения злокачественных новообразований (опухолей
Коллоиды – система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер от 1 до 1000 нм,
Коэффициент биоаккумуляции – обобщенный показатель, используемый в эко токсикологии для характеристики способности живых организмов концентрировать вредные вещества. Выражается отношением концентрации вещества в организме к концентрации в окружающей среде.
М
Мелиоранты – это вещества, позволяющие не только вносить «в запас» необходимые элементы питания, но и значительно улучшающие агрохимические характеристики и плодородие почвы, позволяющие провести ускоренное окультуривание садового участка.
Миграция – перемещение, перераспределение химических элементов в земной коре и на её поверхности.
П
Предельно допустимая концентрация (ПДК) – такая концентрация химических элементов и их соединений в окружающей среде, которая при повседневном влиянии в течение длительного времени на организм человека не вызывает патологических изменений или заболеваний, устанавливаемых современными методами исследований в любые сроки жизни настоящего и последующего поколений.
Пойма – часть речной долины, затопляемая в половодье или во время паводков.
Период полувыведения – время, в течение которого концентрация препарата в организме снижается на 50 %.
С
Синергия – суммирующий эффект взаимодействия двух или более факторов, характеризующееся тем, что их действие существенно превосходит эффект каждого отдельного компонента в виде их простой суммы.
Смог – аэрозоль, состоящий из дыма, тумана и пыли, один из видов загрязнения воздуха в крупных городах и промышленных центрах
Суспензией – смесь веществ, где твёрдое вещество распределено в виде мельчайших частичек в жидком веществе во взвешенном (неосевшем) состоянии
Т
Тяжелые металлы – группа химических элементов со свойствами металлов (в том числе и полуметаллы), имеющие атомный вес больше 50 а.е., и плотность более 8г/см3.
Токсичность – способность вещества вызывать нарушения физиологических функций организма, в результате чего возникают симптомы интоксикаций (заболевания), а при тяжелых поражениях - его гибель.
Тонкодисперсные твердые аэрозоли – устойчивая дисперсная система, состоящая из мелких твёрдых частиц, находящихся во взвешенном состоянии в газах, с размерами твёрдых частиц от 10−7 до 10−5 м
Ф
Фитомелиорация – комплекс мероприятий по улучшению условий при-родной среды с помощью культивирования или поддержания естественных растительных сообществ.
Фоновая концентрация – содержание веществ в воздухе, воде, иных компонентах окружающей среды, определяемое космическими, глобальны-ми, региональными, местными естественно происходящими процессами.
Фиброзные изменения. Фиброз — уплотнение соединительной ткани с по-явлением рубцовых изменений в различных органах
Э
Эссенциальные химические элементы – химические элементы присутствуют в столь малых количествах, что их называют следовыми элементами. Эта группа включает переходные металлы железо (Fe), цинк (Zn), медь (Сu), кобальт (Со) и марганец (Мn)
Эретизм – повышенная нервно-психическая возбудимость и раздражительность.
Экстрагенты – вещества, способные избирательно извлекать отдельные компоненты из твердых материалов (при выщелачивании либо экстрагировании) или жидких смесей (при жидкостной экстракции).
Электромелиорация – способ мелиорации засоленных и солонцовых п. с использованием электрического тока путем наложения поля постоянного тока в период промывок или полного насыщения почвы влагой.
Эмиссия – выброс в атмосферу с отработавшими газами авиационных двигателей прямых и побочных продуктов сгорания топлива, которые могут быть причиной нежелательного воздействия на окружающую среду.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.