

Число известных органических соединений (около 6 млн) значительно превышает число соединений всех остальных элементов периодической системы Менделеева.
Органические вещества имеют исключительное значение как вследствие их крайне многообразного практического применения, так и потому, что они играют важнейшую роль в процессах жизнедеятельности организмов.
Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических, вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
Первая теория в органической химии — теория радикалов. Согласно теории радикалов органические вещества состоят из «неизменяемых» групп атомов, получивших название радикалов. Радикалы при химических реакциях в неизменном виде переходят из молекулы одного вещества в молекулу другого, подобно тому как переходят из молекулы в молекулу атомы элементов.
Теория типов подчеркивала, что в реакциях органических веществ обнаруживается сходство с реакциями простейших неорганических соединений. Органические вещества предлагалось рассматривать образовавшимися из простейших неорганических веществ замещением в последних одного или нескольких атомов на разные органические группы, названные «остатками» (чтобы не употреблять отвергнутого слова «радикал»).
1. Атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностью.
2. Атомы в молекулах органических веществ соединяются между собой в определенной последовательности, что обуславливает химическое строение молекулы.
3. Свойства органических соединений зависят не только от числа и природы входящих в их состав атомов, но и от химического строения молекул.
4. В молекулах существует взаимное влияние атомов как связанных, так и непосредственно друг с другом не связанных.
5. Химическое строение вещества можно определить в результате изучения его химических превращений и, наоборот, по строению вещества можно характеризовать его свойства.
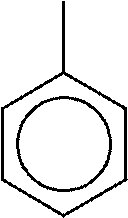
 УГЛЕРОД
УГЛЕРОДАтомы углерода способны соединяться друг с другом в цепи различного строения.
 Наиболее
важными считаются соединения углерода и водорода
Наиболее
важными считаются соединения углерода и водорода
(углеводороды), остальные классы органических веществ – их производные.
 Теория строения органического
вещества позволяет сделать вывод относительно углерода в связи с его положением в
+6
периодической
системе:
Теория строения органического
вещества позволяет сделать вывод относительно углерода в связи с его положением в
+6
периодической
системе:
![]()
![]()
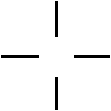
 1.Углерод
четырехвалентен 1s2 2s2р2
1.Углерод
четырехвалентен 1s2 2s2р2
|
|
|
|
2.Все валентности атома углерода равнозначны и размещены симметрично
CH3CH
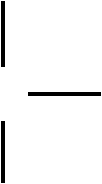 CH3 H3C
CH3 H3C  C CH3 H2C
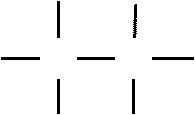
C CH3 H2C3. Атомы углерода способны образовывать связи друг с другом
CH3 CH3
CH3 CH3 CH3 CH3 CH3 C C
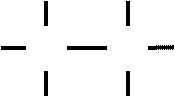
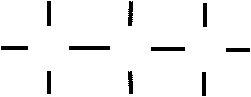
 H3CCH3 H3C C C CH3 H3C C C C CH3 C C
H3CCH3 H3C C C CH3 H3C C C C CH3 C C
H3CCH3
CH3 CH3
4. Атомы углерода способны образовывать кратные связи
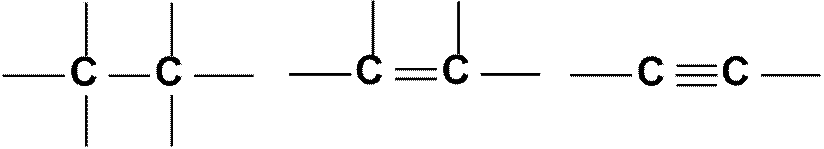
одинарные двойные тройные
ОСНОВНЫЕ ТЕРМИНЫ ОРГАНИЧЕСКОЙ ХИМИИ
Органогены – химические элементы, входящие в состав органических молекул
1.Углерод (валентность 4) 5. Фосфор (валентность 5)
2.Водород (валентность 1) 6. Сера (валентность 2)
3.Кислород (валентность 2) 7. Галогены (валентность 1) 4.Азот (валентность 3 и 4)
Углеродный скелет (углеродная цепь) – это последовательность всех химически связанных
между собой атомов углерода
![]()
![]() OHOH
OHOH
![]() Br
Br ![]() C
C![]() C
C ![]() Cl Br
Cl Br![]() C
C![]() C
C![]() Cl
Cl
HH![]()
Функциональная группа – атом или группа атомов, определяющая принадлежность соединения к данному классу и ответственная за его химические и физические свойства
|
Название классов органических веществ |
Функциональная группа |
Название функциональной группы |
|
Спирты |
-ОН |
гидроксильная |
|
Альдегиды |
-СОН |
альдегидная |
|
Карбоновые кислоты |
-СООН |
карбоксильная |
|
Нитросоединения |
-NO2 |
нитрогруппа |
|
Кетоны |
-СО- |
карбонильная |
|
Амины |
-NH2 |
аминогруппа |
|
Аминокислоты |
-NH2, -COOH |
карбоксильная и аминогруппа |
Радикал – фрагмент молекулы, обладающий единицей
свободной валентности
CH3
 H H H H
H H H H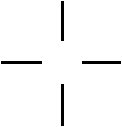
 H
C H H C C H H
C H
H
C H H C C H H
C H
![]() CH3 H
HO
CH3 H
HO
CH3
метил этил метокси фенил


Тривиальная
(историческая) номенклатура — первая
номенклатура, возникшая в начале
развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим
соединениям давали случайные
названия по источнику получения
(щавелевая кислота, яблочная кислота, ванилин), цвету или запаху
(ароматические соединения), реже
— по химическим свойствам
(парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, уксусная кислота, масляная кислота, гликоль, аланин и многие другие.
Рациональная номенклатура этой номенклатуре за основу — по Систематическая номенклатураноменклатура IUPAC — —
 международная
единая химическая наименования органического номенклатура. Систематическая
соединения обычно принимают номенклатура основывается на название наиболее
простого (чаще современной теории строения и всего первого) члена данного
классификации органических гомологического ряда. Все соединений и пытается
решить остальные соединения главную проблему номенклатуры: рассматриваются как
производные название каждого органического этого соединения, образованные
соединения должно содержать замещением в нем атомов водорода правильные
названия функций углеводородными или иными
международная
единая химическая наименования органического номенклатура. Систематическая
соединения обычно принимают номенклатура основывается на название наиболее
простого (чаще современной теории строения и всего первого) члена данного
классификации органических гомологического ряда. Все соединений и пытается
решить остальные соединения главную проблему номенклатуры: рассматриваются как
производные название каждого органического этого соединения, образованные
соединения должно содержать замещением в нем атомов водорода правильные
названия функций углеводородными или иными
(заместителей) и основного скелета радикалами (например: углеводорода и должно быть таким, триметилуксусный альдегид, чтобы по названию можно было метиламин, хлоруксусная кислота, написать единственно правильную метиловый спирт). структурную формулу.
|
Класс |
Функциональная группа |
Название |
|
|
в префиксе |
в суффиксе |
||
|
Карбоновые кислоты |
-СООН |
карбокси- |
-овая кислота |
|
Сульфоновые кислоты |
-SO3H |
сульфо- |
-сульфокислота |
|
Амиды |
-CONH2 |
карбомоил- |
-карбоксамид, -амид |
|
Нитрилы |
-C≡N |
циано- |
-нитрил, -цианид |
|
Альдегиды |
-C(О)H |
оксо- |
-аль |
|
Кетоны |
-C(O)- |
оксо- |
-он |
|
Спирты, фенолы |
-OH |
гидрокси-, окси- |
-ол, -овый спирт |
|
Амины |
-NH2 |
амино- |
-амин |
|
Галогенопроизводные |
F Cl Br I |
фторхлор- бромйод- |
фторид хлорид бромид иодид |
|
Нитрозосоединения |
-NO |
нитрозо- |
- |
|
Нитросоединения |
-NO2 |
нитро- |
- |
|
Диазосоединения |
-N2+ |
диазо- |
диазоний |
|
Сложные эфиры |
-COOR |
алкил(арил)оксикарбонил- |
-оат, карбоксилат |
1. Выбрать самую длинную углеродную цепь.
2. Пронумеровать ее с той стороны, к которой ближе радикалы, или старший заместитель, или кратная связь ( в зависимости от класса вещества).
3. Указать в префиксе положение (номер атома углерода) и название радикала, заместителя, функциональной группы в алфавитном порядке.
4. Записать корень, соответствующий числу атомов углерода в главной цепи.
5. Указать суффикс, если есть соответствующие функциональные группы.
6. Если в веществе несколько одинаковых радикалов, заместителей, связей или функциональных групп, то они называются вместе, с использованием числительных: 2 - ди, 3 – три, 4 – тетра и т.д.
7. При написании названия все цифры отделяются друг от друга запятыми, а от букв – дефисами.
Суффикс у ациклических углеводородов (алканов) –ан.
1 2 3 4 5 6 7 6 5 4 3 2 1
![]()
![]() CH3
CH CH CH2 CH CH3 CH3
CH3
CH CH CH2 CH CH3 CH3
![]() CH2 CH
CH CH CH CH3
CH2 CH
CH CH CH CH3
 CH3
CH3 CH3 CH3
CH2
CH3
CH3
CH3
CH3 CH3 CH3
CH2
CH3
CH3
(но не 2,4,52,3,5-триметилгексан-триметилгексан) CH2
![]() CH2
CH2
![]() CH3
CH3
2,3,5-триметил-4-пропилгептан
Суффикс у этиленовых углеводородов (алкенов) –ен.
5 4 3 2 1 6 5 4 3
![]()
![]() CH3
CH3
![]() CH2 CH
CH
CH2 CH
CH![]() CH2 CH3
CH
CH2
CH
CH2
CH2 CH3
CH
CH2
CH
CH2
![]() CH2
CH2![]() CH3
CH3
CH3 CH3 CH2 CH1 2
3-метилпентен-1 5-метил-3-пропилгексен-1
(или 3-метил-1-пентен) (или 5-метил-3-пропил-1-гексен)
Для углеводорода CH2=CH2 сохраняется несистематическое название – этилен.
Суффикс у ацетиленовых углеводородов (алкинов) –ин.
1 2 3 4 5 1 2 3 4 5
![]()
![]()
![]() HC
C CH2
HC
C CH2 ![]() CH2
CH2 ![]() CH3 HC
C CH2 CH CH3
CH3 HC
C CH2 CH CH3
(или 1-пентин)
4-метилпентин-1 Для углеводорода CH≡CH сохраняется несистематическое (или 4-метил-1-пентин) название – ацетилен.
1 2 3 4 5 6 1 2 3 4 5
![]()
![]() CH3 CH CH CH CH2
CH3 CH CH CH CH2 ![]() CH3 CH3
CH3 CH3 ![]() CH
CH![]() CH CH CH3
CH CH CH3
Cl Cl CH3 Br
![]()
![]() 4-метил-2,3-дихлоргексан CH1 2 CH2 CH3 2 4-бромпентен-2
4-метил-2,3-дихлоргексан CH1 2 CH2 CH3 2 4-бромпентен-2
Br I Cl
1-бром-2-иод-3-хлорпропан
Суффикс у спиртов и фенолов –он.
5 4 3 2 1 2 1 4 3 2 1
![]()
![]()
![]()
![]()
![]()
![]()
![]() CH3
CH CH2 CH CH3
CH3
CH2
CH
CH2OH CH3
CH
C CH2OH
CH3
CH CH2 CH CH3
CH3
CH2
CH
CH2OH CH3
CH
C CH2OH
3
 CH3 OH CH
OH5 6 CH3
CH3 OH CH
OH5 6 CH3
![]()
![]() (или 4-4метилпентанол-2 4CH2CH2CH3 2-метил-метилбутен-2-бутен-2--1-олол-1)
(или 4-4метилпентанол-2 4CH2CH2CH3 2-метил-метилбутен-2-бутен-2--1-олол-1)
-метил-2-пентанол) 2- -1,3 (или 2
этилгександиол
Суффикс у альдегидов –аль, кетонов –он или -дион
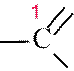 OO
OO
6 5 4 3 27 6 5 4 3 2
![]()
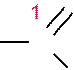
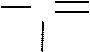
![]()
![]()
![]()
![]()
![]() CH3
CH2
CH2
CH
CH2
C CH3
CH2
C CH CH2
CH2
CH3
CH2
CH2
CH
CH2
C CH3
CH2
C CH CH2
CH2
CH3 3-метилгексаналь 5-метилгептен-4-аль (или 5-метил-4-гептеналь)
5 4 3 2 1 5 4 3 2 1
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() CH2CH
CH2
CO
CH3 CH3
CO
CH2
CO
CH3
CH2CH
CH2
CO
CH3 CH3
CO
CH2
CO
CH3
пентен-4-он-2 2,4-пентандион (или пентандион-2,4)
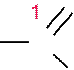
Суффикс у карбоновых кислот –овая кислота
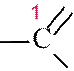 OO
OO
6 5 4 3 27 6 5 4 3 2
![]()
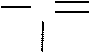
![]()
![]()
![]()
![]()
![]() CH3
CH2
CH2
CH
CH2
C CH3
CH2
C CH CH2
CH2
CH3
CH2
CH2
CH
CH2
C CH3
CH2
C CH CH2
CH2
CH3 CH3
3-метилгексаналь 5-метилгептен-4-аль (или 5-метил-4-гептеналь)
5 4 3 2 1 5 4 3 2 1
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() CH2CH
CH2
CO
CH3 CH3
CO
CH2
CO
CH3
CH2CH
CH2
CO
CH3 CH3
CO
CH2
CO
CH3
пентен-4-он-2 2,4-пентандион (или пентандион-2,4)
Приставка у нитросоединений нитро–, суффикс у аминов -амин
1 2 3 4 8 10
![]() CH3
CH
CH CH3 7
CH3
CH
CH CH3 7
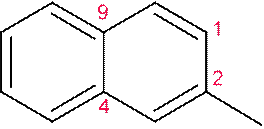
 NH
NHNO2 CH3 6
2-нитро-3-метилбутан 5 3 NO2 дифениламин
ГОМОЛОГИЯ И ГОМОЛОГИЧЕСКИЕ РЯДЫ В ОРГАНИЧЕСКОЙ ХИМИИ
Гомологи – вещества, расположенные в порядке возрастания относительных молекулярных масс, сходных
по строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп –СН2.
Гомологический ряд предельных углеводородов
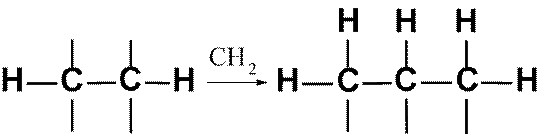 H H
H
H H
H
CH
 H C H
H C H ![]() 2
2
H H H H H H
CH4 С2Н6 С3Н8
![]()
CnH2n+2
Гомологический ряд предельных одноатомных спиртов
H H H H H H

 H C OH H C C OH H C C C
OH
H C OH H C C OH H C C C
OH
H H H H H H
CH4O C2H6O C3H8O
![]()
CnH2n+2O
Изомеры – это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение, а поэтому обладают разными свойствами.
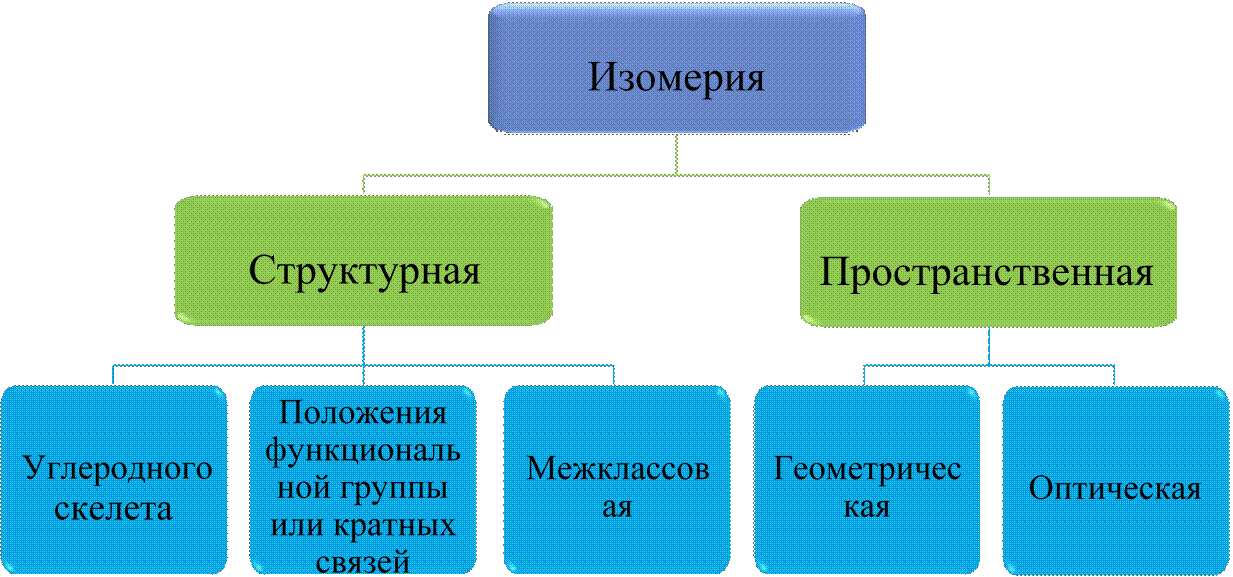
Изомерия углеродного скелета обусловлена различным
порядком связи атомов углерода
![]() пентан CH3
пентан CH3![]() CH
CH ![]() CH2
CH2 ![]() CH3
CH3
CH3
2-метилбутан
Изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеродного скелета
![]() CH3
CH3 ![]() CH2
CH2
![]() CH2
CH2 ![]() CH2
CH2
![]() OH CH3
OH CH3![]() CH
CH ![]() CH2
CH2
![]() CH3 OH
CH3 OH
H2C![]() CH
CH ![]() CH2
CH2
![]() CH3 CH3
CH3 CH3 ![]() CH
CH![]() CH
CH ![]() CH3
бутен-1 бутен-2
CH3
бутен-1 бутен-2
Межклассовая изомерия обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую
молекулярную формулу, но принадлежащих различным классам
![]()
![]() H2C
H2C![]() CH
CH ![]() CH2
CH2
![]() CH3 бутен-1 H2C
CH3 бутен-1 H2C![]() CH2 H2C
CH2 H2C![]() CH2
CH2
циклобутан
Геометрическая изомерия наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы

C![]() C C
C C![]() C
C

малеиновая кислота фумаровая кислота
(цис-1,2-этилен-дикарбоновая кислота) (транс-1,2-этилен-дикарбоновая кислота)
Оптическая изомерия возникает в тех случаях, когда два изомера, представляют собой зеркальное отражение друг друга. Таким свойством
обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя
 CH3CH3
CH3CH3
H COOH HOOC
COOH HOOC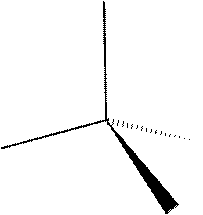 H
H
H2NNH2
Конформация – пространственная структура молекулы, изменение которой происходит без разрыва одних и образования других связей
Конформации (I-VI) различаются по устойчивости, т.е. обладают неодинаковой потенциальной энергией, величина которой определяется торсионным и вандерваалъсовым напряжениями.
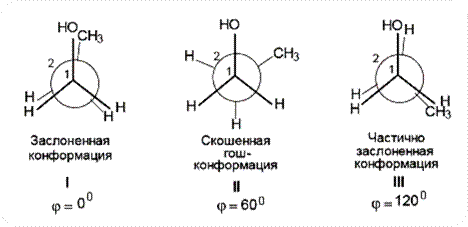
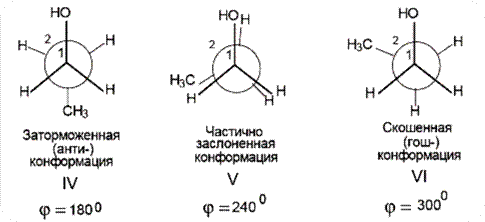 Торсионное
напряжение возникает в результате взаимодействия
электронов противостоящих связей, т.е. оно возникает в заслоненных конформациях
(I, III, V).
Торсионное
напряжение возникает в результате взаимодействия
электронов противостоящих связей, т.е. оно возникает в заслоненных конформациях
(I, III, V).
Ван-дер-ваальсовое напряжение появляется при достаточно близком расположении объемных заместителей и приводит к их взаимному отталкиванию.
Такой фактор неустойчивости присущ заслоненной и скошенной конформациям (I, II, VI). Таким образом, наиболее устойчива заторможенная (анти-) конформация (IV), в которой все виды напряжений минимальны.
Промежуточное положение занимают частично заслоненные (III и V) и скошенные (II и IV) конформации.
|
HOH CH2OH L-глицериновый альдегид
HOH CH3 L-молочная кислота |
H H |
OH CH2OH D-глицериновый альдегид
OH CH3 |
Для определения D- или L-ряда изомера конфигурацию (положение ОН–группы у асимметричного атома углерода) сравнивают с конфигурациями энантиомеров глицеринового альдегида (глицериновый ключ). |
|
D-молочная кислота |
|||
E, Z-НОМЕНКЛАТУРА
Для обозначения конфигурации указывают цис- (Z, от немецкого zusammen - вместе) или транс- (Е, от немецкого entgegen - напротив) расположение старших заместителей при двойной связи.
В Z,E-системе старшими считаются заместители с большим атомным номером. Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы, то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т.д.
17 7 7 17
|
(Е)-1-бром-1-хлор-2-нитроэтен |
(Z)-1-бром-2-хлор-1-нитроэтен |
![]()
![]()
![]()
![]() ClNO2 O2NCl
ClNO2 O2NCl
![]() Для
определения R- или Sконфигурации оптического изомера по проекционной формуле
необходимо путем четного числа перестановок расположить заместители так, чтобы
самый младший из них оказался внизу проекции. Падение старшинства остальных
трех заместителей по часовой стрелке соответствует Rконфигурации, против
часовой
Для
определения R- или Sконфигурации оптического изомера по проекционной формуле
необходимо путем четного числа перестановок расположить заместители так, чтобы
самый младший из них оказался внизу проекции. Падение старшинства остальных
трех заместителей по часовой стрелке соответствует Rконфигурации, против
часовой
стрелки - S-конфигурации
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.