
ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ДЕНСАУЛЫҚ САҚТАУ МИНИСТРЛІГІ
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ КАЗАХСТАН
ҚОСТАНАЙ ЖОҒАРЫ МЕДИЦИНАЛЫҚ КОЛЛЕДЖІ
КОСТАНАЙСКИЙ ВЫСШИЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ

Бекітемін
ОЖ жөніндегі директордың
орынбасары___________
20__ж. «____» _______
ДӘРІС КЕШЕНІ
ЛЕКЦИОННЫЙ КОМПЛЕКС
Пәнінен/Дисциплины/модуля: код "Химия"
Мамандығы/Специальность: 0305000 «Лабораторная диагностика»
Біліктілігі/Квалификация: 0305013 "Медицинский лаборант"
Курс/Курс: 1
Семестр/Семестр:
Жалпы сағат саны/Общая трудоемкость всего часов/кредитов KZ
Қостанай, 2021 ж.
Лекционный комплекс дисциплины/модуля составлен преподавателем Чапаксин И.В. бакалавр химии (ФИО, ученая степень, ученое звание)
На основании рабочей учебной программы по специальности
0302043 «Медицинская сестра общей практики»
Рассмотрен и рекомендован на заседании ЦМК 1
от «28 » августа 2020 г., протокол № _____
Председатель ЦМК ____________ ____________________
(подпись) ( ФИО )
Лекционный комплекс включает следующие разделы:
4.1. Тема.
4.2. Цель.
4.3. Тезисы лекции.
4.4. Иллюстративный материал.
4.5. Литература.
4.6. Контрольные вопросы (обратная связь)
|
№ |
Название этапа занятия |
Теоретическое занятие (лекция, комбинированное занятие, мин.) |
|
1 |
Организационный момент: а) организация рабочей обстановки на занятий б) определение целей и задач занятия |
15 минут |
|
2 |
Актуализация опорных знаний по пройденной теме (методы и приемы ) - тест |
20 минут |
|
3 |
Изложение нового материала (план лекции) А) Апробация полученных знаний по ПСХИ; Б) Применение ранее полученных знаний о строении вещества; В) С помощью программы ChemLab провести лабораторные опыты по ЗСМ, З-А, ЗПВ . |
125 минут |
|
4 |
Закрепление пройденного материала (методы и приемы): А) Собеседования; Б) Виртуальный лабораторный опыт; |
25 минут |
|
5 |
Итоговый этап занятия: а) оценивание учащихся б) задание на дом |
15 минут |
|
|
|
200 минут |
4.1. Тема: Основные классы неорганических веществ
4.2. Цель: изучить основные закономерности классов неорганических соединений
4.4. Иллюстративный материал:
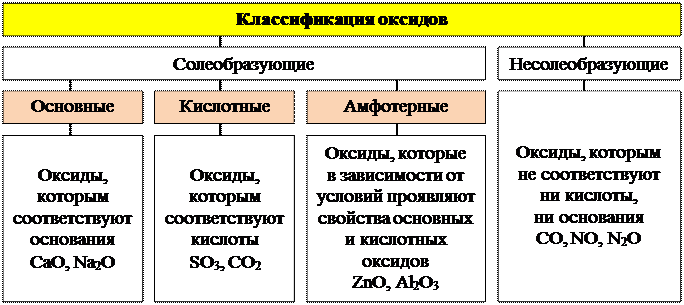
1. Оксиды
Оксиды – это сложные вещества, состоящие из атомов двух химических элементов, один из которых Оксиген.
 |
|
Номенклатура оксидов |
||
|
Валентность элемента, образующего оксид |
Правило составления названия оксида |
Пример |
|
Постоянная |
Название химического элемента + слово «оксид» |
CaO – кальций оксид ZnO – цинк оксид |
|
Переменная |
Название химического элемента + валентность (в скобках) + слово «оксид» |
CO2 – карбон (IV) оксид N2O – нитроген (I) оксид SO3 – сульфур (VI) оксид |
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Химические свойства основных оксидов
· Взаимодействуют с водой, если в результате реакции образуются щелочи.
CaO + H2O = Ca(OH)2
· Взаимодействуют с кислотами с образованием соли и воды.
CaO + H2SO4 = CaSO4 + H2O
· Взаимодействуют с кислотными оксидами с образованием соли.
CaO + CO2 = CaCO3
· Не взаимодействуют с основными оксидами и щелочами.
Химические свойства амфотерных оксидов
· Взаимодействуют с кислотами с образованием соли и воды.
ZnO + 2HCl = ZnCl2 + H2O
· Взаимодействуют со щелочами с образованием соли и воды.
ZnO + 2NaOH = Na2ZnO2 + H2O
· Взаимодействуют с кислотными оксидами с образованием соли.
ZnO + СO2 = ZnСO3
· Взаимодействуют с основными оксидами с образованием соли.
ZnO + СaO = CaZnO2
· Не взаимодействуют с водой.
Химические свойства кислотных оксидов
· Взаимодействуют с водой с образованием кислот.
SO2 + H2O = H2SO3 (исключение: SiO2 + H2O ≠)
· Взаимодействуют со щелочами с образованием соли и воды.
SO2 + Ca(OH)2 = CaSO3 + H2O
· Взаимодействуют с основными оксидами с образованием соли.
СaO + SO3 = CaSO4
· Не взаимодействуют с кислотами и кислотными оксидами.
ПОЛУЧЕНИЕ ОКСИДОВ
· Взаимодействие простых и сложных веществ с кислородом
2Mg + O2 = 2MgO
CH4 + 2O2 = CO2↑ + 2H2O
· Разложение оснований при нагревании
Fe(OH)2 ![]() FeO + H2O
FeO + H2O
· Разложение кислот при нагревании
4HNO3
![]() 4NO2↑ + 2H2O + O2↑
4NO2↑ + 2H2O + O2↑
· Разложение солей при нагревании
CaCO3 ![]() CaO + CO2↑
CaO + CO2↑
2Pb(NO3)2
![]() 2PbO + 4NO2 +
O2↑
2PbO + 4NO2 +
O2↑
· Разложение высших оксидов с образованием низших оксидов
4CrO3 = 2Cr2O3 + 3O2↑
· Окисление низших оксидов с образованием высших оксидов
2CO + O2 = 2CO2↑
· Вытеснение одних оксидов другими
Na2CO3
+ SiO2 ![]() Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
· Окислительно-восстановительные реакции
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
S + H2SO4 (конц.) = 3SO2↑ + 2H2O
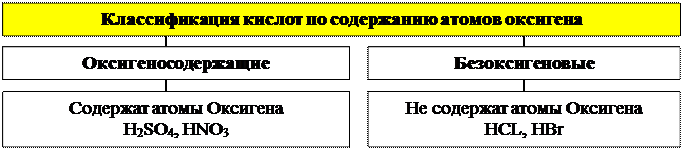
2. Кислоты
Кислоты – это сложные вещества, содержащие атомы Гидрогена, которые могут замещаться атомами металлических элементов, и кислотные остатки.

Ряд активности кислот
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HClO3 > H3PO3 >
сильные кислоты
H2SO3 > H3PO2 > HClO2 > H3PO4 > H3AsO4 > HF > HNO2 >
кислоты средней силы
CH3COOH > H2CO3 > H2S > HClO > H3BO3 > H2SiO3 > HIO
слабые кислоты
Ряд активности металлов
|
Li K Ca Na Mg Al Mn Zn Fe Ni Sn Pb |
(H2) |
Cu Hg Ag Pt Au |
![]()
направление уменьшения активности металлов
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
· Изменяют цвет индикаторов
Кислота + лакмус (фиолетовый) → красный
Кислота + метиловый оранжевый → розовый
· Взаимодействуют с основаниями (реакция нейтрализации) с образованием соли и воды
NaOH + HCl = NaCl + H2O
· Взаимодействуют с основными оксидами с образованием соли и воды
CuO + 2HCl = CuCl2 + H2O
· Взаимодействуют с металлами (если металлы стоят в ряду активности до Н2) с образование соли и водорода
2HCl + Zn = ZnCl2 + H2↑ исключения: HNO3, H2SO4 (конц.)
· Взаимодействуют с солями (если образуется осадок ↓ или газ ↑, соль более слабой или летучей кислоты) с образованием новой соли и новой кислоты
![]()
![]() 2HCl +
K2CO3 = 2KCl +
H2CO3
2HCl +
K2CO3 = 2KCl +
H2CO3 ![]()
ПОЛУЧЕНИЕ КИСЛОТ
· Взаимодействие кислотных оксидов с водой
SO3 + H2O = H2SO4
· Взаимодействие солей с кислотами (кислота, вступающая в реакцию, должна быть более сильной, чем та, которая образуется)
Na2SiO3 + H2SO4 = H2SiO3↓ + Na2SO4
· Окисление некоторых простых веществ
5HNO3 (разб.) + 3P + 2H2O = 5NO↑ + 3H3PO4
· Взаимодействие неметаллов с водородом
H2 + Cl2 = 2HCl
3. Основания
Основания – это сложные вещества, содержащие атомы металлического элемента (Ме) и одну или несколько гидроксогрупп (ОН).
Общая формула оснований:
![]() ,
,
где n – валентность металлического элемента.
 |
|
Номенклатура оксидов |
||
|
Валентность элемента |
Правило составления названия основания |
Пример |
|
Постоянная |
Название металлического элемента + слово «гидроксид» |
NaOH – натрий гидроксид Ca(OH)2 – кальций гидроксид |
|
Переменная |
Название металлического элемента + значение валентности металлического элемента (в скобках) + слово «гидроксид» |
Cu(OH)2 – купрум (II) гидроксид Fe(OH)2 – феррум (II) гидроксид |
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Растворимые основания (щелочи)
· Изменяют цвет индикаторов
NaOH + лакмус (фиолетовый) → синий
NaOH + метиловый оранжевый → желтый
NaOH + фенолфталеин (бесцветный) → малиновый
· Взаимодействуют с кислотами (реакция нейтрализации) с образованием соли и воды
2NaOH + H2SO4 = Na2SO4 + 2Н2O
· Взаимодействуют с кислотными оксидами с образованием соли и воды
2NaOH + SO3 = Na2SO4 + Н2O
· Взаимодействуют с амфотерными оксидами с образованием соли и воды
2NaOH + ZnO ![]() Na2ZnO2 + Н2O
Na2ZnO2 + Н2O
· Взаимодействуют с амфотерными гидроксидами:
а) с образованием соли: Zn(OH)2 + 2NaOH ![]() Na2[Zn(OH)4]
Na2[Zn(OH)4]
б) с образованием соли и воды: Zn(OH)2 + 2NaOH ![]() Na2ZnO2+2H2O
Na2ZnO2+2H2O
· Взаимодействуют с растворами солей (если образуется осадок ↓, или газ ↑) с образованием соли и воды
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
· Не разлагаются при нагревании
Нерастворимые в воде
· Не изменяют цвет индикаторов
· Взаимодействуют с кислотами (реакция нейтрализации) с образованием соли и воды
Cu(OH)2 + H2SO4 = CuSO4 + 2Н2O
· Взаимодействуют с некоторыми кислотными оксидами при нагревании с образованием соли и воды
Mg (ОН)2 + SiO2 ![]() MgSiOg + Н2O
MgSiOg + Н2O
· Не взаимодействуют с амфотерными оксидами, амфотерными гидроксидами и растворами солей
· Разлагаются при нагревании с образованием оксида и воды
Cu(OH)2 ![]() СuО + Н2O
СuО + Н2O
ПОЛУЧЕНИЕ РАСТВОРИМЫХ ОСНОВАНИЙ (ЩЕЛОЧЕЙ)
· Взаимодействие активных металлов с водой (щелочных и щелочноземельных)
2Na + 2Н2O = 2NaOH + Н2↑
· Взаимодействие основных оксидов с водой (только оксиды щелочноземельных и щелочных металлических элементов)
ВаО + Н2O = Ва(ОН)2
· Взаимодействие соли со щелочью (если образуется нерастворимая соль)
Na2SO4 + Ва (ОН)2 – BaSO4↓+2NaOH
· Электролиз водных растворов солей Калия или Натрия
2NaCl
+ 2Н2O ![]() Н2↑ + Cl2↑ + 2NaOH
Н2↑ + Cl2↑ + 2NaOH
ПОЛУЧЕНИЕ НЕРАСТВОРИМЫХ ОСНОВАНИЙ
· Взаимодействие солей со щелочами
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4
MgCl2 + 2KOH = Mg(OH)2↓ + 2KC1
Pb(NO3)2 + 2NaOH = Pb(OH)2↓ +2NaNO3
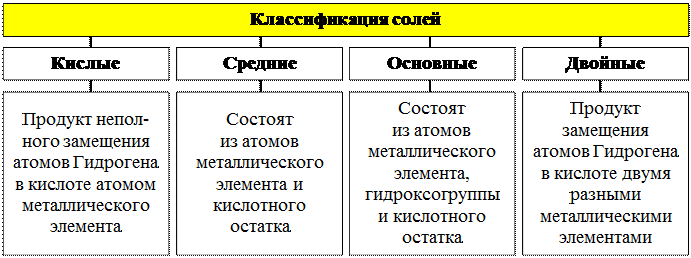
4. Соли
Соли – это сложные вещества, содержащие ионы металлических элементов и кислотные остатки.
|
Номенклатура кислых солей |
|
|
Правило составления названий кислых солей |
Пример |
|
Название металлического элемента + слово «гидроген» («дигидроген») + название кислотного остатка |
NaHSO4 – натрий гидроген сульфат NaH2PO4 – натрий дигидроген ортофосфат |
|
Номенклатура средних солей |
||
|
Валентность элемента |
Правило составления названия основания |
Пример |
|
Постоянная |
Название металлического элемента + название кислотного остатка |
K2SO3 – калий сульфит |
|
Переменная |
Название металлического элемента + валентность металлического элемента (в скобках) + название кислотного остатка |
CuSO4 – купрум (II) сульфат |
|
Номенклатура основных солей |
|
|
Правило составления названий кислых солей |
Пример |
|
Название металлического элемента + слово «гидроксид» + название кислотного остатка |
Mg(OH)Cl – магний гидроксид хлорид |
|
Номенклатура двойных солей |
|
|
Правило составления названий кислых солей |
Пример |
|
Название металлического элементов (по алфавиту) + название кислотного остатка |
KAl(SO4)2 – алюминий калий дисульфат |
ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
· Взаимодействуют с металлами (реакция замещения) при условиях:
- реагирующий металл активнее металла, который образовал соль;
- соль растворима в воде
CuSO4 + Fe = FeSO4 + Сu, FeSO4 + Сu ≠
· Взаимодействуют со щелочами (реакция обмена)
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
· Взаимодействуют с солями (реакция обмена) при условиях:
- реагирующие соли растворимы;
- одна из образовавшихся солей нерастворима
Na2SO4 + ВаСl2 = BaSO4↓ + 2NaCl
· Взаимодействуют с кислотами при условиях:
- реагирующая кислота сильнее, чем та, которая образовала соль;
- образуется газ ↑ или осадок ↓
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
![]() CaCO3 + 2НСl = СаСl2 +
H2CO3
CaCO3 + 2НСl = СаСl2 +
H2CO3 ![]() .
.
· Термическое разложение солей с образованием веществ более простого состава
СаСO3 ![]() СаО + СO2↑
СаО + СO2↑
Са(НСO3)2 ![]() CaCO3 +CO2↑+H2O
CaCO3 +CO2↑+H2O
NH4NO2 ![]() N2 + 2H2O
N2 + 2H2O
2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
· Взаимодействие металлов с кислотами
Mg + 2НС1 = MgCl2 + Н2↑
· Взаимодействие основных оксидов с кислотами
CuO + H2SO4 = CuSO4 + Н2O
· Взаимодействие оснований с кислотами
NaOH + НС1 = NaCl + Н2O
· Взаимодействие солей, с кислотами
СаСO3 + 2HNO3 = Ca(NO3)2 + Н2O + СO2↑
· Взаимодействие основных оксидов с кислотными
СаО + СO2 = СаСО3
· Взаимодействие щелочей с кислотными оксидами
2NaOH + СO2 = Na2CO3 + Н2O
· Взаимодействие солей с кислотными оксидами
СаСO3
+ SiO2 ![]() CaSiO3 + СO2↑
CaSiO3 + СO2↑
· Взаимодействие щелочей с солями
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
· Взаимодействие двух солей
ВаСl2 + Na2SO4 = BaSO4↓+2NaCl
· Взаимодействие металлов с солями
Рb + Hg(NO3)2 = Hg + Pb(NO3)2
· Взаимодействие металлов с неметаллами
2Fe + ЗСl2 = 2FeCl3
· Взаимодействие неметаллов с солями
Сl2 + 2KI = 2КСl +I2
· Термическое разложение солей
2KNO3
![]() 2KNO2
+ O2↑
2KNO2
+ O2↑
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
· Взаимодействие излишка кислоты со щелочами
NaOH + H2SO4 = NaHSO4 + Н2O
· Взаимодействие излишка кислоты с основными оксидами
СаО + 2H2SO4 - Са (HSO4)2 + Н2O
· Взаимодействие кислот и их средних солей
СаСO3 + Н2O + СO2 = Са(НСO3)2
· Взаимодействие щелочей с излишком кислотного оксида
Ва(ОН)2 +2СO2 = Ва(НСO3)2
Задания для закрепления:
1. Укажите кислоту, которая может образовывать кислые соли:
А) карбонатная кислота
Б) нитратная кислота
В)уксусная кислота
Г)хлоридная кислота
2. Укажите ряд кислот, в которых приведены только оксигенсодержащие кислоты:
А) сульфатная, нитратная, хлоридная
Б) флуоридная, сульфидная, бромидная
В)сульфитная, ортофосфатная, силикатная
Г)нитратная, сульфидная, фосфитная
3. Обозначьте классы веществ с которыми взаимодействуют кислоты:
А) кислотные оксиды
Б) основные оксиды
В)неметаллы
Г)металлы
Д) основания
Е) соли
4. Вычислите и обозначьте степень окисления Сульфура в алюминий сульфате Al2(SO4)3:
А) -2
Б) +6
В)+4
Г)+3
5. Укажите продукты реакции взаимодействия нитратной кислоты с кальций карбонатом:
А) кальций гидроген карбонат
Б) кальций нитрат, карбон(4) оксид и вода
В)карбоновая кислота и кальций гидрогенкарбонат
Г)кальций нитрат и натрий нитрат
6. Укажите вещества при взаимодействии которых образуется желтый осадок:
А) нитроген (2) оксид и кислород
Б) натрий йодид и аргентум нитрат
В)кальций силикат и нитратная кислота
Г)натрий сульфат и калий нитрат
7. Обозначьте ионы, которые обуславливают превращение окраски фенолфталеина в розовую:
А) гидроксид -ионы
Б) сульфат ионы
В) ионы гидрогена
Г) ионы кальция
8. Обозначьте вещество с которым реагирует натрий гидроксида:
А) кальций оксид
Б) калий сульфат
В)этанол
Г)кальций гидроксид
9. Укажите название элемента, образующего кислотные оксиды:
А) калий
Б) алюминий
В)сульфур
Г)магний
10. Обозначьте вещества, взаимодейсвующие с карбон(4) оксидом:
А) калий оксид
Б) калий нитрат
В)кальций нитрат
Г)кальций хлорид
Д) кислород
Е) калий хлорид
Ж) вода
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.