
План урока « Ацетилен, его строение, свойства, поучение, применение. Гомологический ряд ацетилена. Изомерия»
Цели:
1. познакомиться с гомологическим рядом, номенклатурой, и изомерией непредельных углеводородов ряда ацетилена;
2. рассмотреть физические и химические свойства на основе ранее полученных знаний о кратной связи и логической цепочки « состав – строение - свойства»;
3. выяснить области применения представителей данного класса органических веществ;
4. закрепить полученные знания;
5. Формирование представлений о химических свойствах ацетилена и его гомологов на основе строения;
6. Формирование информационно-коммуникативных компетенций учащихся при поиске информации, при работе с разными источниками информации;
7. Совершенствование умений и навыков учащихся в написании изомеров непредельных углеводородов, в составлении уравнений химических реакций для ацетилена и его гомологов.
Ход урока
I. Организационный момент
II. Основная часть
1. Алкины – это непредельные (ненасыщенные) углеводороды, с одной тройной углерод - углеродной связью С≡С в цепи и общей формулой СnH2n-2
2. Строение. Состав алкинов.
C2H6 C2H4 C2H2
На доске записаны формулы углеводородов. Чем они отличаются? Числом атомов водорода.
Первая формула принадлежит этану (предельному углеводороду), вторая этилену (непредельному углеводороду), а третья принадлежит еще более ненасыщенному соединению – ацетилену. Давайте составим структурные формулы этих углеводородов.
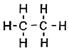
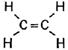
![]()
Сn H2n+2
CnH2n
CnH2n-2
Ацетилен еще более ненасыщенный угеводород, чем этан и этилен..
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н

Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
![]()
Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются.

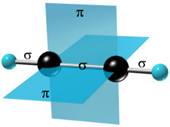
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ - и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
Запомните!
1. Длина связи 0,12 нм
2. Угол 180
3. Линейная молекула
4. Связи – σ и 2π
5. Sp- гибридизация
3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, с резким запахом, малорастворим в воде,
4. Изомерия и номенклатура
Структурная изомерия
1. Изомерия положения тройной связи (начиная с С4Н6):
![]()
2. Составить все возможные изомеры гексина.
3. Построить следующие структурные формулы алкенов:
а) 3метил пентин-1, б) 4,4диметил пентин-2, в) 2,5диэтилгексин-3
5.Химические свойства алкинов
1). Горение. Ацетилен горит светящимся пламенем и образует много копоти. Чем больше в горящем веществе углерода и чем меньше водорода, тем больше коптящего пламени получается. Часть углерода просто не успевает перевариться в углекислый газ и дает частицы сажи от которых пламя становиться светящимся.
2 С2Н2 + 5 О2 = 4СО2 + 2 Н2О
Реакции присоединения
2). Галогенирование
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
3). Гидрогалогенирование
* CH3-C≡CH + HBr AlBr3→ CH3-CBr=CH2
2-бромпропен
* - используется пр. Морковникова
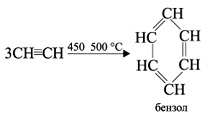
4). Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
Получение ацетилена.
Ацетилен химически активен, поэтому в природе не встречается. Его получают:
1. Из метана, тo есть основного компонента природного газа: 2СН4 → С2Н2+ 3H2
2.Ацетилен в лаборатории получают карбидным способом. В карбид кальция наливают дистиллированную воду и опускают газоотводную трубку в перманганат калия. Раствор обесцвечивается. CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Применение ацетилена.
1. Для сварки и резки металлов.
2. Из ацетилена поучают полихлорвинил из которого изготавливают новогодние искусственные елочки, искусственные кожи , клеенки, линолиум.
3. Ацетилен дешевое химическое сырье, из которого получают пластмассы, каучуки, резину, химические волокна.
4. Переработав ацетилен можно получить этиловый спирт, уксусную кислоту, растворители, ароматические углеводороды.
3. Обобщение и закрепление знаний: Закончите следующие фразы:
1 Алкины - это…
2. Общая формула алкинов…
3 Простейший алкин…
4. Связь в молекуле ацетилена между углеродными атомами…
5. Физические свойства ацетилена…
6. Характерные химические реакции алкинов…
7. Ацетилен применяется для…
Осуществить превращения:
Метан → Ацетилен → Этилен → Этан → Хлорэтан
4.Итоги
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.